


Alecensa (alectinib) er en kinasehæmmer beregnet til behandling af patienter med anaplastisk lymfomkinase (ALK)-positiv ikke-småcellet lungekræft (NSCLC).
Midlet er udviklet af Roche-koncernens medlem Genentech i samarbejde med Chugai Pharmaceutical.
Alecensa modtog den første godkendelse i Japan i juli 2014 og fra den amerikanske lægemiddelstyrelse (FDA) i december 2015.
Roche indsendte en ansøgning om markedsføringstilladelse til Det Europæiske Lægemiddelagentur (EMA) med henblik på godkendelse af Alecensa i september 2015.
Selskabet modtog i februar 2017 en betinget markedsføringstilladelse for Alecensa som monoterapi fra Europa-Kommissionen (EC) til behandling af ALK-positive, fremskredne NSCLC-patienter i voksen alder til behandling af ALK-positive, fremskredne NSCLC-patienter.
Disse patienter blev tidligere behandlet med crizotinib, et NSCLC-lægemiddel udviklet af Pfizer.
ALK-positiv avanceret NSCLC
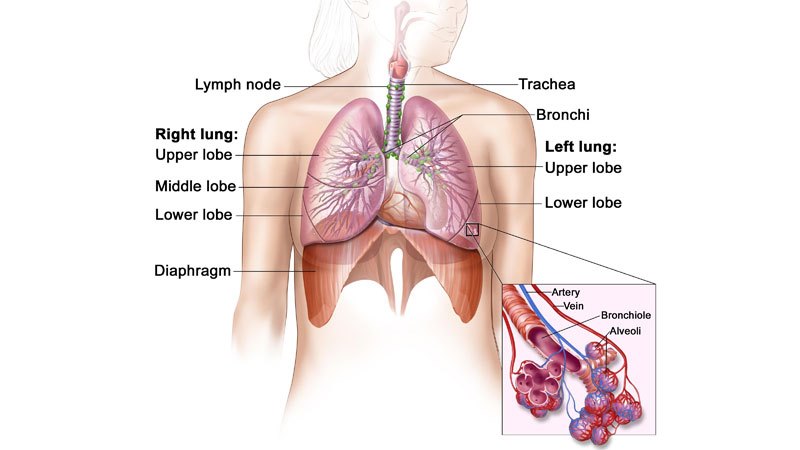
Non-småcellet lungekarcinom er den mest almindelige form for kræft og udgør mere end 85 % af lungekræftformerne. NSCLC medfører, at ca. 1,59 millioner mennesker dør hvert år på verdensplan.
Sygdommen opstår, når celler i lungen bliver unormale og begynder at udvikle sig ukontrollerbart. Den diagnosticeres generelt i fremskredne stadier og er kendt for at være svær at opdage eller diagnosticere i tidlige stadier.
Symptomer i forbindelse med lungekræft omfatter hoste, åndenød, træthed, manglende appetit og vægttab.
ALK-positiv NSCLC forekommer hos ca. 5 % af de patienter, der lider af avanceret NSCLC, og det anslås, at 75.000 personer om året diagnosticeres på verdensplan.
Alecensas virkningsmekanisme
Alecensa indeholder en tyrosinkinasehæmmer, som forhindrer ALK-fosforylering og ALK-medieret aktivering af de downstream-signalproteiner, der er identificeret i NSCLC-tumorer.
Midlet er i øjeblikket tilgængeligt i form af 150 mg kapsler til oral indgivelse.
Kliniske forsøg med Alecensa
EF’s betingede markedsføringsgodkendelse af Alecensa var baseret på to kliniske fase I / II-undersøgelser, kaldet NP28673 og NP28761.
Det kliniske forsøg NP28673 var et globalt fase I / II-studie med en enkelt arm, åben multicenterundersøgelse, som evaluerede sikkerheden og virkningen af Alecensa hos 138 ALK-positive NSCLC-patienter, hvis sygdom var progredieret på crizotinib.
Resultaterne viste, at patienter behandlet med Alecensa viste en samlet responsrate (ORR) på 50.8 % ved en vurdering fra en uafhængig bedømmelseskomité, som blev målt ved hjælp af RECIST-kriterierne (Response Evaluation Criteria In Solid Tumors).
En investigatorvurdering viste, at tumorerne faldt hos 51,4 % af de personer, der fik Alecensa.
Patienterne fortsatte med at reagere i en medianperiode på 15,2 måneder, mens den mediane progressionsfri overlevelse (PFS) hos personer, der fik Alecensa, var 8,9 måneder.
Resultaterne viste også, at Alecensas sikkerhedsprofil svarede til den, der blev observeret i tidligere studier.
De bivirkninger, der blev rapporteret hos ≥2 % af de patienter, der blev behandlet med lægemidlet i løbet af undersøgelsen, omfattede dyspnø, anæmi, træthed, forhøjet INR, lungeemboli og hyperbilirubinæmi.
NP28761 var et klinisk fase I / II-forsøg, der blev gennemført i Nordamerika. Det var et enarmet, åbent multicenterforsøg, der evaluerede sikkerheden og virkningen af Alecensa hos 87 ALK-positive NSCLC-patienter, hvis sygdom også havde udviklet sig under crizotinib-behandling.
Resultaterne af undersøgelsen viste, at patienter behandlet med Alecensa viste en ORR på 52,2 % i en vurdering fra en uafhængig bedømmelseskomité målt efter RECIST-kriterierne.
En investigatorvurdering viste, at tumorerne faldt hos 52,9 % efter behandling med lægemidlet.
Personerne fortsatte med at reagere i en median på 14,9 måneder, og medianen af PFS hos personer, der fik Alecensa, var otte måneder.
Resultaterne viste, at Alecensas sikkerhedsprofil svarede til den, der blev observeret i tidligere undersøgelser.
De mest almindelige bivirkninger af grad 3 eller højere, der blev rapporteret under den kliniske undersøgelse, omfattede stigning i muskelenzymer, forhøjede leverenzymer, åndenød, forhøjede triglyceridniveauer, lave fosfat- og kaliumniveauer og forlænget tid for delvis blodfortykkelse.