CH3OH eller methanol er en brændbar, farveløs og flygtig væske, der har en karakteristisk alkoholisk lugt. Ved at studere sin Methanol kan man få kendskab til molekylets molekylform, bindingsvinkel og polaritet. Polariteten af CH3OH er en af de vitale egenskaber, da den hjælper med at kende de andre egenskaber ved forbindelsen, såsom dens opløselighed, elektriske ladninger og meget mere. For at forstå Methanols polaritet skal vi først se på bindingsvinklerne og atomernes placering i CH3OH-molekylet.

CH3OH Bindingsvinkler
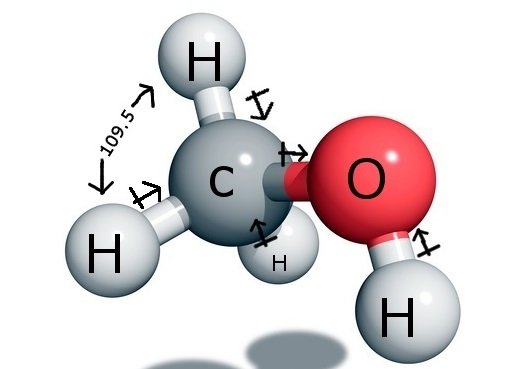
Det centrale kulstofatom danner fire bindinger i forbindelsen, tre med brintatomet og en med hydroxyl ( OH) gruppen. Og da dette kulstofatom har en sp3-hybridisering og danner en tetraederform, har det bindingsvinkler på 109,5 grader med sine bindingsatomer.
I modsætning hertil danner Oxygen én sigma-binding, men har to ensomme par, så der er en bøjning i dets bindingsvinkel på grund af bindingspar-lone pair repulsionskræfter. Dette mindsker bindingsvinklen til 104,5 grader.
Dermed har kulstof en bindingsvinkel på 109,5 grader med alle de tre hydrogenatomer og en bindingsvinkel på 104,5 grader med hydroxylgruppen.
Er CH3OH polær?
Polariteten af en given forbindelse afhænger af nettodipolmomentet på forbindelsen. Dette nettodipolmoment kan kendes ved at lægge mærke til de elektriske ladninger på atomerne i molekylet. Her er både kulstof- og iltatomer (som betragtes som geometriske centre for denne forbindelse) i methanol elektronegative atomer. Men ilt er mere elektronegativt end kulstof eller hydrogen i forbindelsen.
CH3OH kan ikke være upolær, fordi der er forskel i de elektriske ladninger mellem atomerne i methanolmolekylet. Oxygen har mere elektrontæthed på grund af sine to ensomme elektronpar. Dette medfører en nettodipol, der peger i retning af iltatomet, hvilket gør CH3OH polær.
Afhængigt af de elektriske ladninger er CH3OH-molekylet asymmetrisk, hvilket ophæver muligheden for upolaritet. Et upolært molekyle har en symmetrisk struktur, da dipol-dipolmomentet er ophævet. Men da der er en bøjning i Methanols form, fører det til dannelsen af en asymmetrisk struktur, hvilket resulterer i det elektriske nettodipolmomentets negative ende i retning af iltatomet. CH3OH er således et polært molekyle.
Nu da vi kender CH3OH-molekylets polaritet, skal vi gennemgå nogle af dets fysiske egenskaber:
- Methanol ( CH3OH)’s kogepunkt er 64,7 °C.
- Methanol’s smeltepunkt er -97,6 °C.
- Methanolens molekylvægt er 32,04 g/mol.
- Det er et polært opløsningsmiddel og er også kendt som træalkohol, fordi det engang blev fremstillet ved destillation af træ.
- Lugten af denne forbindelse er til den sødere side i forhold til ethanol.
Anvendelser af CH3OH
- Methanol anvendes også til fremstilling af kulbrinter og til syntese af andre kemikalier såsom formaldehyd.
- Det anvendes som frostvæske i rør.
- CH3OH anvendes også som benzintilsætningsstof i flere lande på grund af dets lave smeltepunkt.
- Forbindelsen bruges også som brændstof ved forbrænding i indre motorer.
- Mange medicinalvirksomheder bruger ren Methanol til syntese af andre forbindelser.
Jeg håber, at denne artikel hjælper dig med at forstå molekylets polaritet og dets fysiske egenskaber og anvendelser. CH3OH er et polært molekyle, da dipol-dipolmomentet ikke er ophævet på grund af dets asymmetriske form.