Kolontetrachlorid kan udtrykkes som CCl4, og det består af et kulstofmolekyle og fire chloridmolekyler. Tetrachlormethan er upolær. Hvorfor er tetrachlormethan ikke polært? Det er upolært, fordi molekylets dipolmomenter er jævnt fordelt omkring det centrale kulstofatom. Det betyder, at deres individuelle virkninger er ophævet, og at molekylet er neutralt.
De fire kloratomer er placeret symmetrisk i de fire hjørner af et tetraeder, og en enkelt binding forbinder hvert af dem med kulstofatomet i midten af molekylet. Som følge heraf har CCl4 intet positivt eller negativt nettodipolmoment. Hvis et andet atom end klor havde været placeret et hvilket som helst andet sted i molekylet, ville molekylet have et dipolmoment, og CCl4 ville derfor være polært.
“Vi definerer organisk kemi som kemien af kulstofforbindelser.” – August Kekule
Det er det hurtige svar vedrørende polariteten af tetrachlormethan. Det vil dog være en fordel at tale om molekylers polaritet generelt og undersøge tetrachlormethan og dets egenskaber for at forstå, hvorfor det er upolært i naturen.
Hvad betyder det, at et molekyle har polaritet?
Når man hører udtrykket polært, tænker man sandsynligvis på nord- og sydpolen på jorden. Disse nord- og sydpoler er placeret i modsatte ender af jorden, på samme måde som et batteri kan have en positiv og negativ pol. Molekyler og bindingerne mellem atomerne kan også have polaritet. Et molekyle defineres som polært, når de atomer, der udgør molekylet, er anbragt på en måde, der giver den ene ende af molekylet en positiv ladning og den anden ende af molekylet en negativ ladning.
Et polært molekyle opstår, når et atom, der har et højt elektronegativitetsniveau, kombineres eller bindes med et atom, der har et svagere elektronegativitetsniveau. Det resulterende molekyle har et område med høj elektronegativitet og et område med lavere elektronegativitet eller elektriske poler. Et af de mest berømte eksempler på et polært molekyle er vand, og det er takket være vandets polære natur, at det tjener som grundlag for liv på jorden.
I modsætning hertil mangler upolære molekyler elektriske poler, og elektronerne i dem er fordelt på en mere ligelig måde. Upolære molekyler mangler en bemærkelsesværdig ladning i begge ender af molekylet. De fleste kulbrintevæsker er upolære i naturen.
Sammenfattende er et molekyle, der har dipoler, som ikke ophæver hinanden, polært, mens upolære molekyler er molekyler, hvor atomernes ladninger ophæver hinanden, og hvor der ikke er nogen ladning i den ene eller den anden ende af molekylet.
Eksempler på polære molekyler
Som tidligere nævnt er vand et polært molekyle. De bindinger, der findes mellem oxygenatomerne og hydrogenatomerne, er fordelt således, at begge sider af atomet, både af oxygen-hydrogen og bindinger, er jævnt fordelt. Resultatet er, at iltsiden, eller toppen af molekylet, har en let negativ ladning, mens hydrogenatomerne, eller bunden af molekylet, har en let positiv ladning.
Ethanol er et polært molekyle, fordi de oxygenatomer, der er i molekylet, har en større elektronegativitet end de andre atomer. Oxygenatomerne tiltrækker flere elektroner på grund af deres højere elektronegativitetspotentiale, og -OH-bindingsgrupperne i molekylet har samlet set negative ladninger, selv om den negative ladning er meget svag.
“Livet eksisterer kun i universet, fordi kulstofatomet besidder visse ekstraordinære egenskaber.” – James Jeans
ADVERTISERING
Andre eksempler på polære molekyler er svovldioxid (SO2), svovlbrinte (H2S) og ammoniak (NH3).
Vær opmærksom på, at et molekyle kan bestå af polære bindinger og alligevel være upolært. Et eksempel er kuldioxid, som har fire bindinger, men molekylets dipolmomenter ender med at neutralisere hinanden, så molekylet er upolært.
Eksempler på upolære molekyler

Eksempler på upolære molekyler omfatter nitrogen, methan, ozon og oxygen. Disse er homonukleære molekyler eller molekyler, der består af atomer fra kun ét grundstof. Ikke-polære molekyler, der ikke er homonukleære, omfatter kuldioxid, som nævnt ovenfor, og methan. Toluen og benzin er også eksempler på upolære stoffer. Som hovedregel er kulstofforbindelser upolære, selv om der er nogle undtagelser som f.eks. carbonmonoxid. Kulilte er lineær i sin natur, hvilket normalt ville gøre et molekyle upolært, men forskellen i elektronegativitet mellem ilt- og kulstofmolekylet er betydelig nok til, at molekylet er polært. Alkyner opløses ikke i vand, og de betragtes som upolære molekyler. De inerte eller ædelgasser klassificeres også som upolære molekyler, fordi gasserne kun består af enkelte atomer af deres respektive grundstoffer som f.eks. neon, helium, argon og krypton.
Forudsigelse af et molekyls polaritet
En undersøgelse af elektronegativitetsværdierne for atomerne i et molekyle vil hjælpe dig med at afgøre, om molekylet sandsynligvis vil være polært eller upolært. Betydelige forskelle mellem elektronegativitetsværdierne antyder, at elektronerne er ligeligt fordelt mellem atomerne i molekylet. Da elektronerne vil være tættere på et atom end på et andet, vil dette område af molekylet være polært, men for at bestemme polariteten af hele molekylet skal alle bindinger tages i betragtning.
Den afgørende faktor for et molekyls polaritet eller upolaritet er dets geometri. Hvis den ene ende af molekylet har en negativ ladning, mens den anden ende af molekylet har en positiv ladning, vil molekylet være polært. Men hvis ladningerne er jævnt fordelt og kredser om et centralt atom, er molekylet sandsynligvis upolært. Du kan bruge dette til at forudsige, om et molekyle vil være polært eller upolært. Det er ikke alle molekyler, der har et dipolmoment, og det kan gøre det lidt vanskeligere at forudsige et molekyls polaritet. Som eksempel kan nævnes, at molekyler, der kan vendes og spejles på tværs af et geometrisk plan, ikke har dipolmomenter, fordi dipolmomenter ikke kan omfatte mere end et enkelt punkt.
Fakta om tetrachlormethan
Tetrachlormethan blev først opdaget af den franske kemiker Henri Victor Regnault i midten af 1800-tallet. Kemikaliet blev opdaget ved en kombination af klor og kloroform. På trods heraf stammer tetrachlormethan i dag hovedsageligt fra metan. Produktionen af tetrachlormethan foregår ofte ved at anvende biprodukterne fra kloreringsreaktioner til at udvinde forbindelsen. Dette omfatter biprodukterne fra fremstillingen af chloroform og dichlormethan. Tetrachlormethan er ret flygtigt i naturen og afgiver en lugt, der ligner kemikalier til kemisk rensning. Tetrachlormethan er også opløsningsmiddel og er derfor nyttigt til opløsning af upolære stoffer som f.eks. olier og fedtstoffer.
Tetrachlormethan har mange forskellige anvendelsesmuligheder og er blevet brugt som rengøringsmiddel, som kølemiddel og i brandslukkere. Carbontetrachlorid bruges ofte til fremstilling af lavalamper, idet det gør voksen tungere.
“… Er kulstofmolekylet foret med tanke?” – Saul Bellow
På grund af de miljømæssige konsekvenser af tetrachlormethan er produktionen heraf faldet brat siden 1980’erne. Montréal-protokollen begrænsede produktionen af chlorfluorcarboner, og da tetrachlormethan er en vigtig ingrediens i fremstillingen af CFC’er, har tetrachlormethan oplevet et kraftigt fald i produktionen som følge heraf. De negative sundhedsvirkninger af tetrachlormethan har også medført et fald i produktionen, og selv om det engang blev brugt i stor udstrækning som opløsningsmiddel, anvendes det i dag sjældent til sådanne formål.
Tetrachlormethan er ekstremt giftigt for leveren, og andre leverskadelige stoffer bliver ofte sammenlignet med tetrachlormethanets giftighed. Høje koncentrationer af tetrachlormethan kan ikke kun skade leveren, men de kan også skade nyrerne. Længerevarende udsættelse for tetrachlormethan kan medføre koma eller død. Eksponering for kemikaliet kan også øge ens chance for at udvikle kræft.
Hvorfor er tetrachlormethan polært?
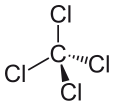
Efter at have set, hvad der gør et molekyle polært, og efter at have set på nogle eksempler på polære molekyler, kan vi nu bedre forstå, hvorfor tetrachlormethan er et upolært molekyle. Det første, man skal gøre, når man forsøger at afgøre, om et molekyle er polært og upolært, er at beregne elektronegativitetsværdierne for atomerne i molekylet. Polariteten af bindingen mellem to atomer skal fastslås, og alle bindinger skal tages i betragtning, når man forsøger at bestemme molekylets polaritet. Forskellen i elektronegativitetsværdierne mellem chlorid og kulstof, i tilfældet med tetrachlormethan, er dog ikke den eneste faktor, der skal tages i betragtning. Molekylets form skal også tages i betragtning. Selv om der er dipoler til stede i molekylet, betyder den lineære form af tetrachlormethan, at virkningerne af de forskellige dipolmomenter i molekylet ophæver hinanden, og at molekylet som følge heraf er neutralt eller upolært.