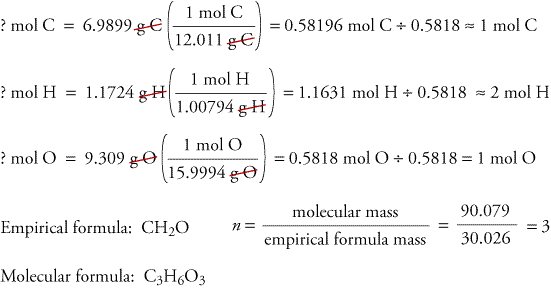Få empiriske og molekylære formler ud fra forbrændingsdata
Empiriske og molekylære formler for forbindelser, der kun indeholder kulstof og hydrogen (CaHb) eller kulstof, hydrogen og oxygen (CaHbOc), kan bestemmes ved hjælp af en proces, der kaldes forbrændingsanalyse. Trinene for denne procedure er
Væg en prøve af den forbindelse, der skal analyseres, og anbring den i det apparat, der er vist på billedet nedenfor.
Brænd forbindelsen fuldstændigt. De eneste produkter fra forbrændingen af en forbindelse, der kun indeholder kulstof og brint (CaHb) eller kulstof, brint og ilt (CaHbOc), er kuldioxid og vand.
H2O og CO2 trækkes gennem to rør. Det ene rør indeholder et stof, der absorberer vand, og det andet indeholder et stof, der absorberer kuldioxid. Vejer hvert af disse rør før og efter forbrændingen. Masseforøgelsen i det første rør er massen af H2O, der blev dannet ved forbrændingen, og masseforøgelsen for det andet rør er massen af CO2, der blev dannet.
Antag, at alt kulstoffet i stoffet er blevet omdannet til CO2 og fanget i det andet rør. Beregn massen af kulstof i forbindelsen ud fra massen af kulstof i den målte masse af dannet CO2.
Antag, at alt brint i forbindelsen er blevet omdannet til H2O og fanget i det første rør. Beregn massen af hydrogen i forbindelsen ud fra massen af hydrogen i den målte masse af vand.
Hvis forbindelsen indeholder ilt samt kulstof og hydrogen, beregnes massen af oxygen ved at trække massen af kulstof og hydrogen fra den samlede masse af den oprindelige prøve af forbindelsen.
Brug disse data til at bestemme de empiriske formler og molekylformlerne på sædvanlig vis.
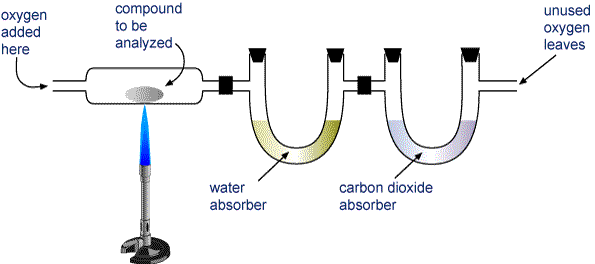
Apparat til forbrændingsanalyse En forbindelse, der indeholder kulstof og brint (CaHb) eller kulstof, brint og ilt (CaHbOc), forbrændes fuldstændigt og danner H2O og CO2. Produkterne trækkes gennem to rør. Det første rør absorberer vand, og det andet rør absorberer kuldioxid.
For at illustrere, hvordan empiriske og molekylære formler kan bestemmes ud fra data, der stammer fra forbrændingsanalyser, skal vi se på et stof kaldet trioxan. Formaldehyd, CH2O, er ustabilt som en ren gas og danner let en blanding af et stof kaldet trioxan og en polymer kaldet paraformaldehyd. Derfor opløses formaldehyd i et opløsningsmiddel, f.eks. vand, før det sælges og anvendes. Molekylformlen for trioxan, som indeholder kulstof, hydrogen og oxygen, kan bestemmes ved hjælp af data fra to forskellige eksperimenter. I det første forsøg forbrændes 17,471 g trioxan i det ovenfor viste apparat, og der dannes 10,477 g H2O og 25,612 gCO2. I det andet forsøg er trioxans molekylmasse 90,079.
Vi kan få denmolekylære formel for en forbindelse ud fra dens empiriske formel og dens molekylmasse. (For at få den empiriske formel skal vi bestemme massen i gram af kulstof, hydrogen og oxygen i 17,471 g trioxan. Vi skal derfor udføre disse generelle trin.
Først omregnes fra de givne data til gram kulstof, brint og ilt.
For det andet bestemmes den empiriske formel ud fra grammene af kulstof, brint og ilt.
For det tredje bestemmes molekylformlen ud fra den empiriske formel og den givne molekylmasse.
Da vi antager, at alt kulstoffet i trioxan har reageret til dannelse i CO2, kan vi finde massen af kulstof i 17,471 g trioxan ved at beregne massen af kulstof i 25,612 g CO2.

Da vi antager, at alt brint i trioxan har reageret til H2O, kan vi finde massen af brint i 17,471 g trioxan ved at beregne massen af brint i 10.477 g H2O.

Da trioxan kun indeholder kulstof,brint og ilt, kan vi beregne massen af ilt ved at trække massen af kulstof og brint fra den samlede masse af trioxan.
? g O = 17,471 g trioxan – 6,9899 g C – 1,1724 g H = 9.309 g O
Vi beregner nu den empiriske formel, den empiriske formels masse og molekylformlen.
EksempelStudieark: Du ønsker at beregne molekylformlen for en forbindelse, der kun indeholder kulstof og brint (CaHb) eller kulstof, brint og ilt (CaHbOc), og du har fået dens molekylære masse og masserne af CO2 og H2O, der dannes ved forbrænding af en given masse af forbindelsen.
Generel fremgangsmåde
Beregne antallet af gram kulstof i forbindelsen ved at beregne antallet af gram kulstof i den givne mængde CO2.

Beregne antallet af gram brint i forbindelsen ved at beregne antallet af gram brint i den givne mængde H2O.

Hvis forbindelsen indeholder ilt, beregnes antallet af gram ilt i den ved at trække masserne af kulstof og brint fra den givne samlede masse af forbindelsen.
? g O = (givet) g total – (beregnet) g C – (beregnet) g H
Beregn forbindelsens empiriske formel ud fra grammerne af kulstof, brint og ilt.
Beregn formelmassen for den empiriske formel, og divider den givne molekylmasse med den empiriske formelmasse for at få n.
Multiplicer hver af subscripterne i den empiriske formel med n for at få molekylformlen.
EKSEMPEL – Fremskaffelse af en molekylformel fraforbrændingsdata:
Dianabol er en af de anabole steroider, der er blevet brugt af nogleatleter til at øge deres muskelstørrelse og styrke. Det svarer til det mandlige hormon testosteron. Nogle undersøgelser viser, at de ønskede virkninger af stoffet er minimale, og bivirkningerne, som omfatter sterilitet og øget risiko for leverkræft og hjertesygdomme, afholder de fleste mennesker fra at bruge det. Dianabol’s molekylformel, som består af kulstof, hydrogen og oxygen, kan bestemmes ved hjælp af data fra to forskellige eksperimenter. I det første forsøg forbrændes 14,765 g Dianabol, og der dannes 43,257 g CO2 og 12,395 g H2O.I det andet forsøg findes Dianabol’s molekylmasse at være 300,44. Hvad er molekylformlen for Dianabol?
Løsning: