Molekylære chaperoner
Molekylære chaperoner består af en lang række proteiner, der spiller en vigtig rolle i den cellulære homøostase og er ansvarlige for at hjælpe med at folde proteiner, samling af multimeriske proteiner, translokation af proteiner inden for og på tværs af cellen, nedbrydning af uønskede eller fejlfoldede proteiner under normale cellulære processer og stabilisering af proteiner ved at forhindre aggregering og hjælpe med genfoldning under stressbetingelser (Lindquist, 1986; Lindquist og Craig, 1988).
Proteiner, der rapporteres at have chaperonaktivitet, blev oprindeligt opdaget som dem, der blev overudtrykt under hedeslag, og blev derfor kaldt for hedeslagsproteiner (Hsp). Ud over varmestød er det også kendt, at andre stressbetingelser som f.eks. kulstof-, kvælstof- eller fosfatbegrænsende forhold inducerer molekylære chaperoner. Disse proteiner er efter deres molekylvægt inddelt i fem store familier: (a) Hsp100-familien, (b) Hsp90-familien, (c) Hsp70-familien, (d) Hsp60-familien og (e) familien af små varmechokproteiner (sHsp) (Bohen et al., 1995; Schirmer et al., 1996; Bukau og Horwich, 1998). Chaperonerne klassificeres også på grundlag af deres virkemåde i: (a) Foldaser, Chaperoner, der hjælper med genfoldning af ufoldede proteiner ved hjælp af ATP, f.eks. Hsp70 og Hsp60, (b) Holdaser, Chaperoner, der binder foldningsintermediater og forhindrer aggregering, f.eks. sHsp og Hsp40, og (c) Disaggregaser, Chaperoner, der aktivt disaggregerer de skadelige proteinaggregater, hvilket kan føre til deres små fragmenter, f.eks. medlemmer af AAA + ATPase-superfamilien og Hsp100. Denne type klassificering gælder med få undtagelser (Richter et al., 2010; Kim et al., 2013). En stor del af vores forståelse af mekanismerne for chaperonassisteret proteinfoldning er blevet afledt af arbejdet med Hsp60- og Hsp70-familierne af chaperoner. Denne gennemgang fokuserer på Hsp60-klassen af molekylære chaperoner og fremhæver Hsp60 med atypisk struktur og funktion.
Hsp60-familie/Chaperoniner
De 60 kDa chaperoner danner store oligomeriske ringe og kaldes også for chaperoninerne. Chaperoninerne kan yderligere underklassificeres i to grupper på grundlag af kravet om co-chaperoniner og deres cellulære placering. Type I-chaperoniner findes i cytoplasmaet hos prokaryoter og i mitokondriet og kloroplasten hos eukaryoter. De har brug for hjælp fra co-chaperonin, dvs. Hsp10, som fungerer som en hætte på ringen. Det velundersøgte type I-chaperonin er kendt som GroEL-GroES-systemet i Escherichia coli. Dets homologer er Cpn60/Cpn20 i kloroplaster og mtHsp60/mtHsp10 i mitokondrier (Cheng et al., 1989; Hayer-Hartl et al., 1995; Dickson et al., 2000). Type II-chaperoniner findes i cytoplasmaet hos eukaryoter og i arkebakterielle mikroorganismer. De har et indbygget låg og kræver derfor ikke co-chaperoniner til deres funktion (Ranson et al., 1998). Eksempler på type II-chaperoniner omfatter det eukaryote TriC/CCT-maskineri (TCP-1 ringkompleks/chaperonin-holding TCP-1-kompleks), som består af 8 underenheder, og termosomet i archaebakterier. I modsætning til type I-chaperoniner kræver substratuafhængig indfangning af type II-chaperoniner hjælp fra prefoldin og Hsp70-homologer (Iizuka et al., 2004; Cuéllar et al., 2008). For nylig blev der rapporteret om en tredje gruppe kendt som type III-chaperoniner, som strukturelt ligner type II-chaperoniner, men som mekanisk og fylogenetisk adskiller sig fra både type I- og type II-chaperoniner, f.eks. Carboxydothermus hydrogenoformans chaperonin (Ch-CPN) (Techtmann og Robb, 2010; An et al., 2017; Figur 1). Type I-, II- og III-chaperoninerne er også kendt som gruppe I-, II- og III-chaperoniner.
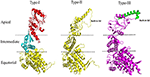
Figur 1. Strukturelle træk ved type I-, type II- og type III-chaperoninerne. Den sammenlignende strukturanalyse af type I-, type II- og type III-chaperoniner. Strukturerne blev downloadet fra RCSB med koderne PDB: henholdsvis 1AON, 3RUW og 5X9U. Type I-chaperonin er afgrænset i apikale, intermediære og ækvatoriale domæner, hvoraf tilsvarende regioner er vist i type II- og III-chaperoniner ved hjælp af stiplede linjer. Type II-chaperonin har et karakteristisk indbygget låg i strukturen, som spiller rollen som co-chaperonin GroES for type I-chaperonin. Type III-chaperoniner ligner strukturelt type II-chaperoniner med hensyn til indbygget låg. Lågets sekvens, struktur og funktion er dog forskellige i type II- og type III-chaperoniner (An et al., 2017). PyMOL-programmet (PyMOL Molecular Graphics System, version 1.3) blev anvendt til at generere denne figur.
Struktur-funktion af type I-chaperoniner: Prokaryotisk cytosol
E. coli GroEL-GroES
Strukturelle og funktionelle undersøgelser af E. coli GroEL har vist, at den danner en tetradecamerisk struktur bestående af to heptameriske ringe, der er stablet på hinanden og danner et hulrum, som ændrer sin karakter fra at være overvejende hydrofobisk til hydrofil ved binding af GroES. Foldning af substratprotein finder sted i dette hulrum med hjælp fra co-chaperonin GroES, som er en kappelignende heptamerisk struktur (Mande et al., 1996). Hver GroES-monomer har en størrelse på 10 kDa. GroEL-monomeren er opdelt i tre domæner, nemlig det apikale, det intermediære og det ækvatoriale domæne. Hver monomer har en størrelse på ~57 kDa.
Der er to modeller foreslået for den GroEL-GroES-medierede substratproteinfoldning. Asymmetrisk/sequentiel model, som er bredt accepteret. I denne model er GroEL og GroES til stede stoikiometrisk i et 2:1-forhold (14:7 underenhedsforhold). I den anden model, der er kendt som den symmetriske/simultane model, som er baseret på det for nylig observerede GroEL-GroES-kompleks, er begge ringe af GroEL dækket af co-chaperonin GroES i det stoikiometriske forhold 1:1, dvs. (GroEL-GroES)2, og underenhedsforholdet er 14:14 (Sameshima et al., 2008; Ye og Lorimer, 2013; Fei et al., 2014). Symmetrisk (GroEL-GroES)2-kompleks er blevet observeret både i tilstedeværelse og fravær af substratprotein, hvilket tyder på en forbigående mellemliggende tilstand i foldningsreaktionscyklussen.
Struktur-funktion af type I-chaperoniner: Endosymbiotiske organeller
Chloroplast- og mitokondrie-chaperoniner
Kloroplast-chaperoninerne betegnes typisk som Cpn60 (GroEL-homologer) og Cpn10 (GroES-homologer). Cpn60-chaperoninerne består af flere underenheder, som er divergeret i to beslægtede, men forskellige α- og β-typer (Dickson et al., 2000; Hill og Hemmingsen, 2001). I modsætning til bakterielle chaperoniner, som indeholder flere underenheder og foretrækker homo-oligomerisering (Ojha et al., 2005; Gould et al., 2007), danner chloroplast-chaperoniner hetero-oligomerer med sine to typer chaperonin α- og β-underenheder. Heterogenitet findes også i co-chaperoninstrukturen. Cpn10 ligner standard co-chaperoninet og danner en heptamerisk enkeltring af 10 kDa underenheder (Koumoto et al., 2001; Sharkia et al., 2003). Cpn20 har to Cpn10-lignende polypeptidsekvenser, der er forbundet i tandem. Den oprensede Cpn20 findes som en tetramer ringlignende struktur, der indeholder 20 kDa underenheder. Den er fuldt funktionel in vitro, idet den bidrager til genfoldning af denatureret protein i tilstedeværelse af både chloroplast Cpn60 og E. coli GroEL (Tang et al., 2006). Desuden hjælper Chlamydomonas reinhardtii Cpn10 kun GroEL i tilstedeværelse af Cpn20 (Tsai et al., 2012). Der findes således en betydelig heterogenitet i den oligomeriske samling af chloroplast-chaperoniner.
Det menneskelige mitokondrielle chaperonin, mtHsp60, er kendt for at have en proteinfoldningsmekanisme (mitokondrieprotein), der er forskellig fra GroEL-GroES-systemet, og kræver en enkelt heptamerisk ring for at udføre sin proteinfoldningsfunktion sammen med sit co-chaperonin, mtHsp10 (Viitanen et al., 1992; Nielsen og Cowan, 1998). Krystalstrukturen af mitokondrielt chaperonin i kompleks med dets co-chaperonin, mtHsp60-mtHsp10, viser imidlertid et unikt mellemstadie, hvor mtHsp60-mtHsp10 danner en symmetrisk fodboldlignende struktur med dobbeltring, (mtHsp60)14 + 2 (mtHsp10)7.
Type I Chaperoniner: Ikke-kanoniske træk
Multiple Chaperoniner på tværs af arter
Analyse af fuldstændigt sekventerede genomer tyder på, at ca. 30 % af alle genomiske sekvensdata besidder flere kopier af gensekvenser, der koder for chaperoniner (Lund, 2009; Kumar et al., 2015). Fordelingen af disse multiple chaperoniner baseret på omfattende fylogenetisk analyse tyder på, at multiple kopier af chaperonin gener findes overvejende i fem phyla, nemlig (a) phylum Actinobacteria, (b) phylum Firmicutes, (c) phylum Cyanobacteria, (d) phylum Chlamydia, og (e) α-Proteobacteria phylum (Kumar et al, 2015).
Actinobakterier
Actinobakterier er Gram-positive bakterier og besidder et højt G + C indhold i deres genomer, f.eks. Mycobacterium tuberculosis, Mycobacterium leprae og Bifidobacterium longum. Disse arter har typisk to kopier af chaperonin-generne, hvoraf den ene kopi er til stede i en operonlignende struktur. Den anden kopi af Cpn60 eksisterer som et uafhængigt gen uden tilstedeværelsen af Cpn10-genet (Rinke de Wit et al., 1992). De actinobakterielle chaperoningener er under regulerende kontrol af HrcA-transkriptionsfaktoren, som binder sig til opstrøms CIRCE-sekvensen (controlling inverted repeat of chaperone expression) (Duchêne et al., 1994; Grandvalet et al., 1998). I nogle tilfælde formidles reguleringen gennem HspR-transkriptionsfaktor, der binder til opstrøms HAIR-sekvensen (HspR Associated Inverted Repeat) (Barreiro et al., 2004).
Firmicutes
Firmicutes er Gram-positive bakterier og besidder et lavt G + C indhold i deres genomer, f.eks. Staphylococcus aureus, Desulfitobacterium dehalogenans og C. hydrogenoformans. Firmicutes er kendt for at besidde både prokaryotiske type I-chaperoningener og arkael-lignende chaperoningener, der klassificeres som type III-chaperonin. Type I-chaperoniner er anbragt i et operonisk arrangement med co-chaperoninet, mens type III-chaperonin-genet er placeret i dnaK-operonet. Både type I- og type III-chaperonin-generne reguleres af HrcA-transkriptionsfaktoren (Techtmann og Robb, 2010).
Chlamydiae
Chlamydiae er for det meste obligate intracellulære patogener, f.eks. Chlamydia trachomatis, Chlamydia pneumonia og Chlamydia psittaci. Chlamydial-arter besidder tre kopier af chaperonin-gener (McNally og Fares, 2007). Operonisk arrangement antyder, at der kun findes én kopi af chaperonin-generne sammen med dets co-chaperonin. Andre chaperoningener er imidlertid placeret separat. Reguleringen af chlamydiale chaperoningener er kompleks. Den første kopi af chaperonin-genet induceres af varmechok og reguleres af HrcA-CIRCE-systemet. Den anden kopi af chaperonin-genet induceres, når Chlamydia befinder sig i monocytter eller makrofager (Kol et al., 1999), og den tredje kopi af chaperonin-genet induceres, når Chlamydia befinder sig i Hep-2-celler (Gérard et al., 2004). Sådanne typer af ekspression og regulering af chaperoningener tyder på livscyklusspecifikke mønstre og uafhængige funktionelle roller for dem.
α-proteobakterier
Rhizobier, der tilhører α-proteobakterieklassen, er symbiotiske organismer, der lever i forbindelse med bælgplanter i rodknoldene og er involveret i kvælstoffiksering, f.eks. Bradyrhizobium japonicum, Rhizobium leguminosarum. Rhizobier indeholder det største antal kopier af chaperoniner. B. japonicum har syv kopier af chaperonin generne (Fischer et al., 1993). R. leguminosarum er en velkarakteriseret organisme og har tre kopier af chaperoningener. Genarrangementet i alle disse organismer tyder på, at de tre kopier af chaperonin-genet danner separate operoner med deres respektive co-chaperonin-gener (George et al., 2004). Et af chaperonin-operonerne er placeret på den genomiske ø, der indeholder gener, som er involveret i nitrogenfiksering. Det reguleres af NiF-faktorer, der regulerer generne for nitrogenfiksering (Ogawa og Long, 1995). Den anden kopi af chaperonin-genet er ikke velundersøgt og er kendt for at være involveret i chaperoneringsevne af flere modelsubstratproteiner (George et al., 2004).
Cyanobakterier
Cyanobakterier er i vid udstrækning fotosyntetiske bakterier, f.eks. Synechococcus platensis, Prochlorococcus marinus og Anabaena variabilis. Omkring 90 % af de genomiske sekvenser af cyanobakteriearter indeholder to kopier af chaperoningener, hvoraf det ene er anbragt på et operon, mens det andet chaperoningen er kodet separat. Nogle cyanobakteriearter, der indeholder tre kopier af chaperoningener, hvor to af dets chaperoningener er placeret sammen med respektive co-chaperoniner i operonet, mens den tredje kopi af chaperoningener er uafhængig (Lund, 2009; Kumar et al., 2015). Chaperoningener, der findes i operonisk arrangement med deres co-chaperoniner, er essentielle gener, mens de gener, der findes uafhængigt af co-chaperoninet, er ikke-essentielle (Sato et al., 2008). De to cyanobakterielle chaperoningener er positivt reguleret af RpoH og negativt reguleret af HrcA-proteiner. Ved varmechok induceres et af chaperonin-generne hurtigt, mens det andet chaperonin-gen induceres gradvist (Kojima og Nakamoto, 2007; Rajaram og Apte, 2010). Det chaperonin-gen, der induceres gradvist ved varmechok, er kendt for at være direkte involveret i fotosyntesen.
Evolutionær linje
I takt med at flere genomiske sekvenser bliver tilgængelige, tyder analyse af chaperoningener på, at fordelingen og hyppigheden af flere kopier af chaperoningener på tværs af fylaer og organismer fortsætter med at stige (Lund, 2009; Kumar et al., 2015). For at forstå årsagen til mangfoldigheden af chaperoningener skyldes enten horisontal genoverførsel eller genduplikation, blev der udført fylogenetisk analyse af GroEL-proteiner på tværs af arter, hvilket afslørede, at årsagerne til eksistensen af flere kopier af GroELs er uensartede. I nogle få tilfælde er der tale om genduplikation efterfulgt af evolutionær udvælgelse som f.eks. det, der er observeret i myxobakterielle GroEL’er, mykobakterielle første og anden kopi af GroEL og få rhizobiale GroEL’er. I tilfælde af den tredje mykobakterielle GroEL-homolog, få rhizobiale GroEL’er og methanosarcinal GroEL’er fandt horisontal genoverførsel sted (Goyal et al., 2006; Kumar et al., 2015).
Det er tidligere blevet foreslået i vores laboratorium, at mykobakteriel GroEL er blevet duplikeret og har undergået forskellige selektive pres for at udføre en karakteristisk strukturel og funktionel rolle i løbet af evolutionen (Goyal et al., 2006). Biofysiske og biokemiske undersøgelser af rekombinant oprensede M. tuberculosis GroEL’er har vist, at GroEL1 og GroEL2 eksisterer som lavere oligomeriske arter i modsætning til den tetradecameriske GroEL-struktur i E. coli (Qamra et al., 2004). Krystalstrukturen af M. tuberculosis GroEL2 i sin dimeriske form fremhævede tilstedeværelsen af forskellige rester i grænsefladeregionen, som sandsynligvis er ansvarlige for ændringen i oligomeriseringen (Figur 2; Qamra og Mande, 2004). Gen shuffling og domain swapping-undersøgelser på M. tuberculosis GroEL1 tyder på, at det ækvatoriale domæne er ansvarlig for den mislykkede oligomerisering. Det apikale domæne kan modstå store indsættelser og sletninger (Kumar et al., 2009). Omkring samme tid blev det vist, at GroEL1 har udviklet sig til promiskuelt at binde nukleinsyrer (Basu et al., 2009), og oligomerisering lettes af fosforylering af serinrester (Kumar et al., 2009). Da GroEL2 er kendt for at være et essentielt chaperonin i mykobakterier, mens den oligomeriske samling af GroEL1 reguleres posttranslationelt, blev det rapporteret, at tetradecamerisk samling og præcis kommunikation mellem domænerne er en forudsætning for chaperoninaktivitet (Chilukoti et al., 2015).
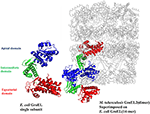
Figur 2. Krystalstrukturen af M. tuberculosis GroEL2 overlejret på E. coli GroEL-ES-strukturen. Strukturen af M. tuberculosis GroEL2 (PDB ID:1SJP) viser lavere oligomerisk status (dimer). Farvet med blå, grøn og rødt er henholdsvis det apikale, intermediære og ækvatoriale domæne. Sammenlignet med E. coli GroEL (PDB ID: 1AON), der er vist i grå farve, formidles inter-underenhedsinteraktionen gennem det apikale domæne i M. tuberculosis GroEL2-strukturen, mens inter-underenhedsinteraktionen sker gennem det ækvatoriale domæne i E. coli GroEL. En enkelt underenhed af M. tuberculosis GroEL2 er tilpasset til E. coli GroES-bunden GroEL-ring, der repræsenterer en asymmetrisk model. GroES-strukturen er fjernet af hensyn til enkelheden. En enkelt underenhed af E. coli GroEL er vist med de samme farvekodede domæner sammenlignet med M. tuberculosis GroEL2 med henblik på sammenlignende analyse. PyMOL-programmet (PyMOL Molecular Graphics System, version 1.3) blev anvendt til at generere denne figur.
Funktionel diversitet
Det er vigtigt at undersøge, om tilstedeværelsen af flere kopier af chaperoniner er ansvarlige for at opføre sig som kanoniske chaperoniner, eller om de har divergeret for at udføre nye funktioner. Det er også vigtigt at bemærke, om disse flere chaperoniner virker på fælles substrater eller på forskellige puljer af substrater. GroEL’er er meget velbevarede på tværs af forskellige arter, og det er blevet vist, at homologer af chaperoniner fra andre bakterier kan fungere i E. coli, hvilket tyder på overlapning af substratproteiner og en fælles mekanisme for GroEL-funktionen. Interaktionerne mellem substratproteiner og GroEL er hydrofobiske af natur, så konformationsændringer, der er medieret af eksponering af de apikale og ækvatoriale domæner i hulrummet, spiller en nøglerolle i substratgenkendelse og fremmer proteinfoldningen. Binding af substratproteiner til GroEL sker gennem α/β-domæner af proteiner uden sekvensmæssig lighed (Kerner et al., 2005; Kumar og Mande, 2011), og yderligere undersøgelser tyder på, at GroEL selektivt binder globulære substrater snarere end forlængede polypeptider (Robinson et al., 1994; Goldberg et al., 1997). Det er også blevet rapporteret, at flere kopier af chaperoniner i en organisme har udviklet sig til at udføre nye funktioner. GroEL-homologen i en insektsymbiont, Xenorhabdus nematophila, har vist sig at være giftig for insekter, hvilket sker gennem binding til alfa-chitin. Mutationsanalyser af disse GroEL-homologer tyder på, at den aminosyre, der er afgørende for denne form for aktivitet, er forskellig fra den essentielle chaperonin (Joshi et al., 2008). I M. tuberculosis fungerer GroEL2 som et generalist-chaperonin (Hu et al., 2008), mens GroEL1 rapporteres at være associeret med nukleoider (Basu et al., 2009). Det er således tydeligt, at genduplikation af groEL-gener har ført til den funktionelle diversitet af chaperoniner og/eller et særskilt substratspektrum for intracellulær proteinfoldning.
Posttranslationelle modifikationer/Biofilmdannelse
Posttranslationelle modifikationer i proteiner anvendes af organismer til at modulere deres fysiologiske processer og tilpasse sig til et konstant skiftende miljø (Bernal et al., 2014). Chaperoniner er blevet rapporteret til at blive posttranslationelt modificeret i visse organismer, og denne modifikation er blevet rapporteret til gevinst/tab af deres funktion. F.eks. har fraktionering af M. tuberculosis cellelysat vist, at tetradecamerisk form af GroEL1 kun opnås ved fosforylering ved serinrester (Kumar et al., 2009). På samme måde er det i en anden rapport blevet vist, at fosforylering sker ved threoninrester (Canova et al., 2009). Begge disse observationer tyder på, at oligomerisering af GroEL1 er et resultat af posttranslationel modifikation.
Mange patogener undgår det medfødte immunforsvar og bliver resistente over for antibiotika ved at danne biofilm på epitelceller (Hall-Stoodley og Stoodley, 2005). GroEL’s rolle i biofilmdannelse er blevet belyst i nogle få organismer. For eksempel undlader GroEL1-mutant af M. smegmatis at danne biofilm. Mekanistiske undersøgelser afslørede, at M. smegmatis GroEL1 interagerer med KasA-enzymet, som er kritisk for mykolsyrebiosyntese, der er involveret i biofilmdannelse (Ojha et al., 2005). Interessant nok er det for nylig blevet rapporteret, at GroEL i den patogene stamme B. anthracis bliver fosforyleret og derved modulerer biofilmdannelsen. Disse fund fremhæver, at fosforylering af GroEL har funktionelle implikationer (Arora et al., 2017). Acetylering er en anden posttranslationel modifikation, der er forbundet med E. coli- og M. tuberculosis-chaperoniner, men en funktionel rolle er endnu ikke blevet tillagt denne modifikation (Liu et al., 2014). Tilsvarende gennemgår mitokondrielt co-chaperonin (mtHsp10) acetylmodifikation og kontrollerer foldning af mitokondrielle proteiner under overskydende næringsstofbetingelser (Lu et al., 2015).
C-terminal diversitet
Flere undersøgelser fremhæver vigtigheden af de C-terminale rester af GroEL i den overordnede funktion af chaperoninet (Tang et al., 2006; Chen et al., 2013). I tilfælde, der vedrører flere kopier af chaperoniner, har de forskellige mønstre af C-terminale rester. Mens GroEL’s C-terminus (fra E. coli) har et motiv med 13 rester (GGM)4M, har GroEL-homologer fra andre organismer (som indeholder flere kopier af chaperoniner) forskellige C-terminale motiver, f.eks.:
a) Histidinrig C-terminal, f.eks. mykobakterier (Colaco og MacDougall, 2014)
b) Mønsterløs C-terminal, f.eks, Rhizobia (George et al., 2004)
c) Lignende (GGM)4M gentagelser, f.eks. Myxobacteria (Wang et al., 2013)
d) Manglende GGM-lignende hale, f.eks. Methanosarcina (Figueiredo et al., 2004)
Det ses tydeligt, at mange chaperonin-paraloger i forskellige organismer har GGM-lignende C-terminus. Der ses en bred vifte af genomisk organisation i disse chaperoniner. Desuden ses der også forskelle i deres samekspression med co-chaperonin og i deres funktioners væsentlighed. Det er således forvirrende, at disse paraloger enten er essentielle eller ikke-essentielle, sameksprimeret med deres co-chaperonin eller ikke sameksprimeret, og muligvis fungerer de som husholdnings-chaperoniner. På den anden side har chaperoniner, der ikke besidder den GGM-lignende C-terminus, muligvis udviklet sig til at udføre nye funktioner (Ojha et al., 2005; Wang et al., 2013; figur 3).

Figur 3. Flere chaperoniner i bakterier, der viser diversitet ved C-terminal. Sekvenstilpasning, der fremhæver C-terminale regioner af de repræsentative bakterielle GroEL-homologer af bakterier med E. coli GroEL. De sidste C-terminale rester af udvalgte flere GroEL’er i forskellige bakterier viser divergenser fra det kanoniske (GGM)4M-motiv af E. coli GroEL, der er vist i den stiplede røde boks. Sekvenserne blev hentet fra www.uniprot.org og justeret i MEGA6 ved hjælp af MUSCLE-algoritmen (www.megasoftware.net). Formateringen af de justerede sekvenser blev foretaget i Jalview alignment viewer (www.jalview.org). Residuerne i alignmentet følger standard Clustal-farveskemaet i Jalview.
Sluttende bemærkninger
Type I chaperoniner er vigtige i kraft af deres rolle i intracellulær proteinfoldning. GroEL-GroES-systemet i bakterier hjælper foldning af ca. 10-15% af de cytosoliske proteiner. Forskellige strukturer af GroEL, der er løst i apo-form, nukleotidbundet form samt i kompleks med co-chaperonin GroES, forsøger at forklare disse chaperonins rolle i proteinfoldning (Saibil et al., 2013). Eksistensen af flere chaperoniner og deres rolle i forskellige funktioner tyder på et evolutionært pres i retning af tilpasning til forskellige miljøforhold. Strukturen af M. tuberculosis GroEL2 fremhæver en lavere oligomerisk tilstand og mere eksponerede hydrofobiske overflader, sandsynligvis for at øge substratpuljen og energibesparelsen (Qamra og Mande, 2004; Qamra et al., 2004; Kumar og Mande, 2011). På grund af tilstedeværelsen af histidinrige C-terminaler i flere chaperoniner er det blevet foreslået, at disse hjælper med alternative biologiske funktioner. M. smegmatis GroEL1, der binder sig til jern, kan bidrage til biofilmdannelse (Ojha et al., 2005). Overlevelsesdefekt hos M. tuberculosis groEL1 knockout-stamme under lav lufttilstand kan hjælpe med iltsansning ved direkte binding til metaller eller hjælpe visse metalloproteiner med at folde sig (Sharma et al., 2016). Strukturen af andre homologe chaperoninproteiner vil sandsynligvis besvare de utallige spørgsmål, der er forbundet med de nye funktioner af chaperoninhomologer.
Author Contributions
Alle forfattere på listen har ydet et væsentligt, direkte og intellektuelt bidrag til arbejdet og godkendt det til offentliggørelse.
Interessekonflikt erklæring
Forfatterne erklærer, at forskningen blev udført i fravær af kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
MYA takker for den økonomiske støtte til Senior Research Fellowship fra Department of Biotechnology (DBT), Ministry of Science and Technology, Government of India. Forfatterne vil gerne takke for den økonomiske støtte til arbejdet i SCM-laboratoriet gennem bevillinger BT/PR15450/COE/34/46/2016 og BT/PR3260/BRB/10/967/2011 fra DBT.
An, Y. J., Rowland, S. E., Na, J. H., Spigolon, D., Hong, S. K., Yoon, Y. J. J., et al. (2017). Strukturel og mekanistisk karakterisering af en archaeal-lignende chaperonin fra en termofil bakterie. Nat. Commun. 8:827. doi: 10.1038/s41467-017-00980-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Arora, G., Sajid, A., Virmani, R., Singhal, A., Kumar, C. M. S., Dhasmana, N., et al. (2017). Ser/Thr-protein kinase PrkC-medieret regulering af GroEL er kritisk for biofilmdannelse i Bacillus anthracis. NPJ Biofilms Microbiomes 3:7. doi: 10.1038/s41522-017-0015-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Barreiro, C., González-Lavado, E., Pátek, M., og Martín, J. F. (2004). Transkriptionsanalyse af groES-groEL1-, groEL2- og dnaK-generne i Corynebacterium glutamicum: karakterisering af varmechokinducerede promotorer. J. Bacteriol. 186, 4813-4817. doi: 10.1128/JB.186.14.4813-4817.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Basu, D., Khare, G., Singh, S., Tyagi, A., Khosla, S., og Mande, S. C. (2009). Et nyt nucleoid-associeret protein fra Mycobacterium tuberculosis er et sekvenshomolog af GroEL. Nucleic Acids Res. 37, 4944-4954. doi: 10.1093/nar/gkp502
PubMed Abstract | CrossRef Full Text | Google Scholar
Bernal, V., Castaño-Cerezo, S., Gallego-Jara, J., Écija-Conesa, A., de Diego, T., Iborra, J. L., et al. (2014). Regulering af bakteriel fysiologi ved lysinacetylering af proteiner. N. Biotechnol. 31, 586-595. doi: 10.1016/j.nbt.2014.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohen, S. P., Kralli, A., og Yamamoto, K. R. (1995). Hold ’em and fold’ em: chaperoner og signaltransduktion. Science 268, 1303-1304.
PubMed Abstract | Google Scholar
Bukau, B., og Horwich, A. L. (1998). Hsp70- og Hsp60-chaperonmaskinerne. Cell 92, 351-366. doi: 10.1016/S0092-8674(00)80928-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Canova, M. J., Kremer, L., og Molle, V. (2009). Mycobacterium tuberculosis GroEL1-chaperonet er et substrat for Ser/Thr-proteinkinaser. J. Bacteriol. 191, 2876-2883. doi: 10.1128/JB.01569-08
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, D. H., Madan, D., Weaver, J., Lin, Z., Schröder, G. F., Chiu, W., et al. (2013). Visualisering af GroEL/ES i forbindelse med indkapsling af et foldningsprotein. Cell 153, 1354-1365. doi: 10.1016/j.cell.2013.04.052
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, M. Y., Hartl, F. U., Martin, J., Pollock, R. A., Kalousek, F., Neupert, W., et al. (1989). Mitokondrielt heat-shock-protein hsp60 er afgørende for samling af proteiner importeret i gærmitokondrier. Nature 337, 620-625. doi: 10.1038/337620a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Chilukoti, N., Kumar, C. M., og Mande, S. C. (2015). GroEL2 af Mycobacterium tuberculosis afslører betydningen af strukturel bøjelighed i chaperoninfunktion. J. Bacteriol. 198, 486-497. doi: 10.1128/JB.00844-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Colaco, C. A., og MacDougall, A. (2014). Mycobakterielle chaperoniner: Halen vifter med hunden. FEMS Microbiol. Lett. 350, 20-24. doi: 10.1111/1574-6968.12276
PubMed Abstract | CrossRef Full Text | Google Scholar
Cuéllar, J., Martín-Benito, J., Scheres, S. H., Sousa, R., Moro, F., López-Viñas, E., et al. (2008). Strukturen af CCT-Hsc70 NBD antyder en mekanisme for Hsp70 levering af substrater til chaperoninet. Nat. Struct. Mol. Biol. 15, 858-864. doi: 10.1038/nsmb.1464
PubMed Abstract | CrossRef Full Text | Google Scholar
Dickson, R., Weiss, C., Howard, R. J., Alldrick, S. P., Ellis, R. J., Lorimer, G., et al. (2000). Rekonstituering af højere planters chloroplast chaperonin 60 tetradecamere, der er aktive i proteinfoldning. J. Biol. Chem. 275, 11829-11835. doi: 10.1074/jbc.275.16.11829
PubMed Abstract | CrossRef Full Text | Google Scholar
Duchêne, A. M., Thompson, C. J., og Mazodier, P. (1994). Transkriptionel analyse af groEL-gener i Streptomyces coelicolor A3(2). Mol. Gen. Genet. 245, 61-68. doi: 10.1007/BF00279751
PubMed Abstract | CrossRef Full Text | Google Scholar
Fei, X., Ye, X., LaRonde, N. A., og Lorimer, G. H. (2014). Dannelse og strukturer af GroEL:GroES2 chaperonin fodbolde, den funktionelle form for proteinfoldning. Proc. Natl. Acad. Sci. U.S.A. 111, 12775-12780. doi: 10.1073/pnas.1412922111
PubMed Abstract | CrossRef Full Text | Google Scholar
Figueiredo, L., Klunker, D., Ang, D., Naylor, D. J., Kerner, M. J., Georgopoulos, C., et al. (2004). Funktionel karakterisering af et archaeal GroEL/GroES chaperoninsystem: Betydning af substratindkapsling. J. Biol. Chem. 279, 1090-1099. doi: 10.1074/jbc.M310914200
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischer, H. M., Babst, M., Kaspar, T., Acuña, G., Arigoni, F., og Hennecke, H. (1993). Et medlem af en gro-ESL-lignende chaperonin multigene-familie i Bradyrhizobium japonicum er samreguleret med symbiotiske nitrogenfikseringsgener. EMBO J. 12, 2901-2912.
PubMed Abstract | Google Scholar
George, R., Kelly, S. M., Price, N. C., Erbse, A., Fisher, M., og Lund, P. A. (2004). Tre GroEL-homologer fra Rhizobium leguminosarum har forskellige in vitro-egenskaber. Biochem. Biophys. Res. Commun. 324, 822-828. doi: 10.1016/j.bbrc.2004.09.140
PubMed Abstract | CrossRef Full Text | Google Scholar
Gérard, H. C., Whittum-Hudson, J. A., Schumacher, H. R., og Hudson, A. P. (2004). Differentiel ekspression af tre Chlamydia trachomatis hsp60-kodende gener i aktive vs. vedvarende infektioner. Microb. Pathog. 36, 35-39. doi: 10.1016/j.micpath.2003.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberg, M. S., Zhang, J., Sondek, S., Matthews, C. R., Fox, R. O., og Horwich, A. L. (1997). Native-lignende struktur af et proteinfoldningsintermediat bundet til chaperonin GroEL. Proc. Natl. Acad. Sci. U.S.A. 94, 1080-1085. doi: 10.1073/pnas.94.4.1080
PubMed Abstract | CrossRef Full Text | Google Scholar
Gould, P. S., Burgar, H. R., og Lund, P. A. (2007). Homologe cpn60-gener i Rhizobium leguminosarum er ikke funktionelt ækvivalente. Cell Stress Chaperones 12, 123-131. doi: 10.1379/CSC-227R.1
CrossRef Full Text | Google Scholar
Goyal, K., Qamra, R., og Mande, S. C. (2006). Multiple genduplikation og hurtig evolution i groEL-genet: funktionelle implikationer. J. Mol. Evol. 63, 781-787. doi: 10.1007/s00239-006-0037-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Grandvalet, C., Rapoport, G., og Mazodier, P. (1998). hrcA, der koder for repressoren af groEL-generne i Streptomyces albus G, er associeret med et andet dnaJ-gen. J. Bacteriol. 180, 5129-5134.
Google Scholar
Hall-Stoodley, L., og Stoodley, P. (2005). Biofilmdannelse og -spredning og overførsel af humane patogener. Trends Microbiol. 13, 7-10. doi: 10.1016/j.tim.2004.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Hayer-Hartl, M. K., Martin, J., og Hartl, F. U. (1995). Asymmetrisk interaktion af GroEL og GroES i ATPasecyklussen af assisteret proteinfoldning. Science 269, 836-841. doi: 10.1126/science.7638601
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, J. E., og Hemmingsen, S. M. (2001). Arabidopsis thaliana type I og II chaperoniner. Cell Stress Chaperones 6, 190-200. doi: 10.1379/1466-1268(2001)006<0190:ATTIAI>2.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Hu, Y., Henderson, B., Lund, P. A., Tormay, P., Ahmed, M. T., Gurcha, S. S., et al. (2008). En Mycobacterium tuberculosis-mutant, der mangler den groEL-homolog cpn60.1, er levedygtig, men inducerer ikke et inflammatorisk respons i dyremodeller af infektion. Infect. Immun. 76, 1535-1546. doi: 10.1128/IAI.01078-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Iizuka, R., So, S., Inobe, T., Yoshida, T., Zako, T., Kuwajima, K., et al. (2004). Rolle af den helikale fremspring i konformationsændringen og den molekylære chaperonaktivitet af den arkæale gruppe II-chaperonin. J. Biol. Chem. 279, 18834-18839. doi: 10.1074/jbc.M400839200
PubMed Abstract | CrossRef Full Text | Google Scholar
Joshi, M. C., Sharma, A., Kant, S., Birah, A., Gupta, G. P., Khan, S. R., et al. (2008). Et insekticidholdigt GroEL-protein med chitinbindende aktivitet fra Xenorhabdus nematophila. J. Biol. Chem. 283, 28287-28296. doi: 10.1074/jbc.M804416200
PubMed Abstract | CrossRef Full Text | Google Scholar
Kerner, M. J., Naylor, D. J., Ishihama, Y., Maier, T., Chang, H. C., Stines, A. P., et al. (2005). Proteom-omfattende analyse af chaperonin-afhængig proteinfoldning i Escherichia coli. Cell 122, 209-220. doi: 10.1016/j.cell.2005.05.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, Y. E., Hipp, M. S., Bracher, A., Hayer-Hartl, M., og Hartl, F. U. (2013). Molekylære chaperonfunktioner i proteinfoldning og proteostase. Annu. Rev. Biochem. 82, 323-355. doi: 10.1146/annurev-biochem-060208-092442
PubMed Abstract | CrossRef Full Text | Google Scholar
Kojima, K., og Nakamoto, H. (2007). En ny lys- og varmeresponsiv regulering af groE-transkriptionen i fravær af HrcA eller CIRCE i cyanobakterier. FEBS Lett. 581, 1871-1880. doi: 10.1016/j.febslet.2007.03.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Kol, A., Bourcier, T., Lichtman, A. H., A. H. og Libby, P. (1999). Chlamydial og humant heat shock protein 60s aktiverer humant vaskulært endothel, glatte muskelceller og makrofager. J. Clin. Invest. 103, 571-577. doi: 10.1172/JCI5310
PubMed Abstract | CrossRef Full Text | Google Scholar
Koumoto, Y., Shimada, T., Kondo, M., Hara-Nishimura, I., og Nishimura, M. (2001). Kloroplaster har en ny Cpn10 ud over Cpn20 som co-chaperoniner i Arabidopsis thaliana. J. Biol. Chem. 276, 29688-29694. doi: 10.1074/jbc.M102330200
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumar, C. M., Khare, G., Srikanth, C. V., Tyagi, A. K., Sardesai, A. A., og Mande, S. C. (2009). Faciliteret oligomerisering af mycobakteriel GroEL: bevis for fosforyleringsmedieret oligomerisering. J. Bacteriol. 191, 6525-6538. doi: 10.1128/JB.00652-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumar, S., og Mande, S. (2011). Protein chaperoner og ikke-proteinsubstrater: om substratpromiskuitet af GroEL. Curr. Sci. 100, 1646-1653.
Google Scholar
Kumar, C. M., Mande, S. C., og Mahajan, G. (2015). Flere chaperoniner i bakterier-nye funktioner og ikke-kanoniske adfærd. Cell Stress Chaperones 20, 555-574. doi: 10.1007/s12192-015-0598-8
CrossRef Full Text | Google Scholar
Lindquist, S. (1986). Varmestødreaktionen. Annu. Rev. Biochem. 55, 1151-1191. doi: 10.1146/annurev.bi.55.070186.005443
PubMed Abstract | CrossRef Full Text | Google Scholar
Lindquist, S., og Craig, E. A. (1988). Hedeshock-proteinerne. Annu. Rev. Genet. 22, 631-677. doi: 10.1146/annurev.ge.22.120188.003215
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, F., Yang, M., Wang, X., Yang, S., Gu, J., Zhou, J., et al. (2014). Acetylome-analyse afslører forskellige funktioner af lysinacetylering i Mycobacterium tuberculosis. Mol. Cell. Proteomics 13, 3352-3366. doi: 10.1074/mcp.M114.041962
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, Z., Chen, Y., Aponte, A. M., A. M., Battaglia, V., Gucek, M., og Sack, M. N. (2015). Forlænget faste identificerer heat shock protein 10 som et Sirtuin 3-substrat, der belyser en ny mekanisme, der forbinder mitokondriel proteinacetylering med fedtsyreoxidationsenzymets foldning og funktion. J. Biol. Chem. 290, 2466-2476. doi: 10.1074/jbc.M114.606228
PubMed Abstract | CrossRef Full Text | Google Scholar
Lund, P. A. (2009). Flere chaperoniner i bakterier – hvorfor så mange? FEMS Microbiol. Rev. 33, 785-800. doi: 10.1111/j.1574-6976.2009.00178.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Mande, S. C., Mehra, V., Bloom, B. R., og Hol, W. G. (1996). Struktur af heat shock-proteinet chaperonin-10 fra Mycobacterium leprae. Science 271, 203-207. doi: 10.1126/science.271.5246.203
PubMed Abstract | CrossRef Full Text | Google Scholar
McNally, D., og Fares, M. A. (2007). In silico identifikation af funktionel divergens mellem de mange groEL-genparaloger i Chlamydiae. BMC Evol. Biol. 7:81. doi: 10.1186/1471-2148-7-81
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, K. L., og Cowan, N. J. (1998). En enkelt ring er tilstrækkelig til produktiv chaperonin-medieret foldning in vivo. Mol. Cell 2, 93-99. doi: 10.1016/S1097-2765(00)80117-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Ogawa, J., og Long, S. R. (1995). Rhizobium meliloti groELc locus er påkrævet for regulering af tidlige nod gener af transkriptionsaktivatoren NodD. Genes Dev. 9, 714-729. doi: 10.1101/gad.9.6.714
PubMed Abstract | CrossRef Full Text | Google Scholar
Ojha, A., Anand, M., Bhatt, A., Kremer, L., Jacobs, W. R., og Hatfull, G. F. (2005). GroEL1: en dedikeret chaperon involveret i mycolsyrebiosyntese under biofilmdannelse i mycobakterier. Cell 123, 861-873. doi: 10.1016/j.cell.2005.09.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Qamra, R., og Mande, S. C. (2004). Krystalstruktur af 65-kilodalton varmechokprotein, chaperonin 60.2, fra Mycobacterium tuberculosis. J. Bacteriol. 186, 8105-8113. doi: 10.1128/JB.186.23.8105-8113.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Qamra, R., Srinivas, V., og Mande, S. C. (2004). Mycobacterium tuberculosis GroEL-homologer eksisterer usædvanligt som lavere oligomerer og bevarer evnen til at undertrykke aggregering af substratproteiner. J. Mol. Biol. 342, 605-617. doi: 10.1016/j.jmb.2004.07.066
PubMed Abstract | CrossRef Full Text | Google Scholar
Rajaram, H., og Apte, S. K. (2010). Differentiel regulering af groESL operon ekspression som reaktion på varme og lys i Anabaena. Arch. Microbiol. 192, 729-738. doi: 10.1007/s00203-010-0601-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ranson, N. A., White, H. E., og Saibil, H. R. (1998). Chaperoniner. Biochem. J. 333(Pt 2), 233-242. doi: 10.1042/bj3330233
PubMed Abstract | CrossRef Full Text | Google Scholar
Richter, K., Haslbeck, M., og Buchner, J. (2010). Varmechokreaktionen: liv på dødens rand. Mol. Cell 40, 253-266. doi: 10.1016/j.molcel.2010.10.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Rinke de Wit, T. F., Bekelie, S., Osland, A., Miko, T. L., Hermans, P. W., van Soolingen, D., et al. (1992). Mycobakterier indeholder to groEL-gener: det andet Mycobacterium leprae groEL-gen er arrangeret i et operon med groES. Mol. Microbiol. 6, 1995-2007. doi: 10.1111/j.1365-2958.1992.tb01372.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Robinson, C. V., Gross, M., Eyles, S. J., Ewbank, J. J., Mayhew, M., Hartl, F. U., et al. (1994). Konformation af GroEL-bundet alfa-lactalbumin undersøgt ved massespektrometri. Nature 372, 646-651. doi: 10.1038/372646a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Saibil, H. R., Fenton, W. A., Clare, D. K., og Horwich, A. L. (2013). Struktur og allosteri af chaperoninet GroEL. J. Mol. Biol. 425, 1476-1487. doi: 10.1016/j.jmb.2012.11.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Sameshima, T., Ueno, T., Iizuka, R., Ishii, N., Terada, N., Okabe, K., et al. (2008). Fodbold- og kugleformede GroEL-GroES-komplekser eksisterer samtidig under reaktionscyklussen. J. Biol. Chem. 283, 23765-23773. doi: 10.1074/jbc.M802541200
PubMed Abstract | CrossRef Full Text | Google Scholar
Sato, S., Ikeuchi, M., og Nakamoto, H. (2008). Ekspression og funktion af en groEL-paralog i den termofile cyanobakterie Thermosynechococcus elongatus under varme og kulde stress. FEBS Lett. 582, 3389-3395. doi: 10.1016/j.febslet.2008.08.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Schirmer, E. C., Glover, J. R., Singer, M. A., og Lindquist, S. (1996). HSP100/Clp-proteiner: en fælles mekanisme forklarer forskellige funktioner. Trends Biochem. Sci. 21, 289-296. doi: 10.1016/S096868-0004(96)10038-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharkia, R., Bonshtien, A. L., Mizrahi, I., Weiss, C., Niv, A., Lustig, A., et al. (2003). Om den oligomeriske tilstand af chloroplast chaperonin 10 og chaperonin 20. Biochim. Biophys. Acta 1651, 76-84. doi: 10.1016/S1570-9639(03)00237-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharma, A., Rustad, T., Mahajan, G., Kumar, A., Rao, K. V., Banerjee, S., et al. (2016). Mod forståelse af den biologiske funktion af den usædvanlige chaperonin Cpn60.1 (GroEL1) af Mycobacterium tuberculosis. Tuberc. Edinb. Scotl. 97, 137-146. doi: 10.1016/j.tube.2015.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Tang, Y. C., Chang, H. C., Roeben, A., Wischnewski, D., Wischnewski, N., Kerner, M. J., et al. (2006). Strukturelle træk ved GroEL-GroES-nanoburet, der er nødvendige for hurtig foldning af indkapslet protein. Cell 125, 903-914. doi: 10.1016/j.cell.2006.04.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Techtmann, S. M., og Robb, F. T. (2010). Archaeal-lignende chaperoniner i bakterier. Proc. Natl. Acad. Sci. U.S.A. 107, 20269-20274. doi: 10.1073/pnas.1004783107
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsai, Y. C., Mueller-Cajar, O., Saschenbrecker, S., Hartl, F. U., og Hayer-Hartl, M. (2012). Chaperonin cofaktorer, Cpn10 og Cpn20, fra grønalger og planter fungerer som hetero-oligomeriske ringkomplekser. J. Biol. Chem. 287, 20471-20481. doi: 10.1074/jbc.M112.365411
PubMed Abstract | CrossRef Full Text | Google Scholar
Viitanen, P. V., Lorimer, G. H., Seetharam, R., Gupta, R. S., Gupta, R. S., Oppenheim, J., Thomas, J. O., et al. (1992). Mammalian mitochondrial chaperonin 60 fungerer som en enkelt toroidal ring. J. Biol. Chem. 267, 695-698.
PubMed Abstract | Google Scholar
Wang, Y., Zhang, W. Y., Zhang, Z., Z., Li, J., Li, Z. F., Li, Z. F., Tan, Z. G., et al. (2013). Mekanismer, der er involveret i den funktionelle divergens af duplikerede GroEL-chaperoniner i Myxococcus xanthus DK1622. PLoS Genet. 9:e1003306. doi: 10.1371/journal.pgen.1003306
PubMed Abstract | CrossRef Full Text | Google Scholar
Ye, X., og Lorimer, G. H. (2013). Substratprotein skifter GroE-chaperoniner fra asymmetrisk til symmetrisk cykling ved at katalysere nukleotidudveksling. Proc. Natl. Acad. Sci. U.S.A. 110, E4289-E4297. doi: 10.1073/pnas.1317702110
PubMed Abstract | CrossRef Full Text | Google Scholar