Givet de mange funktioner, som en bioreaktor skal udføre, undrer du dig måske over, hvordan den kan klare det hele. Hvilke komponenter har den brug for? Hvordan ved du, hvordan forholdene i bioreaktoren er i øjeblikket, og hvordan du kan korrigere dem? Og endelig, bare for perspektivets skyld: Hvordan tager du de data, der opsamles under en batch-bioproces, viser dem på en meningsfuld måde og derefter gemmer og evaluerer dem, mens du holder dem organiseret?
De vigtigste procesparametre og mekanismerne til regulering af dem er dækket nedenfor:
- Kulturblanding
- Temperaturstyring
- pH-kontrol
- Fodering af næringsstoffer
- Gasning
- Tryk kontrol
- Forebyggelse af skumdannelse
Kulturblanding
Kulturen i en bioreaktor skal hele tiden blandes grundigt. Hvis næringsstofferne i bioreaktoren ikke spredes godt nok, vil forholdene i visse dele af bioreaktoren afvige væsentligt fra det ideelle. pH-værdien kan f.eks. være for sur, eller tilførslen af næringsstoffer kan være utilstrækkelig. Sådanne afvigelser reducerer ikke kun effektiviteten af den planlagte bioproces, men kan også fremme genetiske ændringer. Temperaturfordelingen er et andet problem. Uden en ensartet omrøring vil mikroorganismerne eller cellekulturerne langs kanten af beholderen bogstaveligt talt blive kogt, mens mikroorganismerne eller cellekulturerne i midten får kolde fødder. Hvis De nogensinde har opvarmet suppe i mikrobølgeovnen og derefter spist den med stor forventning uden at røre i den, ved De, hvad vi mener.
Den typiske omrøringshastighed varierer bl.a. afhængigt af den dyrkede organisme:
| Organisme | Blandingshastighed | ||||
| Bakterier, Gær, Svampe | 500 – 1500 min-1 | ||||
| Spattedyr, Insekt- eller planteceller | 30 – 300 min-1 | ||||
Ajustering af omrøringshastigheder til dyrkning af enten mikroorganismer, planteceller, dyreceller eller insektceller er meget vigtig, da disse reagerer forskelligt på forskydningsstress, dvs.e., den mekaniske belastning, der forårsages af omrøring. Afhængigt af cellelinjen kan cellekulturer reagere meget mere intenst på alt for kraftig omrøring, dvs. de dør simpelthen, en tendens, som forskerne mere præcist (og diplomatisk) beskriver som værende “følsomme over for shear stress”. Ilttilgængeligheden kan varieres under bioprocessen ved at ændre omrøringshastigheden og dermed sikre optimal cellevækst.
Måling og styring af temperaturen
Mikroorganismer såvel som cellekulturer har enzymer, der fungerer bedst inden for bestemte temperatur- og pH-intervaller. Hvis forholdene falder uden for disse områder, vil den ønskede bioproces skride meget langsommere frem, fordi vækst og metabolisk ydeevne er stærkt afhængige af disse enzymer, dvs. katalytisk aktive proteiner. I værste fald kan ugunstige miljøforhold endog ødelægge dem. Pattedyrscellekulturer har det bedst inden for et meget snævert temperaturområde – et område, der kun er til stede fra deres perspektiv, når temperaturen inde i kulturkarret er 37 °C.
Der anvendes derfor en platinmodstandssensor, kendt som en Pt100-sensor, i bioreaktoren til at bestemme temperaturen. Den har en modstand på 100 Ω ved 0 °C og dækker det forventede biologisk relevante måleområde ganske godt, når den er kalibreret korrekt.
Det typiske temperaturområde varierer bl.a. afhængigt af den dyrkede organisme:
| Organisme | Temperaturområde | ||||
| Bakterier, Gær, Svampe | +20 °C til +60 °C | ||||
| Spattedyr, Insekt- eller planteceller | +25 °C til +37 °C | ||||
Hvis du arbejder ved temperaturer tæt på eller under stuetemperatur, har du brug for et aktivt kølesystem, f.eks. et recirkulerende kølesystem. For de fleste bioprocesser bør temperaturen forblive konstant under hele dyrkningen. For nogle produkter, f.eks. penicillin eller rekombinante proteiner (dvs. bioteknologisk fremstillede proteiner ved hjælp af genetisk modificerede organismer), aktiverer en ændring af temperaturen i slutningen af vækstfasen imidlertid vigtige gener for produktdannelsen og er derfor gavnlig. Ved produktionsmetoder, der involverer cellekulturer, sænkes temperaturen undertiden også i slutningen af bioprocessen (en teknik, der er kendt som “temperaturforskydning” inden for bioteknologi), således at det færdige produkt forbliver stabilt til senere brug.
Der er flere måder at bruge et varme- og/eller kølekredsløb til at regulere temperaturen på:
-
-
- En elektrisk varmeblok med indbygget kølespiral
- En silikonevarmeblok, der er viklet rundt om dyrkningsbeholderen efter sterilisering
- En dobbelt kappe, hvori der cirkuleres vand. Temperaturen justeres via et elektrisk varmelegeme eller damp og en magnetventil til kølevandsindtag
-
Måling og styring af pH
Måling og styring af pH er et meget vigtigt aspekt af bioprocesser, da ændringer i pH kan ændre vækstbetingelserne betydeligt – som regel med store konsekvenser. Kulturmedier indeholder almindeligvis buffere, dvs. stoffer, der afbøder alt for pludselige ændringer i pH-værdien som følge af tilsætning af en syre eller base. Da en syre, der drypper ned i kulturmediet, kan skade mange cellelinjer, beriger forskerne ofte omhyggeligt den gasblanding, der anvendes i cellekulturen, med CO2 i stedet for at tilsætte en flydende syre. Gassen opløses derefter i kulturmediet, så kuldioxiden kan påvirke pH-værdien i kombination med en buffer.
Typiske pH-intervaller afhængigt af den dyrkede organisme:
| Organisme | pH | ||||
| Bakterier, Gær, Svampe | 4.5 – 7.0 | ||||
| Spattedyrceller | 6.7 – 7,4 | ||||
| Insektceller | 6,2 – 6,9 | ||||
| Planteceller | 5.5 | ||||
Til måling af pH under bioprocessen er hver bioreaktor udstyret med en pH-sensor, en såkaldt kombinationselektrode for pH. Bioreaktoren kan korrigere eventuelle afvigelser i pH-værdien; til dette formål stilles en syre og/eller en basisk opløsning til rådighed og forbindes til kulturbeholderen via slanger og pumper. Koncentrationen af syre og base skal vælges omhyggeligt, for at dette kan fungere – hvis den er for høj, kan dråberne af koncentreret syre eller base beskadige mikroorganismerne og cellekulturerne, inden de fordeles i bioreaktoren. Hvis koncentrationen derimod er for lav, skal operatørerne tilsætte mere syre eller base, hvilket unødigt fortynder kulturmediet.
Tilførsel af næringsstoffer
Under en bioproces forbruger mikroorganismerne normalt en bred vifte af næringsstoffer. Den grundlæggende sammensætning af et næringsmedium består normalt af vand, en brugbar energikilde for organismen (f.eks. glukose) samt de næringsstoffer, den har brug for (kulstof, kvælstof og fosfor), salte og sporstoffer. Afhængigt af organismen er der behov for andre forbindelser, som ikke kan syntetiseres af organismen selv (vitaminer, essentielle aminosyrer osv.).
Afhængigt af bioprocesstrategien stilles disse næringsstoffer enten alle til rådighed i begyndelsen af en bioproces (batch-bioproces) eller tilsættes over tid, f.eks. i en fed-batch-proces eller i en kontinuerlig proces.
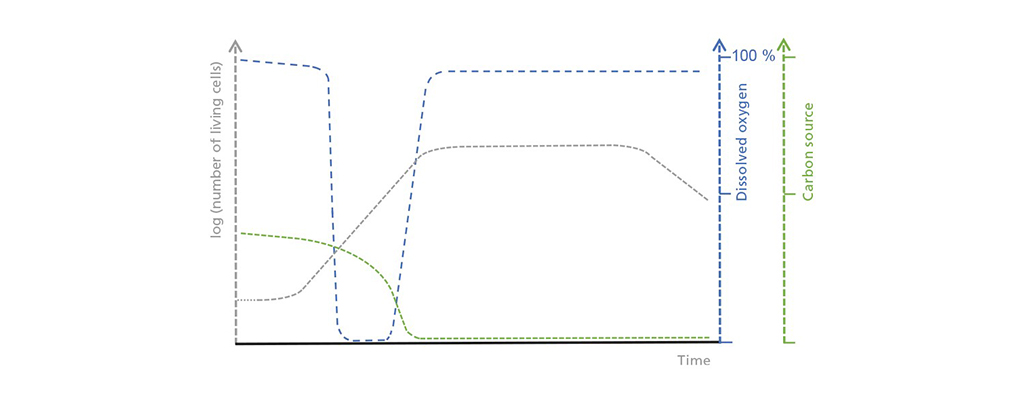
Skematisk illustration af sammenhængen mellem koncentrationen af levende celler, opløst ilt og den begrænsende kulstofkilde i batchdrift. I den indledende forsinkelsesfase stiger antallet af levende celler kun langsomt, hvilket fører til en moderat, men stabil optagelse af kulstofkilden. Iltforbruget stiger i den eksponentielle vækstfase, indtil det overstiger den mulige ilttilførsel. Når kulstofkilden er opbrugt, starter den stationære fase, som efterfølges af en død fase, hvor antallet af levende celler falder drastisk.
Hvis du gerne vil vide mere om de forskellige fodringsstrategier, så tag et kig på vores blogindlæg: Forskellen mellem batch-, Fed-batch- og kontinuerlige processer.
Gasning
Under bioprocessen tilføres der i bioreaktoren en steril gasblanding, f.eks. luft, til kulturmediet. Konstant omrøring fordeler ikke blot næringsstofferne – den reducerer også størrelsen af de gasbobler, der opstår i kulturbeholderen, og frigiver dermed effektivt ilt til næringsopløsningen. Dette er vigtigt, fordi mikroorganismer og cellekulturer kun kan optage den ilt, der er opløst i næringsopløsningen.
Syrebehovet varierer: aerobe bakterier har brug for ilt, mens andre foretrækker gasblandinger som f.eks. syntesegas (“syntesegas”). Anaerobe organismer kan derimod helt undvære gasning, idet de kun ernærer sig af uorganiske og organiske stoffer fra kulturmediet som f.eks. nitrat eller fumarat.
I modsætning til mikroorganismer gasses cellekulturer med mere end blot luft – iltindholdet i gasblandingen kan også påvirkes ved hjælp af rent kvælstof og ren ilt. Den nøjagtige sammensætning afhænger af cellekulturanvendelsen. For at holde gasatmosfæren konstant har bioreaktoren brug for præcise kontrolsystemer.
I begyndelsen af bioprocessen har en kultur f.eks. ofte brug for mindre ilt – og dermed en mindre gastilførsel – da væksten stadig skrider langsomt frem. Senere kræver en hurtigere vækst imidlertid meget mere ilt. Ud over at sikre en konstant tilførsel af den ønskede gas eller gasblanding leverer bioreaktoren også den rigtige mængde gas på det rigtige tidspunkt. For at gøre dette har bioreaktoren gasporte, der er forbundet med trykluft fra bygningen, en kompressor eller en gasflaske.
Gasningshastigheden måles normalt i liter pr. minut. For at få en generisk parameter, der kan anvendes på forskellige bioreaktorer, angives hastigheden også ofte som den specifikke gasningshastighed, der henviser til multipla af arbejdsvolumenet (beholdervolumener pr. minut, vvm) og udtrykkes som min-1. En typisk værdi for mikrobielle bioprocesser er 1 til 1,5 gange arbejdsvolumenet pr. minut. For en bioreaktor med et arbejdsvolumen på 4 L vil den maksimale gasningshastighed derfor være 4 L * 2 L L L-1 min-1 = 8 L min-1. I cellekulturer er den maksimale hastighed derimod ofte 10 til 15 % af arbejdsvolumenet pr. minut som en måde at holde gasboblerne små på og dermed forhindre skumdannelse og skader på cellerne fra sprængte bobler.
Ændring af gasningshastigheden er imidlertid ikke den eneste måde at styre effektiviteten, hvormed bioreaktoren tilfører ilt og andre gasser til kulturmediet. Jo større overfladearealet af det samlede antal af alle gasbobler i bioreaktoren er – dvs. jo mere fint fordelt selve gasboblerne er – jo mere effektivt vil ilten blive overført fra gasfasen til den flydende fase. Det betyder f.eks. at en forøgelse af omrøringshastigheden kan forbedre iltningen for mikroorganismerne, da omrøreren gør gasboblerne endnu mindre og dermed øger det samlede overfladeareal af alle gasbobler i bioreaktoren.
En præcis regulering af pO2 – og dermed en præcis styring af gasningshastigheden og gassammensætningen – er meget vigtig, da pO2 normalt ikke bør være den væksthæmmende faktor for kulturen. Hvis den ikke kontrolleres tilstrækkeligt, bliver pO2 imidlertid den begrænsende faktor.
Da gastilførslen til bioreaktoren normalt er tør, kan fugt fra bioreaktoren opsamles i udgangsstrømmen under gasningen. Ved en høj gasningshastighed vil ikke blot fyldningsniveauet falde, men fugten vil også blokere udluftningsfilteret, hvilket forhindrer en korrekt udluftning i at finde sted og tillader opbygning af tryk. For at undgå denne effekt er bioreaktorer udstyret med en effektiv udstødningskøler, hvor fugten i udstødningen kondenserer og kan dryppe tilbage i bioreaktoren, inden den når udstødningsfilteret.
Måling og styring af trykket
Jo højere trykket i beholderen er, jo mere ilt opløses der. Kulturkar af glas er ofte kun godkendt til et tryk på op til 0,5 bar, hvilket ikke engang er halvdelen af trykket i et moderat fyldt cykeldæk. Ved et højere driftstryk kan let beskadigede kulturkar af glas sprænges, hvilket er en sikkerhedsrisiko. Derfor bør du altid sikre en fri, trykfri udluftningsledning fra bioreaktoren ved at holde udluftningsfilteret tørt og udskifte det regelmæssigt – i den forbindelse sikrer du naturligvis også kulturkarrets integritet. I modsætning til kulturbeholdere af glas er bioreaktorer af rustfrit stål konstrueret til højere tryk, og selv i deres standardkonfiguration er de egnede til tryk på op til 2 bar (et godt fyldt cykeldæk). Desuden er systemer som disse ofte udstyret med en trykstyringsmekanisme baseret på en tryksensor i bioreaktoren og en proportionalventil i udstødningsledningen. Disse kan ikke blot måle trykket i bioreaktoren – de kan også aktivt styre det.

Forebyggelse af skumdannelse
Ude for badekar og ølglas er skum en ret upopulær bivirkning, især i bioreaktorer. Skum dannes ved grænsefladen mellem væske- og gasfasen i kulturbeholderen og kan hurtigt finde vej op under den øverste plade. I værste fald blokerer det så udstødningsfilteret, som igen blokerer for gasstrømmen. De fleste bioreaktorer er derfor udstyret med et system til bekæmpelse af skumdannelse. Mekaniske skumdæmpere i headspace er forbeholdt ret store bioreaktorer i rustfrit stål, mens skumdæmpningssystemer baseret på kemiske midler (f.eks. PPG, Struktol eller silikonebaserede skumdæmpere) findes i mindre bioreaktorer.
Et typisk skumdæmpningssystem består af en sensor, der er installeret i en bestemt højde i kulturbeholderen. Hvis skumhøjden når op til sensoren, pumpes et skumdæmpende middel fra et reservoir ind i kulturkarret. Disse skumdæmpende midler er aktive ved grænsefladen mellem væske og gas og øger skumboblernes tendens til at kollapse. I særligt genstridige tilfælde, hvor skummet ikke opløses med det samme, gentages proceduren efter en forudindstillet tid (en “shot & delay”-strategi). Forsigtighed er tilrådeligt, når du bruger et skumdæmpende middel – hvis du doserer bare lidt mere end nødvendigt, kan det ligge som en anden hud på væskens overflade, hvilket hindrer gasudvekslingen. Skumdæmpende midler modvirker også en effektiv iltoverførsel, fordi ændringen i overfladespændingen fremmer kollapset af gasbobler i bioreaktoren og dermed reducerer det overfladeareal, der er tilgængeligt for gasudveksling. Valget af det passende middel afhænger også af den pågældende bioproces, fordi bakterier og celler reagerer forskelligt på visse kemikalier.
Bonus: Fordelene ved at bruge en SCADA-software
I dag bør de resultater, der genereres i en bioreaktor, indsamles og evalueres så centralt som muligt, da dette er den eneste måde, hvorpå man effektivt kan implementere moderne big data-algoritmer med henblik på at generere flere oplysninger og bedre forstå, hvordan en proces fungerer. Det er SCADA-softwarens opgave. I det første trin kan alle data fra bioreaktoren læses ud – uden større input fra brugerens side – og gemmes centralt for at kunne evaluere dem alene eller sammenligne dem med andre batchdata. Dette giver hurtigt ideer til nye eksperimenter og måske endda til komplekse batchstrategier. Med en professionel SCADA-software kan du nemt planlægge disse og derefter styre bioreaktoren, som ideelt set vil være en fuldt automatiseret proces. Desuden integrerer SCADA-softwaren også flere komponenter i bioreaktormiljøet. Disse omfatter værktøjer til procesoptimering ved hjælp af design-of-experiment-teknikken (DoE) eller kraftfulde softwaresensorer, som samtidig kan bruges til at beregne yderligere oplysninger direkte fra batchprocessens parametre og endda til at regulere disse parametre. For eksempel kan respiratorisk kvotient (RQ) bruges til at opnå et skøn over metabolisk aktivitet ved hjælp af forholdet mellem udskilt kuldioxid og absorberet ilt.
Der er så mange muligheder – især når bioreaktoren og SCADA-softwaren er perfekt afstemt – at vi umuligt kan beskrive dem alle. Hvis du er interesseret i at lære mere om alt det, som en moderne SCADA-software har at tilbyde, skal du se eve® bioprocess platform software
