Indledning
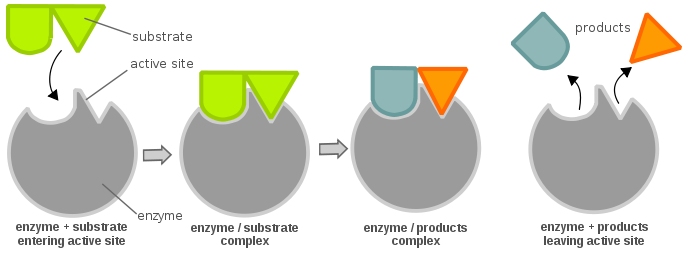
Et enzyms aktive steder består normalt af aminosyrerester; afhængigt af hvilke aminosyrerester der er til stede, kan substratets specificitet variere meget. Afhængigt af pH-niveauet kan et enzyms fysiske egenskaber (hovedsagelig den elektriske ladning) ændres. En ændring i den elektriske ladning kan ændre interaktionen mellem aminosyreresterne på det aktive sted og det indkommende substrat. Når det er sagt, kan substratet binde sig til det aktive sted via hydrogenbinding eller van der Waals-kræfter. Når substratet binder sig til det aktive sted, danner det et enzym-substratkompleks, som derefter er involveret i yderligere kemiske reaktioner.
For at et enzym kan være aktivt og være energimæssigt gunstigt for at lade en kemisk reaktion skride fremad, skal et substrat binde til et enzyms “aktive sted”. Et aktivt sted kan opfattes som en lås og substratet som en nøgle; dette er kendt som lås og nøgle-modellen. En nøgle (substrat) skal indsættes og drejes (kemisk reaktion), hvorefter låsen (enzym) åbnes (produktion af produkter). Bemærk, at et enzym kan have mere end ét aktivt sted. En anden teori om forholdet mellem det aktive sted og substrat er teorien om induceret tilpasning, som er det stik modsatte af lås og nøgle-teorien (hvor det aktive sted tilsyneladende er ufleksibelt). I teorien om induced fit er enzymets aktive sted meget fleksibelt og ændrer kun sin konformation, når substratet binder sig til det.
Enzymer virker som katalysator ved at sænke den frie Gibbs-energi for aktivering af enzym-substrat-komplekset. Nedenfor er to figurer, der viser en grundlæggende enzymatisk reaktion med og uden katalysator:
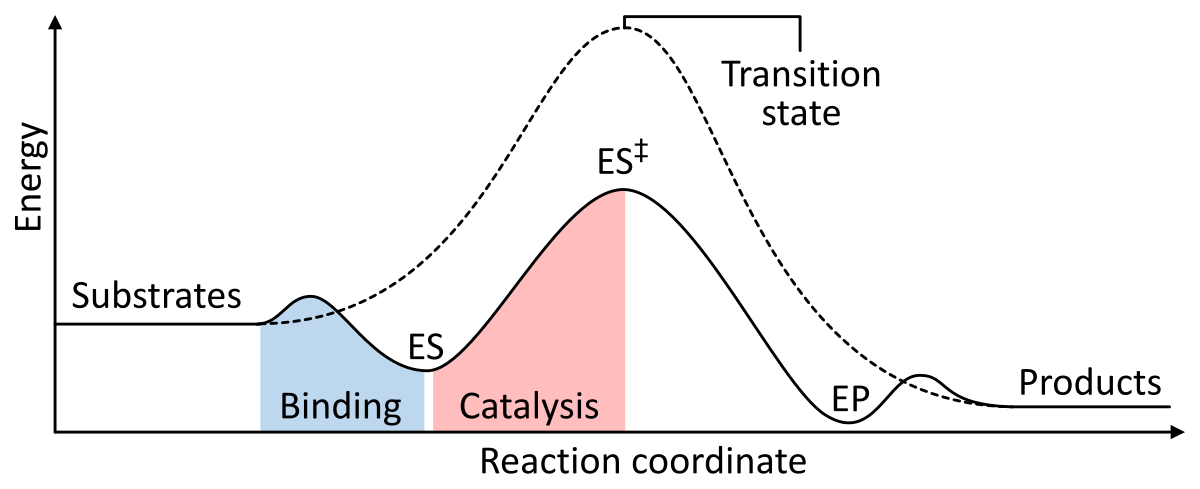
Figur 1: Energierne i faserne i en kemisk reaktion. Uden katalysator (stiplet linje) skal substratet bruge meget aktiveringsenergi for at nå en overgangstilstand, som derefter henfalder til produkter med lavere energi. Når enzymet er katalyseret (gennemgående linje), binder enzymet substraterne (ES) og stabiliserer derefter overgangstilstanden (ES‡) for at reducere den aktiveringsenergi, der er nødvendig for at fremstille produkter (EP), som til sidst frigives. fra Wikipedia.
Enzymets effektivitet kan bestemmes på følgende måde: Betragt en simpel enzymatisk reaktion:
Den tyske biokemiker Leonor Michaelis og den canadiske biokemiker Maud Menten udledte en ligning, der beskriver dette system, senere kendt som “Michaelis-Menten-ligningen”, vist nedenfor:
\}{K_M + } \tag{1}\]
Denne ligning giver reaktionshastigheden ved en given substratkoncentration under forudsætning af en kendt Vmax, som er den maksimale hastighed, som reaktionen kan forløbe med, og KM, Michaelis-konstanten. I en praktisk anvendelse af Michaelis-Menten-princippet måles V0 imidlertid ofte, og Vmax observeres som en mætning eller et plateau i et dataplot. Da substratkoncentrationen er kendt, er KM normalt den beregnede værdi af interesse.
For \(K_M\) antages \(V_0= \dfrac{V_{max}}}{2}\):
\}{K_M + } \tag{2}\]
\) \dfrac{V_{max}}}{2} = V_{max} \tag{3}\]
\ = \dfrac{V_{max}}}{\dfrac{V_{max}}}{2}}} \tag{4} \]
\ = 2 \tag{5}\]
\ \tag{6}\]
Michaelis-konstanten kan opfattes som den hastighed, hvormed substratet bliver løsrevet fra enzymet, hvilket enten kan ske ved, at substrat-enzymkomplekset bliver til produktet, eller at substratet bliver løsrevet fra enzymet. KM kan vises som en ligning:
\
Hvor k-1 er den hastighedskonstant, hvormed substratet bliver ubundet til enzymet, hvilket resulterer i dissociation af enzym-substratkomplekset, k2 er den hastighedskonstant, hvormed substrat-enzymkomplekset forsvinder og bliver til produkt, og K1 er hastighedskonstanten for dannelsen af substrat-enzymkomplekset dannelse af substrat-enzymkomplekset. KM kan derfor ses som hastigheden for substrat-enzymkompleksets forsvinden divideret med hastigheden for dannelse af substrat-enzymkomplekset, hvilket er det niveau, hvor halvdelen af substratet er bundet til enzymet. KM er en nyttig indikator for tilstedeværelsen af en inhibitor, fordi vi kan se efter ændringer i KM og sammenligne med vores kontrol (biologiske systemer, som vi ved, at der ikke er nogen inhibitor til stede). KM er en afhængig variabel, og dens værdi kan ændre sig af mange årsager, herunder systemets pH-værdi, temperatur eller andre forhold, der kan påvirke en kemisk reaktion. En lille KM indikerer, at substratet har en høj affinitet for enzymet.
Michaelis-Menten-ligningen er mest nyttig til måling af enzymeffektivitet, hvis v0 plottes mod , som følger:
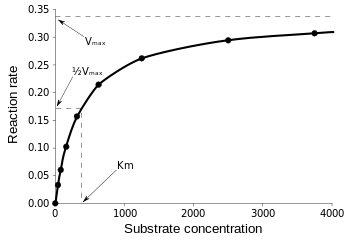
Figur 3: Diagram over reaktionshastighed og Michaelis-Menten-konstant. fra Wikipedia.
Vmax er den maksimale hastighed, hvormed reaktionen kan forløbe, uanset , hvilket betyder, at selv hvis man tilføjer mere substrat, kan reaktionen ikke gå hurtigere. Det skyldes, at ved Vmax er alle de aktive steder på enzymet besat. Efter alle forklaringerne om de forskellige former for enzymkinetiske ligninger når vi frem til vores konklusion om katalytisk effektivitet. Hvis vi vender tilbage til figur 3, har vi:
\_o}{\dfrac{k_{-1} + k_2}{k_1} + }\right) \tag{8}\]
Bemærk \(k_2\) beskriver en irreversibel reaktion i modsætning til et ligevægtsudtryk, når man sammenligner med k-1 og k1. k2 er her også kendt som kcat, enzymets katalytiske effektivitet. Ud fra den foregående diskussion er v0 den målte reaktionshastighed, som er produktdannelsen over tid, så det kan konkluderes, at en ligning ville se ud som følgende:
\}{dt} = k_2_0 \tag{9}\]
Hvor 0 er den samlede enzymkoncentration.
Det er også kendt, at VMax observeres, når hele enzym-substratkomplekset forsvinder og bliver til produkter, så vi kan foretage følgende antagelse:
\_0 \tag{10} \]
og efter omlægning har vi denne ligning:
\_0} \tag{11}\]
Dette er ligningen til beregning af den katalytiske effektivitet, der skal anvendes, når vi har fået data fra eksperimenter og efter at vi har anvendt Michaelis-Menten-ligningen. Med en større kcat , er enzymet effektivt, fordi der er brug for mindre enzym.