Apoptose

Apoptose, eller programmeret celledød, er en meget reguleret måde, hvorpå en organisme selektivt kan fjerne celler. Denne proces spiller en vigtig rolle i embryogenese, opretholdelse af en organismes størrelse og eliminering af beskadigede eller afvigende celler. Apoptosens betydning for menneskers sundhed understreges af de mange sygdomme, der skyldes afvigende apoptose. Dysregulering af apoptose er blevet forbundet med forskellige kræftformer, neurologiske og kardiovaskulære lidelser og autoimmune sygdomme.
Vi skelner almindeligvis mellem to forskellige typer apoptose: den intrinsiske vej, der formidles af mitokondrier som reaktion på interne stimuli såsom DNA-skader, og den ekstrinsiske vej, der formidles af ekstracellulære dødsreceptorer (f.eks. binding af FasL til FasLG-receptoren) (Figur 1). Begge veje er afhængige af proteaser kaldet initiatorcaspaser, der aktiverer en kaskade af effektorcaspaser, hvilket fører til apoptose. Crosstalk mellem de intrinsiske og ekstrinsiske veje formidles via BH-3 interagerende domæne-dødsagonist (Bid).
Den intrinsiske vej (figur 1) initieres af Bcl-2-homologiproteiner. I den klassiske apoptosevej aktiveres Bcl-2-proteinerne Bax og Bak som reaktion på interne stimuli som f.eks. DNA-skader eller oxidativ stress. Disse to proteiner interagerer efterfølgende med Bid og indsættes i den ydre mitokondrielle membran. Dette resulterer i det, der betragtes som det punkt, hvor der ikke er nogen vej tilbage i apoptose – mitokondriel ydre membranpermeabilisering (MOMP). MOMP fører til frigivelse af pro-apoptotiske faktorer som f.eks. cytochrom c i cytoplasmaet. Cytokrom c i cytoplasmaet binder APAF-1 og dATP for at rekruttere pro-caspase- 9, hvorved apoptosomet dannes. Apoptosomdannelsen udløser spaltning af pro-caspase-9 til dets aktive proteaseform, caspase-9. Caspase-9 er en initiatorcaspase, der derefter aktiverer nedstrøms effektorcaspaser, såsom caspase-3 og -7, gennem proteolyse, hvilket udløser caspaskaskaskaden, der fører til apoptose.
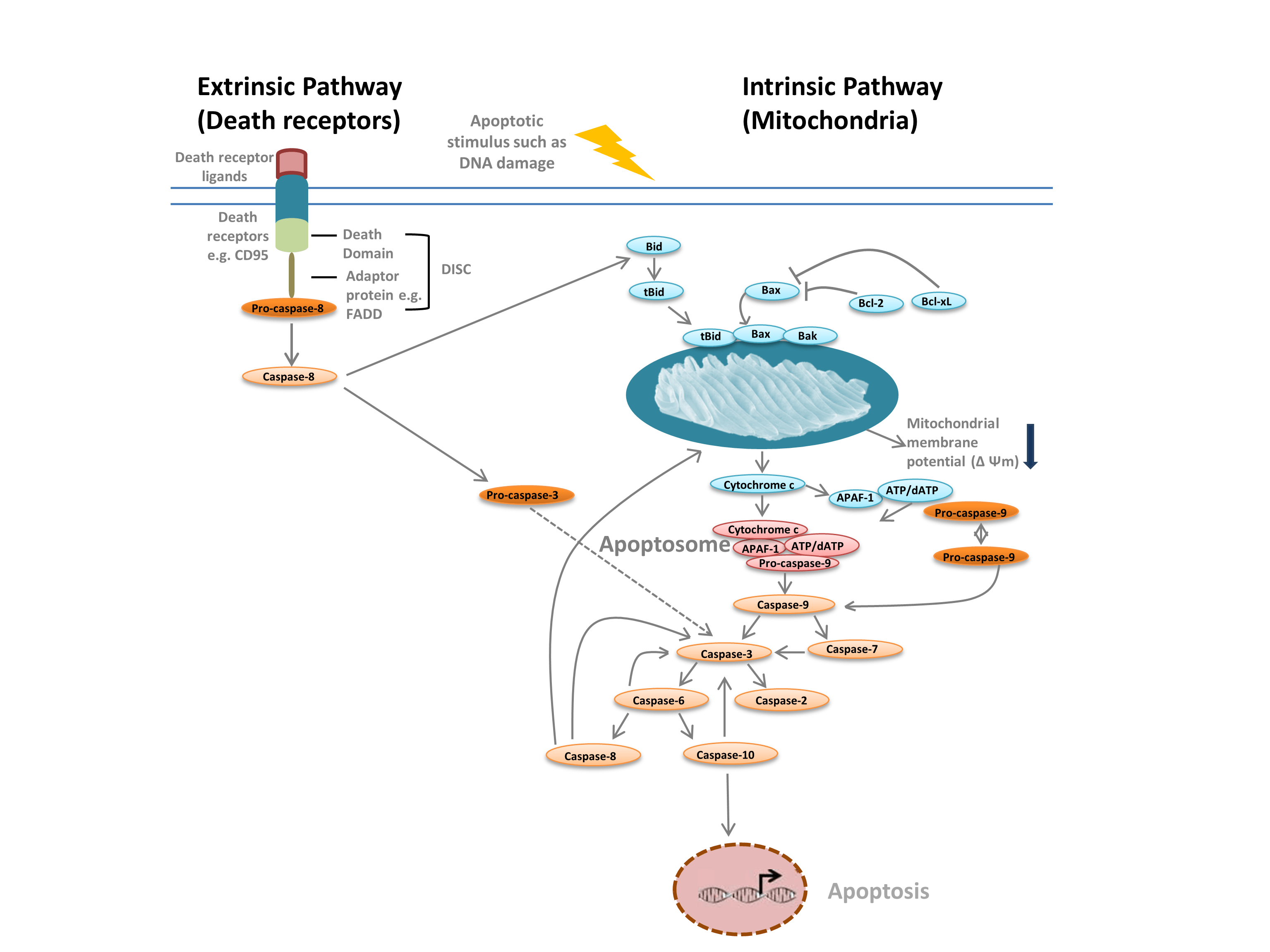
Fig. 1. Apoptosens veje.
Den ekstrinsiske vej udløses af bindingen af ligander til dødsreceptorer. Ved ligandbinding oligomeriseres dødsreceptorer og rekrutterer adaptorproteiner såsom FADD. Dette muliggør rekruttering af pro-caspase-8, den inaktive form af initiatorcaspase-8, og dannelse af det dødsinducerende signaleringskompleks (DISC). Pro-caspase-8 oligomeriseres og spaltes til sin aktive form, caspase-8, som på sin side spalter og aktiverer effektorcaspase-3. Caspase-3 aktiverer på sin side proteolytisk forskellige andre caspaser og fører derved til apoptose. I nogle tilfælde kan aktivering af den extrinisiske vej også føre til aktivering af den intrinsiske vej, formidlet gennem Bid.
Apoptose adskiller sig fra uprogrammeret celledød/nekrose. Nekrose er en ureguleret proces, der initieres af ekstern skade, og adskiller sig fra apoptose på flere vigtige måder (tabel 1). Efterhånden som vi har lært mere om apoptose og nekrose og har identificeret nye celledødsmekanismer som f.eks. nekroptose, er grænserne mellem apoptose og nekrose imidlertid blevet mere udviskede. De kendetegn, der er skitseret i tabel 1, er dog stadig nyttige retningslinjer.
Tabel 1. Kendetegn ved apoptose og nekrose.
| Apoptose | Nekrose |
| Cellerne skrumper | Cellerne svulmer op |
| Fagocytter/makrofager opsluger cellerne | Cellerne debris frigives |
| Processen er ikke-inflammatorisk | Processen er inflammatorisk |
Det er nyttigt at opdele denne proces i faser, når man analyserer apoptose:
- Apoptose indledes, og signalkaskader aktiveres
- Cellerne skrumper og runder sig sammen, medieret af caspaser
- Organeller ændrer form og membraner begynder at bløde
- Kernekondensering begynder
- DNA-fragmentering kan observeres
- Apoptotiske organer dannes
- Apoptotiske organer fagocyttes
Disse apoptotiske stadier, kan sammen med de kendte apoptosemediatorer anvendes som identifikatorer for apoptose. Når du vælger et apoptoseassay, skal du tænke over, hvilket spørgsmål du gerne vil stille – caspaseaktivitetsassays er fremragende indikatorer for apoptoseinitiering, mens DNA-fragmenteringsassays kan bruges til at identificere celler i de sene apoptosefaser, når de er irreversibelt forpligtet til programmeret celledød.
Når man udfører apoptoseassays, er det altid klogt at medtage levedygtighedsfarvestoffer som propidiumjodid (PI) for at skelne apoptotiske celler fra nekrotiske celler og for visuelt at inspicere celler eller væv under mikroskopet for vigtige morfologiske indikatorer for apoptose.
Vurdering af apoptose
1. Morfologiske ændringer
Live cell time lapse imaging kan bruges til at følge apoptose i realtid og er særlig nyttig til at identificere membranblødning. For væv kan transmissionselektronmikroskopi anvendes til at identificere mange af de strukturelle ændringer, der ledsager apoptosefaserne. Vævene kan også farves med hæmatoxylin og eosin for at visualisere makrofager, der har opslugt apoptotiske celler. Acridine orange (AO) er et andet farvestof, der almindeligvis anvendes til at visualisere apoptotiske celler. Dette populære viabilitets- og proliferationsfarvestof kan bruges til at vurdere apoptose, fordi dets emissionsspektrum skifter til orange, når det befinder sig i det sure lysosom-miljø; dette gør farvestoffet nyttigt til at identificere opslugte apoptotiske celler. DNA-bindende farvestoffer som DAPI, Hoechst, propidiumjodid (PI) og 7-AAD kan anvendes til at visualisere nukleær blebbing, mens celleskrumpning kan påvises enten i et flowcytometer som en reduktion i forward scatter (FSC) eller visuelt ved hjælp af lysmikroskopi.
2. Ændringer i mitokondrielt membranpotentiale
Ændringer i membranpotentialet indikerer, at en celle har passeret point of no return og nu er forpligtet til apoptose. Et sammenbrud i mitokondriernes membranpotentiale kan påvises ved flowcytometri eller immunofluorescens ved hjælp af potentiometriske farvestoffer.
Tetramethylrhodamin ethyl ester (TMRE), Tetramethylrhodamin methyl ester (TMRM) og JC-1 er almindeligt anvendte potentiometriske farvestoffer. TMRE og TMRM aggregeres i mitokondrierne i ikke-apoptotiske celler og fluorescerer klart orange eller rødt. I apoptotiske celler med reduceret mitokondriemembranpotentiale findes disse farvestoffer i hele cytoplasmaet i deres monomere form og viser en reduceret rød fluorescens. Farvestofferne kan anvendes i kombination med fluorophore-mærkede inhibitor of caspase assays (FLICA) (se næste afsnit) til at identificere apoptotiske celler på grundlag af to karakteristika: nedbrydning af mitokondriemembranpotentialet og caspaseaktivering (figur 2).
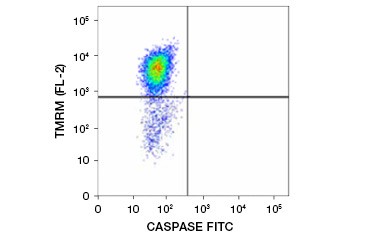
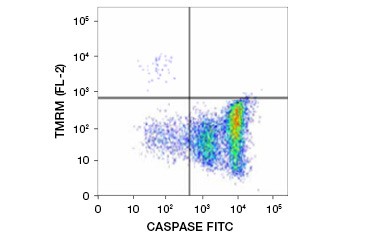
Figur 2. Påvisning af reduktion af mitokondrielt membranpotentiale og caspaseaktivering ved flowcytometri. Samtidig tab af orange fluorescens fra TMRM og stigning i grøn fluorescens, der viser caspaseaktivering som målt med FAM-FLICA Polycaspase Kit, viser apoptotiske celler (nederste højre kvadrant).
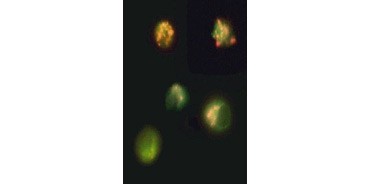
Fig. 3. Nedbrydning af mitokondriernes membranpotentiale visualiseret ved hjælp af JC-1. Jurkat-celler blev farvet med MitoPT JC-1. Ikke-apoptotiske celler (øverst) udviser rødfarvede mitokondrier, mens celler i forskellige stadier af apoptose udviser grøn cytoplasmatisk fluorescens.
JC-1 aggregeres også i mitokondrier i ikke-apoptotiske celler og findes diffust i hele cellen i apoptotiske celler. I modsætning til TMRE og TMRM , som viser reduceret fluorescens, skifter JC-1 farve, fra rød til grøn. Dette gør det let at skelne mellem ikke-apoptotiske rødt fluorescerende celler og apoptotiske grønt fluorescerende celler (figur 3). Disse assays kan aflæses ved hjælp af fluorescensmikroskopi, et flowcytometer eller en passende udstyret mikropladelæser.
3. Caspaseaktivering
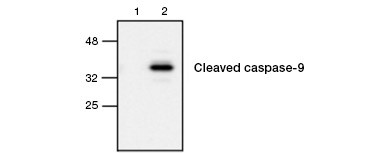
Fig. 4. Aktiv caspase-9 påvises ved western blot. Western blot-analyse af ubehandlede (linie 1) og etoposidbehandlede (linie 2) celler probed med kanin anti-caspase-9 (aktivt) antistof. Aktiv, spaltet caspase-9 påvises kun ved induktion af apoptose med etoposid.
Caspase-aktivering er et definerende træk ved apoptose. Almindeligvis testes de vigtigste apoptotiske caspaser, nemlig initiatorcaspase 3, 6 og 7 og effektorkaspase 2, 8, 9 og 10. Caspaseaktivering kan identificeres enten ved den reducerede størrelse af pro-caspaser, når de spaltes, eller ved at anvende antistoffer, der kun interagerer med den spaltede, aktiverede form (figur 4). Begge fremgangsmåder kan aflæses ved hjælp af western blotting, mens sidstnævnte fremgangsmåde også kan tilpasses til fluorescerende og immunohistokemiske analyser ved at vælge antistoffer, der er konjugeret til fluorophorer eller biotin. Disse assays er kompatible med både fikserede og ufikserede celler.
En ting, som man skal huske på, er, at initiatorcaspaser er langt opstrøms i apoptosesignalvejen, og at deres aktivering ikke altid resulterer i apoptose. Det er derfor klogt at parre assays for initiatorcaspaser med assays for effektorcaspaser eller, endnu bedre, med prober for begivenheder nedstrøms for point of no return, såsom MOMP.
En anden klasse af caspaseaktiveringsassays er fluoroformærkede caspasesubstrater, såsom FLICA-assays. FLICA-assays binder kovalent og irreversibelt til aktiverede caspaser; eventuel ubundet inhibitor diffunderer ud af cellerne og/eller kan fjernes ved vaskning. Disse inhibitorer kan fås med enten røde eller grønne farvestoffer. Fluorescensintensiteten kan anvendes som et kvantitativt mål for caspaseaktivitet – apoptotiske celler med høj caspaseaktivitet vil vise mere fluorescens end celler med lav caspaseaktivitet. FLICA Assays er kompatible med levende celler, vævssnit og tynde frosne snit, men ikke med fikserede celler eller paraffinindlejrede væv, og de kan aflæses ved at kvantificere fluorescensintensiteten ved hjælp af fluorescensmikroskopi, flowcytometri (figur 2) eller en mikropladelæser.
For at drage solide konklusioner fra caspaseaktivitetsassays er det altid klogt at vælge mere end ét mål.
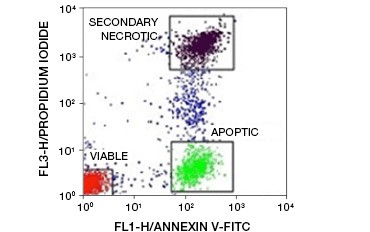
Figur 5. Annexin-V-konjugater kan anvendes til at skelne apoptotiske fra nekrotiske og levedygtige celler. Dot-plot, der viser Ramos-celler farvet med annexin V:FITC versus propidiumjodid. Der kan observeres tre forskellige populationer.
4. Eksternalisering af fosfatidylserin
Et centralt træk ved apoptose, som kan påvises selv i tidlige stadier, er eksternalisering af fosfatidylserin (PS), en fosfolipid, der udelukkende findes i den indre membran i sunde celler. Annexin-V binder phosphatidylserin, og annexin-V-konjugater kan således anvendes til at vurdere apoptose. Disse analyser udføres almindeligvis ved flowcytometri ved hjælp af fluorophore-mærket annexin-V. Ved at kombinere dette farvestof med et hvilket som helst levedygtighedsfarvestof, f.eks. PI, kan apoptotiske celler skelnes fra nekrotiske celler. I disse tofarvede flowcytometriforsøg kan der let skelnes mellem tre populationer: annexin-V/PI dobbeltnegative levedygtige celler, annexin-V positive/PI negative apoptotiske celler og annexin-V/PI dobbeltpositive sekundære nekrotiske celler
(figur 5).
Phosphatidylserin-eksternalisering er en dynamisk, reversibel proces, indtil en celle er forpligtet til apoptose efter MOMP. Ved hjælp af annexin-V-konjugater er det umuligt at skelne tidlige, reversible stadier af apoptose fra de senere stadier af apoptose, når en celle er døden overgivet. Polaritetsfølsomme indikatorer for levedygtighed og apoptose (pSIVA-sonder) er biosensorer, der reversibelt binder PS og således tænder og slukker, når PS skifter fra den ydre membran til den indre membran (figur 6). En anden fordel ved pSIVA-assayet er, at pSIVA-sonderne i modsætning til annexin-V-konjugater kan tilsættes direkte til dine celler uden vasketrin. Dette assay kan aflæses ved hjælp af immunocytokemi og immunofluorescensmikroskopi, herunder billeddannelse af levende celler, hvilket gør det nemt at sammenligne forskelle i apoptoserater som reaktion på forskellige eksperimentelle behandlinger i realtid. Da apoptose overvåges i realtid, er dette assay ikke kompatibelt med fikserede celler.
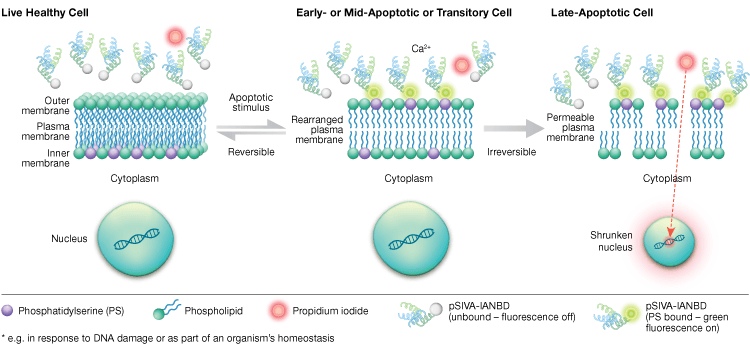
Fig. 6. pSIVA-assayet kan skelne mellem levende, tidligt apoptotiske og sent apoptotiske celler ved at overvåge phosphatidylserin-eksternalisering og -internalisering i realtid.
5. DNA-fragmentering
DNA-fragmentering er et af de senere stadier af apoptose og analyseres almindeligvis ved påvisning af DNA-laddering ved hjælp af agarosebaseret elektroforese eller TUNEL-metoden (terminal deoxynucleotidyl transferase dUTP nick end labeling).
Et definerende kendetegn ved apoptose er fragmentering af DNA i ~180 bp-fragmenter ved hjælp af caspase-aktiverede endonukleaser. Ekstraheret genomisk DNA, der køres på en agarosegel, vil således vise en karakteristisk DNA-stigning, som ikke ses i celler, der dør ved andre mekanismer, f.eks. nekrose.
TUNEL-metoden er en anden måde at påvise oligonukleosomdannelse ved hjælp af caspase-aktiveret endonuklease. DNA-spaltning resulterer i 3′ hydroxylgrupper (3′-OH-grupper). TUNEL-assayet anvender enzymet terminal deoxynucleotidyl transferase (TdT) til at tilføje BrdU til disse 3′-OH-grupper. Indarbejdet BrdU kan derefter påvises ved hjælp af anti-BrdU-antistoffer, der er mærket med biotin eller en fluorofor. Dette assay er kompatibelt med flowcytometri samt immunohistokemi og immunofluorescens og kan konverteres til en radiomærkningsaflæsning ved at anvende -TdR i stedet for BrdU. Cellerne skal fikseres efter BrdU-inkorporering før farvning.
DNA-fragmentering kan også måles ved flowcytometri ved hjælp af sub-G1-assayet. De små DNA-fragmenter på ~180 bp, der dannes under apoptose, lækker ud af cellerne, hvilket mindsker det samlede DNA-indhold i apoptotiske celler. Ved farvning af DNA med PI kan hypodiploide apoptotiske celler tælles i sub-G1-toppen af PI-histogrammet.
6. Multiplex-apoptosemarkørpaneler
Endeligt sælger mange leverandører paneler til multiplex-immunoassay-analyse af cellepopulationer. Disse paneler kan analysere flere apoptosemarkører på én gang.
Uanset hvilken metode der anvendes til påvisning af apoptose, skal der medtages passende kontroller, da forsøgsbetingelser og celletype kan ændre ydeevnen af nogle assays. Der skal altid medtages positive og negative kontroller. Medtag køretøjsbehandlede kontroller for at tage højde for virkningerne af opløsningsmidler, applikationsspecifikke kontroller for at kontrollere faktorer såsom autofluorescens i immunofluorescensforsøg og belastningskontroller til Western Blotting.
Tabel 2. Oversigt over assays til påvisning af kendetegn for apoptose.
| Apoptosestadium | Reagenser til påvisning | Anvendelse | |
| PS-flipping | annexin-V-konjugater, pSIVA-sonder | Flowcytometri, mikroskopi | |
| Signaleringskaskader initieret | FLICA, caspase antistoffer | Flow cytometri, mikroskopi, western blot | |
| MOMP | TMRM, TMRE, JC-1 | Flow cytometri, mikroskopi, mikropladelæser | |
| Celleskrumpning | Flow cytometri, mikroskopi | ||
| Membranblødning | hematoxylin + eosin | Mikroskopi | |
| Kernekondensering | DAPI, Hoechst, PI, 7-AAD | Mikroskopi | |
| DNA-fragmentering | TUNEL, Sub-G1 assay, DNA laddering | Agarosegel, flowcytometri, mikroskopi | |
| Fagocytose af apoptotiske legemer | Acridinorange, hæmatoxylin + eosin | Flowcytometri, lys- og elektronmikroskopi |