John Grizzanti1, Rachel Corrigan1, Spencer Servizi1, Gemma Casadesus1,2*
1School of Biomedical Sciences, Kent State University, Ohio, USA
2Department of Biological Sciences, Kent State University, Ohio, USA
Abstract
Es gibt immer mehr Beweise für die enge Beziehung zwischen Typ-II-Diabetes (T2D) und der Alzheimer-Krankheit (AD). Diese beiden Krankheiten weisen eine Reihe von pathologischen Gemeinsamkeiten auf, darunter Amyloid-Akkumulation, oxidativer Stress, Entzündungen und Zelltod. Bislang gibt es keine medikamentösen Therapien für Alzheimer und T2D, und es besteht ein dringender Bedarf an der Entdeckung und Entwicklung neuer Therapeutika für diese Krankheiten. Eine Reihe von Studien am Menschen und an Nagetieren haben gezeigt, dass die Einnahme von Stoffwechselhormonen sowohl bei T2D als auch bei Alzheimer die kognitiven Funktionen und die allgemeine Stoffwechselgesundheit erheblich verbessern kann. Das Bauchspeicheldrüsenhormon Amylin hat sich als entscheidender Bestandteil der Krankheitsätiologie von T2D und Alzheimer erwiesen, obwohl die genaue Rolle, die Amylin bei diesen Krankheiten spielt, noch nicht gut verstanden ist. Hier überprüfen wir kritisch die aktuelle Literatur, die menschliches Amylin oder sein synthetisches Analogon, Pramlintid, sowie Amylin-Rezeptor-Antagonisten für die Behandlung von Alzheimer verwendet.
Einführung
Alzheimer-Krankheit (AD) ist eine fortschreitende, schwächende neurodegenerative Erkrankung, die durch die Anhäufung von Amyloid-beta (Aβ)-Plaques und neurofibrillären Tangles aus hyperphosphoryliertem tau1 gekennzeichnet ist. Die Anhäufung dieser pathologischen Peptide trägt zu Defiziten bei exekutiven Funktionen wie Lernen und Gedächtnis, Stimmung, Affekt usw. bei und stellt eine erhebliche Belastung für den Patienten und das Pflegepersonal dar. Die Häufigkeit von Alzheimer nimmt in den USA in alarmierendem Maße zu: 2017 lebten schätzungsweise 5,5 Millionen Amerikaner mit Alzheimer, und diese Zahl wird sich bis 2050 voraussichtlich verdreifachen2. Darüber hinaus belaufen sich die Kosten für die Pflege und Behandlung von Alzheimer-Patienten derzeit auf über 200 Milliarden US-Dollar jährlich, und es wird erwartet, dass sie weiter steigen werden3. Obwohl die Alzheimer-Krankheit in den USA und darüber hinaus eindeutig ein großes Problem darstellt, sind die Behandlungsmöglichkeiten nach wie vor sehr begrenzt4. Es wurden zahlreiche Medikamentenversuche mit einer Vielzahl von gezielten Ansätzen durchgeführt, doch gibt es derzeit nur sechs von der FDA für Alzheimer zugelassene Medikamente, die lediglich symptomatische Behandlungen darstellen5, 6. Bislang haben die meisten der entwickelten pharmakologischen Wirkstoffe speziell auf die charakteristische Aβ- oder Tau-Pathologie abgezielt, aber keines davon war erfolgreich bei der Beseitigung oder Verhinderung der Pathologie4. Daher besteht ein grundlegender Bedarf an der Entwicklung praktikabler Therapeutika und präventiver Behandlungen für die Alzheimer-Krankheit.
Die altersbedingte (sporadische) Alzheimer-Krankheit ist eine komplizierte multifaktorielle Erkrankung, die zahlreiche genetische und umweltbedingte Einflüsse aufweist. Umwelt und Lebensstil sind in hohem Maße an der Entwicklung der sporadischen Alzheimer-Krankheit beteiligt; Faktoren wie Ernährung7-9, Fettleibigkeit8-10, metabolisches Syndrom7, Typ-II-Diabetes (T2D)9, 11 und Herz-Kreislauf-Erkrankungen12 wurden alle mit der Verursachung von Alzheimer in Verbindung gebracht. Von entscheidender Bedeutung ist, dass die Raten von Fettleibigkeit und Diabetes parallel zu Alzheimer rasch ansteigen12, 13. Obwohl der Zusammenhang zwischen Fettleibigkeit und Alzheimer nicht ganz klar ist, gibt es Hinweise darauf, dass Fettleibigkeit im mittleren Lebensalter eine Rolle bei der Entwicklung von Alzheimer spielt10. Noch wichtiger ist, dass Adipositas häufig mit einer Reihe anderer Krankheiten einhergeht, darunter Herz-Kreislauf-Erkrankungen, Bluthochdruck, Dyslipidämie, T2D, Schlaganfall usw.14. Die Inzidenz von T2D steigt rapide an, wobei die CDC schätzt, dass etwa 30,3 Millionen Menschen (1 von 10 Erwachsenen) in den USA an Diabetes leiden und erschütternde 84,1 Millionen (1 von 3 Erwachsenen) Prädiabetes haben, von denen die meisten nichts von ihrem Zustand wissen. Darüber hinaus werden die Raten von Fettleibigkeit, T2D, metabolischem Syndrom und kardiovaskulären Erkrankungen aufgrund eines massiven Rückgangs der körperlichen Aktivität, der mit einer gleichzeitigen Zunahme der Nahrungsaufnahme und schlechter Ernährung einhergeht, bis zum Jahr 2035 weltweit auf schätzungsweise 600 Millionen T2D-Fälle ansteigen15.
Es gibt zahlreiche Belege dafür, dass Stoffwechselfunktionen und -krankheiten mit dem Prozess des kognitiven Verfalls und des Alterns zusammenhängen16, 17. So berichten etwa 70 % der Menschen, bei denen T2D diagnostiziert wurde, über kognitive Beeinträchtigungen, und eine beträchtliche Anzahl von T2D-Patienten entwickelt später eine Demenz16, 18-21. Personen, bei denen T2D seit mindestens fünf Jahren diagnostiziert wird, haben ein deutlich erhöhtes Risiko, an Alzheimer zu erkranken, verglichen mit Personen, die seit weniger als fünf Jahren an T2D leiden17. Zusammengenommen deuten diese Daten darauf hin, dass die zunehmende Prävalenz von T2D in der Bevölkerung zu den steigenden Raten der Alzheimer-Krankheit beitragen könnte.
T2D ist zunächst durch hohe Blutzucker- und Insulinwerte gekennzeichnet, was zu einer Hyperinsulinämie führt; wichtig ist, dass Amylin, ein kleines Stoffwechselhormon, das von den β-Inselzellen der Bauchspeicheldrüse produziert wird, zusammen mit Insulin ausgeschüttet wird und somit bei T2D überproduziert wird.22. Wichtig ist, dass es eine Reihe von pathologischen Merkmalen gibt, die sowohl bei T2D als auch bei AD vorhanden sind: 1) verminderter Hirnstoffwechsel und metabolische Hormonresistenz 2) Amyloid-Pathologie 3) oxidativer Stress (OS) und Entzündung. Chronische Hyperinsulinämie und Hyperamylinämie führen zu einer Reihe von physiologischen Problemen: Chronische Hyperinsulinämie führt zu einer systemischen Insulinresistenz22, einem beeinträchtigten Insulintransport durch die Blut-Hirn-Schranke (BHS)23, 24 und somit zu einer verminderten Insulinsignalisierung im Gehirn25. Der Verlust der Insulinsignalübertragung im Gehirn wird mit einer Reihe von mit der Alzheimer-Krankheit zusammenhängenden pathologischen Merkmalen in Verbindung gebracht, darunter eine erhöhte Aβ-Produktion, Tau-Phosphorylierung und Neuroinflammation.
Außerdem weist Amylin in hohen Konzentrationen ähnliche pathologische Merkmale wie Aβ auf26 und könnte ein gemeinsamer Übertragungsweg zwischen den beiden Krankheiten sein. Beispielsweise wurden Amylinfibrillen in der Bauchspeicheldrüse von 95 % der T2D-Patienten gefunden27-29 und verursachen eine Reihe von physiologischen Störungen, einschließlich eines abnormen Ca2+-Einstroms, einer erhöhten Sekretion von pro-inflammatorischen Zytokinen30,31 und letztlich eines β-Inselzellverlusts32. Außerdem überwindet Amylin leicht die BHS und bildet Amylinfibrillen sowie gemischte Plaques mit Aβ im Gehirn und könnte für die AD-ähnliche Pathologie und die Aβ-Aussaat bei T2D verantwortlich sein33-35. Es ist bekannt, dass Amylin die Langzeitpotenzierung (LTP) im Hippocampus beeinflusst und einen angeborenen Einfluss auf die kognitiven Funktionen des Gehirns haben kann36-39. Es bleibt jedoch unklar, ob Amylin bei diesen Krankheiten ein toxischer Insult ist oder ob sein Funktionsverlust durch Aggregation oder den späten Verlust von β-Zellen bei T2D zur Entwicklung einer Alzheimer-Erkrankung beiträgt.
Die Amylin-Signaldichotomie
Es gibt immer noch viele Debatten über die Beteiligung des Amylin-Rezeptors (AMYR) und der Amylin-Signalübertragung am Krankheitsverlauf und der Ätiologie von T2D und Alzheimer. Die Forschungsarbeiten, die darauf abzielen, diesen Zusammenhang zu erkennen, werden immer umfangreicher. Alle einschlägigen Forschungsarbeiten haben durchweg gezeigt, dass die Modulation der Amylin-Signalübertragung die AD-bezogene Pathologie beeinflusst. Die Art dieser Beziehung muss jedoch noch konkret aufgeklärt werden. Mehrere Gruppen haben überzeugende Daten vorgelegt, die darauf hindeuten, dass die Amylin-Signalübertragung sowohl in vivo als auch in vitro zur Vorbeugung von AD-bedingter Pathologie und kognitiven Defiziten beiträgt40-44. Wichtig ist, dass Pramlintid, eine rekombinante, nicht aggregierende Form von Amylin, die in Verbindung mit Insulintherapien zur Behandlung von Diabetes eingesetzt wird und die Blutzuckerkontrolle verbessert, das Körpergewicht reduziert und die Serummarker für OS verringert45-47, ebenfalls vielversprechend als AD-Therapeutikum ist. Bislang gab es jedoch keine klinischen Studien, die darauf abzielten, Amylin oder Pramlintid als therapeutisches Mittel zur Behandlung von Demenz einzusetzen. Eindeutige Beweise aus Studien mit Nagetieren deuten darauf hin, dass eine chronische Behandlung mit humanem Amylin oder Pramlintid einen starken therapeutischen Nutzen bei der Verringerung der mit Alzheimer verbundenen Pathologie hat; eine Amylin/Pramlintid-Supplementierung verringert die löslichen Aβ-Spiegel, die Plaque-Belastung, die Tau-Phosphorylierung, die Neuroinflammation und das OS und verbessert gleichzeitig die Kognition40-42,44. Die oben genannten Daten deuten darauf hin, dass ein Verlust der angeborenen Amylin-Signalgebung im ZNS aufgrund von Aggregation zu einem erhöhten Risiko für die Entwicklung von Alzheimer führt, und werden in Grizzanti et al. 201848 ausführlicher behandelt.
Im Gegensatz dazu zeigen Studien auch, dass menschliches Amylin und Aβ ähnliche toxische Wirkungen haben und dass diese toxischen Wirkungen durch AMYR-Antagonisten gemildert werden können36-39,49. So zeigen die Daten, dass eine In-vivo-Behandlung mit AMYR-Antagonisten einen sehr ähnlichen physiologischen Nutzen hat wie eine Behandlung mit Amylin oder Pramlintid. Die Behandlung von TgCRND8-AD-Mäusen mit AC253, einem AMYR-Antagonisten, oder seinem zyklischen Gegenstück cAC253 verringert die Neuroinflammation, die löslichen Aβ-Spiegel und die Plaque-Belastung und verbessert gleichzeitig die Kognition50. In ähnlicher Weise zeigen In-vitro-/Ex-vivo-Studien, dass niedrige Dosen von menschlichem Amylin oder Aβ zu Störungen der LTP führen und dass diese Defizite durch AC253 oder Pramlintid blockiert werden38,39, und dass höhere Dosen von menschlichem Amylin/Amylin-Oligomeren mit einem unkontrollierten Ca2+-Einstrom verbunden sind, der eng mit dem Zelltod verbunden ist26,32. Zusammengenommen sprechen diese Daten für eine toxische Funktion von Amylin-Oligomeren und damit für einen potenziellen therapeutischen Mechanismus der AMYR-Blockade. Im Gegensatz dazu haben andere Studien gezeigt, dass die positiven Wirkungen von Amylin durch AC25341 blockiert werden können. Somit bleibt das therapeutische Potenzial der Amylin-Behandlung oder -Hemmung unklar und unterstreicht die komplexe und zwiespältige Natur der Amyloide im Gehirn und in der Peripherie.
Piecing Together the Puzzle
Es gibt eine Reihe von Lücken in der aktuellen Literatur, die gefüllt werden müssen, um ein vollständigeres Bild der Amylin-Geschichte zu erhalten: 1) die Natur des angeborenen Amylin-Systems und der Amylin-Signalübertragung im Gehirn 2) die Aβ- und Pramlintid-Signalübertragung durch die drei wichtigsten AMYR- und verwandten Rezeptoren 3) die therapeutischen Mechanismen, durch die Amylin/Pramlintid oder AMYR-Hemmung vermittelt werden. Erstens zeigen interessante neue Daten, dass der AMYR nicht nur an der Signalübertragung, sondern auch am Ligandentransport durch die BHS beteiligt ist. Der AMYR ist ein heterodimerer Rezeptor, der aus einem Calcitonin-Rezeptor und einem die Rezeptoraktivität modifizierenden Protein (1-3)51 besteht. Ein globaler Knockdown des Calcitonin-Rezeptors (einer Schlüsselkomponente des AMYR) um 50 % verringerte die im Gehirn gefundene Menge an AC25350, was darauf hindeutet, dass die in der BHS befindlichen AMYR am Transport dieser Liganden in das Gehirn beteiligt sind und möglicherweise auch Amylin und Pramlintid in das/aus dem Gehirn transportieren. Das Vorhandensein dieser BBB-Transportmechanismen legt nahe, dass Amylin wahrscheinlich eine angeborene physiologische Funktion im Gehirn hat, da sein Transport ins Gehirn streng kontrolliert wird. Wie jedoch die Amylin-Signalisierung oder ihr Fehlen zu den pathologischen Merkmalen der Alzheimer-Krankheit führt und ob die AMYR das Vehikel ist, durch das Aβ seine toxischen Wirkungen vermittelt, ist nach wie vor unklar.
Weiterhin gibt es widersprüchliche Beweise in Bezug auf die Beziehung zwischen Aβ und der AMYR. Obwohl mehrere Studien eindeutig zeigen, dass menschliches Amylin und Aβ ähnliche Auswirkungen auf die LTP im ZNS haben und die Verwendung von AMYR-Inhibitoren diese schädlichen Auswirkungen verbessert36-39, deuten andere Beweise darauf hin, dass Aβ (1-42) nicht in der Lage ist, über den AMYR zu signalisieren, um irgendeine Art von cAMP-Antwort bei einer Vielzahl von Konzentrationen hervorzurufen52. Es ist möglich, dass Aβ durch Interaktion mit dem AMYR verschiedene Signalkaskaden aktiviert oder einfach als inerter kompetitiver Inhibitor wirkt, aber dies muss noch nachgewiesen werden.
Darüber hinaus hat eine separate Studie gezeigt, dass oligomeres Amylin seine toxischen Wirkungen direkt über den AMYR und indirekt über TRPV4, einen nicht-selektiven Kationenkanal, vermittelt26. Niedrige Konzentrationen von humanem Amylin lösen eine Ca2+-Reaktion aus, die über den nativen Rezeptor vermittelt wird. Bei höheren Konzentrationen bildet humanes Amylin jedoch Oligomere und löst eine abweichende Signalübertragung aus, die zur Aktivierung der TRVP4-Kanäle führt und einen unkontrollierten Kationeneinstrom, insbesondere von Ca2+, ermöglicht. Die pharmakologische Blockade von AMYR und TRPV4 zeigt, dass beide Rezeptoren notwendig sind, damit oligomeres humanes Amylin seine toxischen Ca2+-Wirkungen entfalten kann26. Es ist daher wahrscheinlich, dass Aβ seine toxischen Wirkungen auf ähnliche Weise auf den AMYR überträgt, obwohl diese Daten noch nicht vorliegen. Ein unkontrollierter Ca2+-Einstrom wird mit einer Reihe von pathologischen Phänomenen in Verbindung gebracht, darunter unkontrollierte vesikuläre Freisetzung, OS- und mitochondriale Dysfunktion, Apoptose, usw. Daher ist es wahrscheinlich, dass die zelluläre Dysfunktion und die Entwicklung zusätzlicher AD-ähnlicher Pathologien, die durch toxische Amyloid-Signale entstehen, sowohl durch AMYR als auch TRPV4 vermittelt werden. Daher ist es notwendig, die Signalkaskaden zu erkennen, die die Beziehung zwischen AMYR und TRVP4 modulieren. Darüber hinaus sind pharmakologische Experimente erforderlich, bei denen Aβ und Pramlintid in einer Vielzahl von Dosierungen eingesetzt werden, um die Auswirkungen von Aβ und Pramlintid auf Ca2+-Ströme, LTP, cAMP-Produktion und andere Signalkaskaden zu bestimmen. Diese Experimente werden dazu beitragen, einige der Lücken in der aktuellen Literatur in Bezug auf die AMYR und ihre Beteiligung an Krankheitszuständen zu füllen (Abbildung 1).
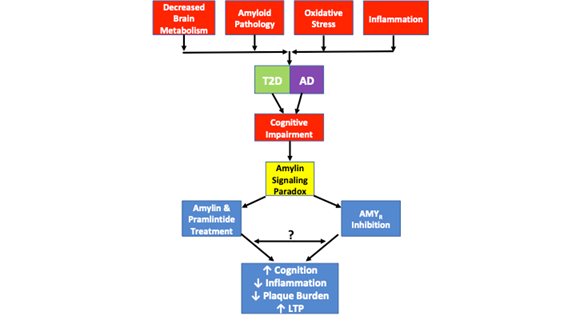
Abbildung 1. zeigt das Amylin-Signalparadoxon und die pathologischen Ähnlichkeiten, die bei T2D und AD beobachtet werden. Ein verminderter Hirnstoffwechsel, Amyloid-Pathologie, oxidativer Stress und Entzündungen sind gemeinsame pathologische Merkmale, die bei beiden Krankheiten beobachtet werden. Auch wenn nicht jeder Fall von T2D oder Alzheimer jedes dieser pathologischen Merkmale aufweist, so zeigt doch jeder Fall eine kognitive Beeinträchtigung. Das Amylin-Signalparadoxon kommt ins Spiel, da Studien gezeigt haben, dass sowohl die AMYR-Hemmung als auch der AMYR-Agonismus durch Amylin- und Pramlintid-Behandlung zu verbesserter Kognition, verringerter Entzündung, geringerer Plaque-Belastung und erhöhter LTP führt. Die Signalmechanismen, die durch AMYR-Agonismus und AMYR-Antagonismus gesteuert werden, müssen noch vollständig aufgeklärt werden. Während die Amylin-Signalgebung traditionell mit der cAMP- und PKA-Signalgebung in Verbindung gebracht wird, ist unklar, ob auch andere Kaskaden durch Amylin/Pramlintid aktiviert werden. Außerdem ist unklar, ob AMYR-Antagonisten, Amylin-Oligomere oder Aβ über die AMYR signalisieren oder ob es Ähnlichkeiten oder Überschneidungen zwischen all diesen AMYR-Liganden gibt. Daher wird eine Reihe von Experimenten, die in dieser Übersichtsarbeit vorgeschlagen werden, dazu beitragen, die wahre Natur der AMYR weiter aufzuklären.
Schlussfolgerungen
Die derzeitige Diskrepanz in Bezug auf die Rolle der Amylin-Signalübertragung im Gehirn zeigt einen wesentlichen Bedarf an weiterer Aufklärung der Beteiligung von Amylin sowohl bei AD als auch bei T2D. Bei T2D ist es wahrscheinlich, dass Amylin in den frühen Stadien der Krankheit das Gehirn überflutet, Oligomere bildet, eine abweichende Signalübertragung durch seinen nativen Rezeptor induziert und TRPV4 rekrutiert, um einen pathologischen Ca2+-Einstrom zu induzieren, der zu einer weit verbreiteten neuronalen Dysfunktion führt, die sich als OS, unkontrollierte vesikuläre Freisetzung und interneuronale Dysfunktion, Entzündung und daraus resultierender Zelltod manifestiert. Dieser Mechanismus könnte für den anfänglichen Übergang vom gesunden Gehirn zur Gehirnalterung bei Stoffwechselkrankheiten verantwortlich sein. Daher könnte eine Hemmung von AMYR oder TRVP4 zu bestimmten Zeitpunkten bei Stoffwechselerkrankungen und in den frühen Stadien von Diabetes gerechtfertigt sein, um die toxischen Auswirkungen von oligomerem Amylin oder Aβ zu blockieren. Es gibt jedoch auch deutliche Hinweise darauf, dass der Ersatz von Amylin durch menschliches Amylin oder Pramlintid die meisten der mit der Alzheimer-Krankheit zusammenhängenden Pathologien reduziert und gleichzeitig die kognitiven Fähigkeiten in Nagetiermodellen für Alzheimer verbessert. Daher könnte ein Ersatz der Amylin-Signalübertragung durch Amylin oder Pramlintid in den mittleren bis späten Stadien des Diabetes, wenn die Amylin-Signalübertragung aufgrund von Aggregation, Oligomerisierung oder β-Zellverlust verloren gegangen ist, gerechtfertigt sein. Zu diesem Zweck müssen auch die zeitliche Abfolge pathologischer Ereignisse bei der metabolisch bedingten Hirnalterung und therapeutische Optionen für frühe, mittlere und späte Krankheitsstadien untersucht werden. Eine kritische Analyse und Prüfung der direkten Natur und der Signalfähigkeiten dieser Amyloide sowie der therapeutischen Natur spezifischer zeitlicher Behandlungen kann dazu beitragen, die Lücke zwischen AMYR-Hemmtherapien und Amylin-Ersatztherapien zu schließen.
Finanzierung
Die Finanzierung dieses Artikels wurde von den National Institutes of Aging Grant 1R15AG050292-01A1 zur Verfügung gestellt.
- LaFerla FM, Oddo S. Alzheimer’s disease: Aβ, Tau und synaptische Dysfunktion. Trends Mol Med. 2005; 11: 170-176.
- Hebert LE, Weuve J, Scherr PA, et al. Alzheimer disease in the United States (2010-2050) estimated using the 2010 census. Neurology. 2013; 80: 1778-1783.
- Association As. 2016 Alzheimer’s disease facts and figures. Alzheimer’s & Dementia. 2016; 12: 459-509.
- Cummings JL, Morstorf T, Zhong K. Alzheimer’s disease drug-development pipeline: few candidates, frequent failures. Alzheimers Res Ther. 2014; 6: 37.
- Hyde C, Peters J, Bond M, et al. Evolution of the evidence on the effectiveness and cost-effectiveness of acetylcholinesterase inhibitors and memantine for Alzheimer’s disease: systematic review and economic model. Age Ageing. 2012; 42: 14-20.
- Howard R, McShane R, Lindesay J, et al. Donepezil and memantine for moderate-to-severe Alzheimer’s disease. N Engl J Med. 2012; 366: 893-903.
- Crane PK, Walker R, Hubbard RA, et al. Glucose levels and risk of dementia. N Engl J Med. 2013; 369: 540-548.
- Loef M, Walach H. Midlife obesity and dementia: meta?analysis and adjusted forecast of dementia prevalence in the United States and China. Obesity. 2013; 21.
- Gudala K, Bansal D, Schifano F, et al. Diabetes mellitus and risk of dementia: a meta?analysis of prospective observational studies. Journal of diabetes investigation. 2013; 4: 640-650.
- Whitmer RA, Gunderson EP, Barrett-Connor E, et al. Obesity in middle age and future risk of dementia: a 27 year longitudinal population based study. BMJ. 2005; 330: 1360.
- Vagelatos NT, Eslick GD. Typ-2-Diabetes als Risikofaktor für die Alzheimer-Krankheit: Confounder, Interaktionen und Neuropathologie im Zusammenhang mit dieser Beziehung. Epidemiol Rev. 2013; 35: 152-160.
- Debette S, Seshadri S, Beiser A, et al. Midlife vascular risk factor exposure accelerates structural brain aging and cognitive decline. Neurology. 2011; 77: 461-468.
- Ginter E, Simko V. Global prevalence and future of diabetes mellitus In Diabetes Springer. 2013; 35-41.
- Khaodhiar L, McCowen KC, Blackburn GL. Adipositas und ihre Komorbiditäten. Clin Cornerstone. 1999; 2: 17-31.
- Federation ID. IDF diabetes atlas. Brüssel: International Diabetes Federation. 2013.
- K Dash S. Cognitive impairment and diabetes. Recent Pat Endocr Metab Immune Drug Discov. 2013; 7: 155-165.
- Leibson CL, Rocca WA, Hanson V, et al. Risk of dementia among persons with diabetes mellitus: a population-based cohort study. Am J Epidemiol. 1997; 145: 301-308.
- Biessels GJ, Strachan MW, Visseren FL, et al. Dementia and cognitive decline in type 2 diabetes and prediabetic stages: towards targeted interventions. The Lancet Diabetes & Endocrinology. 2014; 2: 246-255.
- Akter K, Lanza EA, Martin SA, et al. Diabetes mellitus and Alzheimer’s disease: shared pathology and treatment. Br J Clin Pharmacol. 2011; 71: 365-376.
- Akter S, Rahman MM, Abe SK, et al. Prevalence of diabetes and prediabetes and their risk factors among Bangladeshi adults: a nationwide survey. Bull World Health Organ. 2014; 92: 204-213A.
- Ott A, Stolk R, Van Harskamp F, et al. Diabetes mellitus and the risk of dementia The Rotterdam Study. Neurology. 1999; 53: 1937-1937.
- Farris W, Mansourian S, Chang Y, et al. Insulin-abbauendes Enzym reguliert die Spiegel von Insulin, Amyloid-β-Protein und der intrazellulären Domäne des β-Amyloid-Vorläuferproteins in vivo. Proceedings of the National Academy of Sciences. 2003; 100: 4162-4167.
- Schwartz MW, Figlewicz DF, Kahn SE, et al. Insulin binding to brain capillaries is reduced in genetically obese, hyperinsulinemic Zucker rats. Peptides. 1990; 11: 467-472.
- Wallum B, Taborsky Jr G, Porte Jr D, et al. Cerebrospinal Fluid Insulin Levels Increase During Intravenous Insulin Infusions in Man*. The Journal of Clinical Endocrinology & Metabolism. 1987; 64: 190-194.
- Gil-Bea FJ, Solas M, Solomon A, et al. Insulin levels are decreased in the cerebrospinal fluid of women with prodomal Alzheimer’s disease. J Alzheimers Dis. 2010; 22: 405-413.
- Zhang N, Yang S, Wang C, et al. Multiple target of hAmylin on rat primary hippocampal neurons. Neuropharmacology. 2017; 113: 241-251.
- Kahn SE, Hull RL, Utzschneider KM. Mechanismen, die Fettleibigkeit mit Insulinresistenz und Typ-2-Diabetes verbinden. Nature. 2006; 444: 840-846.
- Johnson K, O’Brien T, Jordan K, et al. Impaired glucose tolerance is associated with increased islet amyloid polypeptide (IAPP) immunoreactivity in pancreatic beta cells. The American Journal of Pathology. 1989; 135: 245.
- Johnson KH, O’Brien TD, Betsholtz C, et al. Islet amyloid, islet-amyloid polypeptide, and diabetes mellitus. N Engl J Med. 1989; 321: 513-518.
- Masters SL, Dunne A, Subramanian SL, et al. Activation of the NLRP3 inflammasome by islet amyloid polypeptide provides a mechanism for enhanced IL-1β in type 2 diabetes. Nat Immunol. 2010; 11: 897.
- Wang X, Bao W, Liu J, et al. Inflammatory markers and risk of type 2 diabetes: a systematic review and meta-analysis. Diabetes Care2013; 36: 166-175.
- Kawahara M, Kuroda Y, Arispe N, et al. Alzheimer’s β-Amyloid, humanes Insel-Amylin und Prion-Protein-Fragment evozieren intrazelluläre freie Kalziumerhöhungen durch einen gemeinsamen Mechanismus in einer hypothalamischen GnRH-Neuronalzelllinie. J Biol Chem. 2000; 275: 14077-14083.
- Verma N, Ly H, Liu M, et al. Intraneuronal Amylin Deposition, Peroxidative Membrane Injury and Increased IL-1β Synthesis in Brains of Alzheimer’s Disease Patients with Type-2 Diabetes and in Diabetic HIP Rats. J Alzheimers Dis. 2016; 53: 259-272.
- Jackson K, Barisone GA, Diaz E, et al. Amylin deposition in the brain: a second amyloid in Alzheimer disease. Ann Neurol. 2013; 74: 517-526.
- Oskarsson ME, Paulsson JF, Schultz SW, et al. In vivo seeding and cross-seeding of localized amyloidosis: a molecular link between type 2 diabetes and Alzheimer disease. The American Journal of Pathology. 2015; 185: 834-846.
- Fu W, Patel A, Jhamandas JH. Amylin-Rezeptor: ein gemeinsames pathophysiologisches Ziel bei Alzheimer-Krankheit und Diabetes mellitus. Front Aging Neurosci. 2013; 5.
- Fu W, Ruangkittisakul A, MacTavish D, et al. Amyloid β (Aβ) peptide direct activates amylin-3 receptor subtype by triggering multiple intracellular signaling pathways. J Biol Chem. 2012; 287: 18820-18830.
- Kimura R, MacTavish D, Yang J, et al. Pramlintide Antagonizes Beta Amyloid (Aβ)-and Human Amylin-Induced Depression of Hippocampal Long-Term Potentiation. Mol Neurobiol. 2017; 54: 748-754.
- Kimura R, MacTavish D, Yang J, et al. Beta Amyloid-induced depression of hippocampal long-term potentiation is mediated through the amylin receptor. J Neurosci. 2012; 32: 17401-17406.
- Zhu H, Wang X, Wallack M, et al. Intraperitoneal injection of the pancreatic peptide amylin potently reduces behavioral impairment and brain amyloid pathology in murine models of Alzheimer’s disease. Mol Psychiatry. 2015; 20: 252.
- Zhu H, Xue X, Wang E, et al. Amylin-Rezeptor-Liganden reduzieren die pathologische Kaskade der Alzheimer-Krankheit. Neuropharmacology. 2017; 119: 170-181.
- Adler BL, Yarchoan M, Hwang HM, et al. Neuroprotective effects of the amylin analog pramlintide on Alzheimer’s disease pathogenesis and cognition. Neurobiol Aging. 2014; 35: 793-801.
- Zhang Z, Hartmann H, Do VM, et al. Destabilization of β-catenin by mutations in presenilin-1 potentiates neuronal apoptosis. Nature. 1998; 395: 698-702.
- Wang E, Zhu H, Wang X, et al. Amylin Treatment Reduces Neuroinflammation and Ameliorates Abnormal Patterns of Gene Expression in the Cerebral Cortex of an Alzheimer’s Disease Mouse Model. J Alzheimers Dis. 2017; 56: 47-61.
- Singh-Franco D, Robles G, Gazze D. Pramlintide acetate injection for the treatment of type 1 and type 2 diabetes mellitus. Clin Ther. 2007; 29: 535-562.
- Singh-Franco D, Perez A, Harrington C. The effect of pramlintide acetate on glycemic control and weight in patients with type 2 diabetes mellitus and in obese patients without diabetes: a systematic review and meta?analysis. Diabetes, Adipositas und Metabolismus. 2011; 13: 169-180.
- Hollander PA, Levy P, Fineman MS, et al. Pramlintide as an adjunct to insulin therapy improves long-term glycemic and weight control in patients with type 2 diabetes. Diabetes Care. 2003; 26: 784-790.
- Grizzanti J, Corrigan R, Casadesus G. Neuroprotective Effects of Amylin Analogues on Alzheimer’s Disease Pathogenesis and Cognition. J Alzheimers Dis. 2018; 1-13.
- Jhamandas JH, Li Z, Westaway D, et al. Actions of β-amyloid protein on human neurons are expressed through the amylin receptor. The American Journal of Pathology. 2011; 178: 140-149.
- Soudy R, Patel A, Fu W, et al. Cyclic AC253, a novel amylin receptor antagonist, improves cognitive deficits in a mouse model of Alzheimer’s disease. Alzheimer’s & Dementia: Translational Research & Clinical Interventions. 2017; 3: 44-56.
- Gebre-Medhin S, Mulder H, Zhang Y, et al. Reduced nociceptive behavior in islet amyloid polypeptide (amylin) knockout mice. Mol Brain Res. 1998; 63: 180-183.
- Gingell JJ, Burns ER, Hay DL. Aktivität von Pramlintid, Ratten- und menschlichem Amylin, aber nicht von Aβ1-42 an menschlichen Amylinrezeptoren. Endocrinology. 2014; 155: 21-26.