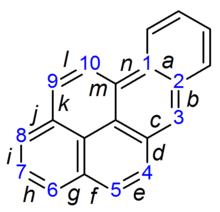
NervensystemEdit
Prenatale Exposition von BaP bei Ratten beeinträchtigt bekanntermaßen das Lernen und Gedächtnis in Nagetiermodellen. Bei trächtigen Ratten, die BaP zu sich nahmen, wurden negative Auswirkungen auf die Gehirnfunktion im späteren Leben ihrer Nachkommen festgestellt. Zu einem Zeitpunkt, an dem Synapsen zum ersten Mal gebildet und in ihrer Stärke durch Aktivität angepasst werden, verringerte BaP die NMDA-Rezeptor-abhängige Nervenzellaktivität, gemessen als mRNA-Expression der NMDA NR2B-Rezeptor-Untereinheit.
ImmunsystemEdit
BaP wirkt sich auf die Anzahl der weißen Blutkörperchen aus, indem es einige von ihnen daran hindert, sich in Makrophagen zu differenzieren, die erste Verteidigungslinie des Körpers zur Bekämpfung von Infektionen. Im Jahr 2016 wurde der molekulare Mechanismus als Schädigung der Integrität des Lipid Rafts der Makrophagenmembran durch einen Rückgang des Membrancholesterins um 25 % aufgedeckt. Dies bedeutet, dass weniger Immunrezeptoren CD32 (ein Mitglied der Fc-Familie von Immunrezeptoren) an IgG binden und das weiße Blutkörperchen in einen Makrophagen verwandeln können. Daher werden die Makrophagenmembranen anfällig für bakterielle Infektionen.
ReproduktionssystemEdit
In Experimenten mit männlichen Ratten hat sich gezeigt, dass eine subchronische Exposition gegenüber inhaliertem BaP die Funktion von Hoden und Nebenhoden allgemein verringert, was zu einer geringeren Produktion von Sexualsteroiden/Testosteron und Spermien führt.
KarzinogenitätEdit
Die Metaboliten von BaP sind mutagen und hochgradig karzinogen, und es wird von der IARC als Karzinogen der Gruppe 1 aufgeführt. Chemical agents and related occupations, Volume 10, A review of Human Carcinogens, IARC Monographs, Lyon France 2009
Im Juni 2016 wurde BaP als Benzochrysen in die REACH-Kandidatenliste der besonders besorgniserregenden Stoffe für die Zulassung aufgenommen.
Zahlreiche Studien seit den 1970er Jahren haben Verbindungen zwischen BaP und Krebserkrankungen dokumentiert. Es war schwieriger, Krebserkrankungen mit bestimmten BaP-Quellen in Verbindung zu bringen, insbesondere beim Menschen, und es war schwierig, die Risiken zu quantifizieren, die von verschiedenen Expositionsmethoden (Einatmen oder Verschlucken) ausgehen. Im Jahr 2005 wurde ein Zusammenhang zwischen Vitamin-A-Mangel und Emphysem bei Rauchern beschrieben, der auf BaP zurückzuführen ist, das bei Ratten einen Vitamin-A-Mangel hervorruft.
Eine Studie aus dem Jahr 1996 lieferte molekulare Beweise für einen Zusammenhang zwischen Bestandteilen des Tabakrauchs und Lungenkrebs. Es wurde gezeigt, dass BaP in Lungenzellen genetische Schäden verursacht, die mit den Schäden identisch sind, die in der DNA der meisten bösartigen Lungentumore beobachtet werden.
Der regelmäßige Verzehr von gekochtem Fleisch wurde epidemiologisch mit einem erhöhten Auftreten von Dickdarmkrebs in Verbindung gebracht (obwohl dies an sich kein Beweis für Karzinogenität ist).Eine NCI-Studie aus dem Jahr 2005 ergab, dass ein erhöhtes Risiko für kolorektale Adenome mit der BaP-Aufnahme und noch stärker mit der BaP-Aufnahme aus allen Lebensmitteln verbunden war. Die Lebensmittel selbst sind jedoch nicht unbedingt krebserregend, selbst wenn sie Spuren von Karzinogenen enthalten, da der Magen-Darm-Trakt sich selbst vor Karzinomen schützt, indem er seine äußere Schicht ständig abstreift. Außerdem haben Entgiftungsenzyme wie die Cytochrome P450 im Darm eine erhöhte Aktivität zum Schutz vor Toxinen aus der Nahrung. Daher werden in den meisten Fällen kleine Mengen BaP verstoffwechselt, bevor sie ins Blut gelangen. Die Lunge ist auf keine der beiden Weisen geschützt.
Die Entgiftungsenzyme Cytochrom P450 1A1 (CYP1A1) und Cytochrom P450 1B1 (CYP1B1) sind sowohl schützend als auch notwendig für die Benzopyren-Toxizität. Experimente mit Mäusestämmen, bei denen CYP1A1 und CYP1B1 ausgeschaltet wurden (Knockout), zeigen, dass CYP1A1 in erster Linie Säugetiere vor niedrigen BaP-Dosen schützt, und dass durch die Ausschaltung dieses Schutzes hohe BaP-Konzentrationen akkumuliert werden. Wenn nicht auch CYP1B1 ausgeschaltet wird, resultiert die Toxizität aus der Bioaktivierung von BaP zu Benzopyren-7,8-dihydrodiol-9,10-epoxid, der ultimativen toxischen Verbindung.
Interaktion mit DNAEdit

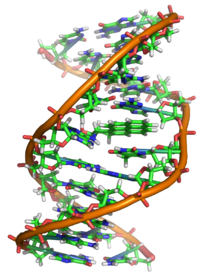
Genau genommen ist BaP ein Prokarzinogen, was bedeutet, dass sein Mechanismus der Karzinogenese von seiner enzymatischen Metabolisierung zu BaP-Diol-Epoxid abhängt. Es lagert sich in die DNA ein, und das elektrophile Epoxid wird von nukleophilen Guaninbasen angegriffen, wobei ein sperriges Guanin-Addukt gebildet wird.

Röntgenkristallographische und kernmagnetische Resonanz-Strukturstudien haben gezeigt, wie diese Bindung die DNA durch Verwirrung der doppelhelikalen DNA-Struktur verzerrt. Dadurch wird der normale Prozess der DNA-Kopie gestört und Mutationen verursacht, was das Auftreten von Krebs nach der Exposition erklärt. Dieser Wirkmechanismus ähnelt dem von Aflatoxin, das sich an die N7-Position von Guanin bindet.
Es gibt Hinweise darauf, dass Benzopyren-Diol-Epoxid spezifisch auf das schützende p53-Gen abzielt. Dieses Gen ist ein Transkriptionsfaktor, der den Zellzyklus reguliert und somit als Tumorsuppressor fungiert. Durch die Induktion von G (Guanin) zu T (Thymidin)-Transversionen in Transversions-Hotspots innerhalb von p53 besteht die Wahrscheinlichkeit, dass Benzopyren-Diol-Epoxid die Fähigkeit zur Tumorsuppression in bestimmten Zellen inaktiviert und so zu Krebs führt.
Benzopyren-7,8-dihydrodiol-9,10-epoxid ist das krebserregende Produkt dreier enzymatischer Reaktionen:
- Benzopyren wird zunächst durch Cytochrom P450 1A1 oxidiert, um eine Reihe von Produkten zu bilden, darunter (+)Benzopyren-7,8-epoxid.
- Dieses Produkt wird durch Epoxidhydrolase metabolisiert, wobei der Epoxidring geöffnet wird und (-)Benzopyren-7,8-Dihydrodiol entsteht.
- Das endgültige Karzinogen wird nach einer weiteren Reaktion mit Cytochrom P450 1A1 gebildet, wobei das (+)Benzopyren-7,8-Dihydrodiol-9,10-Epoxid entsteht. Dieses Diol-Epoxid bindet kovalent an die DNA.
BaP induziert Cytochrom P4501A1 (CYP1A1) durch Bindung an den AHR (Aryl-Kohlenwasserstoff-Rezeptor) im Cytosol. Nach der Bindung transloziert der transformierte Rezeptor in den Zellkern, wo er mit ARNT (aryl hydrocarbon receptor nuclear translocator) dimerisiert und dann Xenobiotic response elements (XREs) in der DNA bindet, die stromaufwärts von bestimmten Genen liegen. Dieser Prozess erhöht die Transkription bestimmter Gene, insbesondere von CYP1A1, gefolgt von einer erhöhten CYP1A1-Proteinproduktion. Dieser Prozess ähnelt der Induktion von CYP1A1 durch bestimmte polychlorierte Biphenyle und Dioxine. Offenbar verhindert die CYP1A1-Aktivität in der Darmschleimhaut, dass größere Mengen von aufgenommenem Benzopyren in das Pfortaderblut und den systemischen Kreislauf gelangen. Die intestinale, nicht aber die hepatische Expression von CYP1A1 hängt vom TOLL-ähnlichen Rezeptor 2 (TLR2) ab, der ein eukaryotischer Rezeptor für bakterielle Oberflächenstrukturen wie Lipoteichonsäure ist.
Außerdem wurde festgestellt, dass BaP beim Menschen ein Transposon, LINE1, aktiviert.