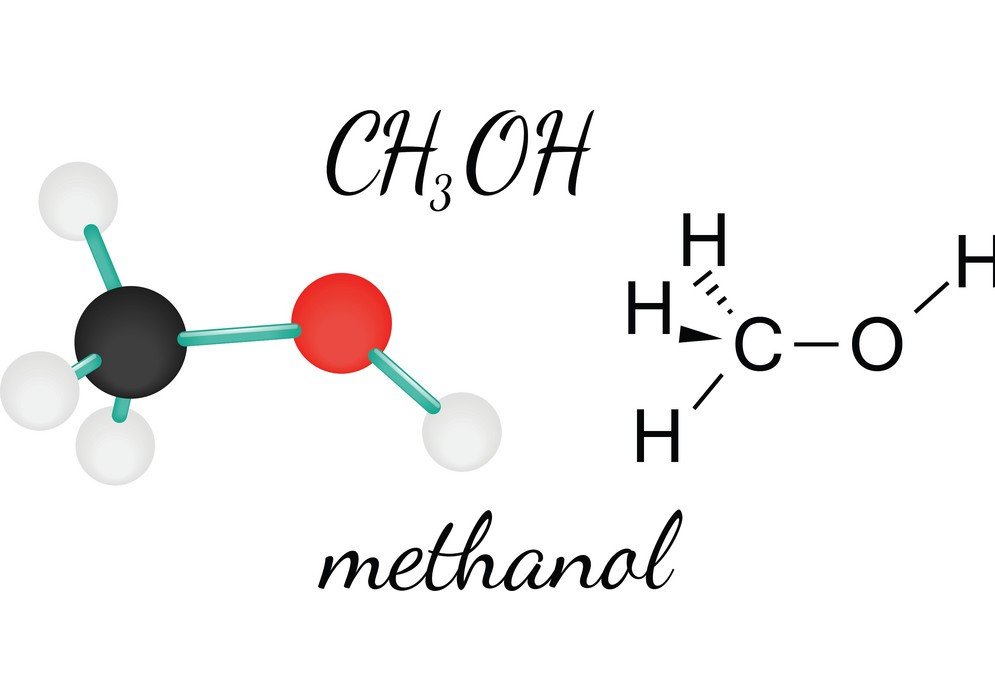
CH3OH oder Methanol ist eine brennbare, farblose und flüchtige Flüssigkeit, die einen ausgeprägten alkoholischen Geruch hat. Durch die Untersuchung des Methanols kann man die Molekülform, den Bindungswinkel und die Polarität des Moleküls kennen lernen. Die Polarität von CH3OH ist eines der wichtigsten Merkmale, da sie dazu beiträgt, die anderen Eigenschaften der Verbindung, wie ihre Löslichkeit, elektrische Ladungen und vieles mehr, zu bestimmen. Um die Polarität von Methanol zu verstehen, betrachten wir zunächst die Bindungswinkel und die Anordnung der Atome im CH3OH-Molekül.

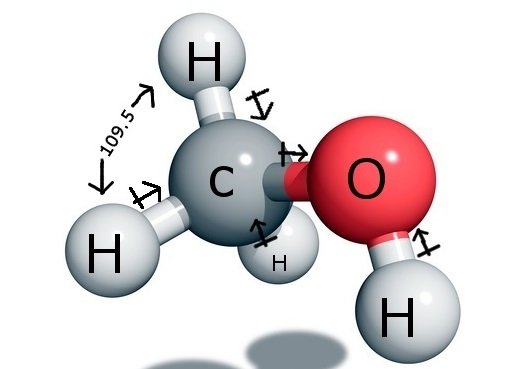
CH3OH Bindungswinkel
Das zentrale Kohlenstoffatom bildet vier Bindungen in der Verbindung, drei mit dem Wasserstoffatom und eine mit der Hydroxylgruppe (OH). Da dieses Kohlenstoffatom eine sp3-Hybridisierung aufweist und eine Tetraederform bildet, beträgt der Bindungswinkel mit seinen Bindungsatomen 109,5 Grad.
Im Gegensatz dazu bildet der Sauerstoff eine Sigma-Bindung, hat aber zwei Einzelpaare, so dass sein Bindungswinkel aufgrund der Abstoßungskräfte zwischen den Bindungspaaren gebogen ist. Dadurch verringert sich der Bindungswinkel auf 104,5 Grad.
Der Kohlenstoff hat also einen Bindungswinkel von 109,5 Grad mit allen drei Wasserstoffatomen und einen Bindungswinkel von 104,5 Grad mit der Hydroxylgruppe.
Ist CH3OH polar?
Die Polarität einer bestimmten Verbindung hängt vom Nettodipolmoment der Verbindung ab. Dieses Nettodipolmoment lässt sich aus den elektrischen Ladungen der Atome im Molekül ablesen. Hier sind sowohl die Kohlenstoff- als auch die Sauerstoffatome (die als geometrische Zentren für diese Verbindung betrachtet werden) in Methanol elektronegative Atome. Aber Sauerstoff ist elektronegativer als Kohlenstoff oder Wasserstoff in der Verbindung.
CH3OH kann nicht unpolar sein, weil es einen Unterschied in den elektrischen Ladungen zwischen den Atomen im Methanolmolekül gibt. Sauerstoff hat aufgrund seiner zwei einsamen Elektronenpaare eine höhere Elektronendichte. Dadurch entsteht ein Nettodipol, der auf das Sauerstoffatom gerichtet ist und CH3OH polar macht.
Abgesehen von den elektrischen Ladungen ist das CH3OH-Molekül asymmetrisch, was die Möglichkeit der Unpolarität ausschließt. Ein unpolares Molekül hat eine symmetrische Struktur, da sich das Dipol-Dipol-Moment aufhebt. Da die Form des Methanols jedoch gekrümmt ist, bildet sich eine asymmetrische Struktur, die dazu führt, dass das elektrische Nettodipolmoment zum Sauerstoffatom hin negativ ist. Somit ist CH3OH ein polares Molekül.
Nachdem wir nun die Polarität des CH3OH-Moleküls kennen, gehen wir einige seiner physikalischen Eigenschaften durch:
- Der Siedepunkt von Methanol ( CH3OH) liegt bei 64,7 °C.
- Der Schmelzpunkt von Methanol liegt bei -97,6 °C.
- Das Molekulargewicht von Methanol beträgt 32,04 g/mol.
- Es ist ein polares Lösungsmittel und wird auch als Holzalkohol bezeichnet, weil es früher durch die Destillation von Holz hergestellt wurde.
- Der Geruch dieser Verbindung ist im Vergleich zu Ethanol eher süßlich.
Verwendungen von CH3OH
- Methanol wird auch für die Herstellung von Kohlenwasserstoffen und für die Synthese anderer Chemikalien wie Formaldehyd verwendet.
- Es wird als Frostschutzmittel in Rohren verwendet.
- CH3OH wird aufgrund seines niedrigen Schmelzpunkts in mehreren Ländern auch als Benzinzusatz verwendet.
- Die Verbindung wird auch als Kraftstoff in Verbrennungsmotoren verwendet.
- Viele pharmazeutische Unternehmen verwenden reines Methanol für die Synthese anderer Verbindungen.
Ich hoffe, dieser Artikel hilft dir, die Polarität des Moleküls und seine physikalischen Eigenschaften und Verwendungen zu verstehen. CH3OH ist ein polares Molekül, da sich das Dipol-Dipol-Moment aufgrund seiner asymmetrischen Form nicht aufhebt.