Die valvuläre Aortenstenose (AS) ist die häufigste Klappenerkrankung in den entwickelten Ländern. Die Diagnose der AS wird klassischerweise durch die Echokardiographie bestätigt, dem Standardinstrument zur Erkennung und Beurteilung des Schweregrads der Erkrankung (1). Dennoch ist die Beurteilung des Schweregrads der AS nach wie vor eine Herausforderung. Schwere AS wird in der Regel definiert als mittlerer Gradient >40 mmHg, Aortenklappenfläche (AVA) <1 cm2 und Spitzengeschwindigkeit des Aortenstrahls >4,0 m/s (2). Es werden jedoch häufig Diskrepanzen zwischen dem mittleren Gradienten und der Klappenfläche bei einem einzelnen Patienten beobachtet (3). Diese Diskrepanzen sind bei Patienten mit niedrigem Herzzeitvolumen aufgrund einer reduzierten LV-Ejektionsfraktion leicht zu verstehen, können aber auch bei Patienten mit scheinbar erhaltener LV-Funktion auftreten (4). In der täglichen Praxis können sie zu einer Unterschätzung der Stenose und des Schweregrads der Symptome und damit zu einer unangemessenen Verzögerung des Aortenklappenersatzes (AVR) führen, was sich wiederum negativ auf das Patientenergebnis auswirken kann (5-7). In dieser Ausgabe von Cardiovascular Diagnosis and Therapy hat OZKAN auf elegante Weise das Konzept der AS mit niedrigem Gradienten bei Patienten mit erhaltener LV-Funktion untersucht (8).
New aortic stenosis grading classification
In jüngster Zeit haben mehrere Autoren berichtet, dass unter der gleichen Bezeichnung der schweren AS (AVA <1 cm2) mehrere Entitäten identifiziert werden können, die sich hinsichtlich der transvalvulären Flussraten und der Druckgradientenentwicklung unterscheiden (9-11). Die Gruppe von Pibarot et al. (5) unterstrich als erste die Bedeutung der Integration der Ventil-Gradienten-Beziehung in das Flussmuster, während Miners et al. (3) als erste die Unstimmigkeiten bei der Einstufung des Schweregrads der AS deutlich aufzeigten und mit Dumesnil et al. (6) die neue Klassifizierung der AS vorschlugen. Bei Patienten mit einer AVA <1 cm2 lassen sich vier Flussgradienten-AS-Kategorien unterscheiden: normaler Fluss/niedriger Gradient (NF/LG), normaler Fluss/hoher Gradient (NF/HG), niedriger Fluss/hoher Gradient (LF/HG) und niedriger Fluss/niedriger Gradient (LF/LG). LF ist definiert als ein indiziertes LV-Hubvolumen <35 mL/m2 und LG als ein mittlerer trans-aortaler Druckgradient <40 mmHg (12).
Normaler Fluss/niedriger Gradient
Dieses Muster wird bei 31-38 % der Patienten beobachtet und scheint eine Gruppe von Patienten zu identifizieren, die einen weniger schweren Grad der AS aufweisen – was in den Leitlinien nicht eindeutig geregelt ist – oder die der Krankheit über einen kürzeren Zeitraum ausgesetzt waren. Diese Gruppe zeichnet sich durch eine erhaltene longitudinale Herzmuskelfunktion aus, was zu einem niedrigeren BNP-Spiegel und Monin-Risikoscore führt (12,13). Die Prognose dieser Patienten scheint im Vergleich zu den anderen Kategorien relativ gut zu sein.
Normaler Fluss-hoher Gradient
Dieses Muster stellt die häufigste Entität dar (39-72 %) und entspricht vollständig den in den Leitlinien vorgeschlagenen Kriterien (4,5,12). Im Vergleich zur NF/LG-Gruppe ist die LV-Längsfunktion zwar erhalten, aber der BNP-Wert ist höher und die kardiale ereignisfreie Überlebensrate von NF/HG ist geringer. Darüber hinaus scheinen Patienten mit NF/HG eine schwerere AS zu haben, was auf eine längere Exposition gegenüber dieser fortschreitenden Erkrankung hindeutet. Wenn sie symptomatisch sind, werden diese Patienten klassischerweise zur AVR überwiesen, während bei asymptomatischen Patienten das Management dieser Patienten die Notwendigkeit einer optimierten Risikostratifizierung unterstreicht.
Low flow-high gradient
Dieses Muster macht 8 % der Patienten mit schwerer AS aus (4,12). Es ist gekennzeichnet durch ein indiziertes LV-Hubvolumen <35 mL/m2 trotz erhaltener LV-Auswurfsfraktion, einen hohen BNP-Spiegel und Monin-Risikoscore sowie eine signifikante Verringerung der LV-Längsfunktion (14). Die LV-Ejektionsfraktion ist eine grobe Schätzung der systolischen LV-Funktion. Die LV-Ejektionsfraktion wird sowohl von der intrinsischen Myokardfunktion als auch von der LV-Hohlraumgeometrie beeinflusst. Bei einem ähnlichen Ausmaß an intrinsischer Myokardverkürzung steigt die LV-Auswurffraktion daher tendenziell im Verhältnis zum Ausmaß des konzentrischen LV-Umbaus. Die LV-Ejektionsfraktion kann daher das Ausmaß der myokardialen Beeinträchtigung bei Vorliegen eines konzentrischen LV-Remodellings, wie es bei AS-Patienten im Allgemeinen der Fall ist, deutlich unterschätzen. Was für einen LV mit normaler Geometrie normal ist, kann daher für einen LV mit konzentrischem Umbau abnormal sein. Darüber hinaus kann die Verringerung der LV-Leistung (im Zusammenhang mit einer intrinsischen Myokarddysfunktion und einem signifikanten LV-Remodelling) wiederum zu niedrigeren transvalvulären Gradienten führen als erwartet. Die Ergebnisse dieser Patienten sind nahezu identisch mit denen von Patienten mit NF/HG. Wenn diese Patienten symptomatisch sind, haben sie eine bessere Überlebensrate, wenn sie chirurgisch behandelt werden.
Low flow-low gradient
Die Prävalenz des LF/LG-Musters scheint niedriger zu sein als ursprünglich berichtet. Diese Entität macht 7 % bei asymptomatischen Patienten und bis zu 15-35 % bei symptomatischen Patienten aus (4-6,12,14). Dieses Muster, nämlich die paradoxe Low-Flow-AS, stellt eine schwierige klinische Entität dar, die in jüngster Zeit hervorgehoben wurde. Es ist mit einem ausgeprägteren konzentrischen LV-Remodelling, einem kleineren LV-Hohlraum, einer erhöhten globalen LV-Nachlast, einer intrinsischen Myokarddysfunktion, Myokardfibrose und einer schlechten Prognose verbunden (12,15). Bei asymptomatischen Patienten haben wir gezeigt, dass die Wahrscheinlichkeit, nach 3 Jahren ohne AVR am Leben zu bleiben, um das Fünffache niedriger war als beim NF/LG-Muster und um das 4,3-Fache höher als bei der NF/HG-Gruppe (12). Diese klinische Entität wird häufig fehldiagnostiziert, was zu einer Unterschätzung des Schweregrads der AS und damit zu einer unzureichenden Nutzung oder unangemessenen Verzögerung der Operation führen kann. Es ist wichtig, diese Entität zu erkennen, um einem symptomatischen Patienten mit kleiner AVA und LG eine Operation nicht zu verweigern.
Diskordanz zwischen Gradient und Klappenfläche
Zu den möglichen Ursachen für die Diskordanz zwischen AVA und Gradient bei Patienten mit erhaltener LV-Ejektionsfraktion gehören (I) Messfehler, (II) geringe Körpergröße, (III) paradoxe Low-Flow-AS und (IV) inkonsistente Einstufung aufgrund intrinsischer Diskrepanzen in den Leitlinienkriterien (4,6,7,10,11). Erstens können Patienten mit geringer Körpergröße und LV-Dimensionen einen niedrigeren transvalvulären Druckgradienten aufweisen, weil sie ein geringeres, wenn auch normales Schlagvolumen haben. Zweitens kann das Schlagvolumen und damit die AVA unterschätzt werden, weil der LV-Ausflusskanal unterschätzt wird und/oder das Volumen der Pulswellen-Dopplerprobe falsch platziert wurde. Zur Bestätigung der doppler-echokardiographischen Messungen des Schlagvolumens und der AVA können verschiedene Methoden eingesetzt werden. Liegt beispielsweise keine signifikante Mitralinsuffizienz vor, kann das Schlagvolumen leicht mit der Simpson-Methode (volumetrische Methode zur Messung der LV-Ejektionsfraktion und des LV-Volumens) geschätzt werden. Wenn das mit diesen unabhängigen Methoden gemessene Schlagvolumen mit dem im LV-Ausflusskanal gemessenen Schlagvolumen übereinstimmt, kann man sich auf die Genauigkeit der Messung des Schlagvolumens verlassen. Drittens stellt die paradoxe LF/LG eine neue Entität dar, bei der der LF-Zustand sowohl aus einem konzentrischen LV-Remodelling als auch aus einer reduzierten subendokardialen Längsfunktion resultiert. Dies verdeutlicht, dass der Schweregrad der AS nicht falsch eingeschätzt wird. Viertens kann die Diskrepanz im Verhältnis zwischen Gradient und Klappenfläche in einigen Fällen auf Unstimmigkeiten in den aktuellen Leitlinien zurückzuführen sein. Eine Harmonisierung der Definition von schwerer AS könnte einige dieser Patienten mit „schwerer“ AS in „moderate“ AS umklassifizieren. Kombiniert man die aktuellen prospektiven klinischen Daten mit früheren hämodynamischen Echo- und invasiven Daten, so scheint ein Gradient von 40 mmHg eher zu einer Klappenfläche von 0,8 cm2 zu passen, während eine Klappenfläche von 1 cm2 einem mittleren Gradienten von 26 mmHg entspricht (3,6,16). Wenn bei Patienten mit erhaltener LV-Ejektionsfraktion eine Diskordanz zwischen der Klappenfläche (im schweren Bereich) und dem Gradienten (im mittleren Bereich) besteht, können eine umfassendere echokardiographische Doppleruntersuchung und möglicherweise andere diagnostische Tests (BNP, Calcium-Score mittels Multislice-Computertomographie, Belastungs-/Dobutamin-Stress-Echokardiographie) erforderlich sein, um den Schweregrad der Erkrankung zu bestätigen und das therapeutische Management zu steuern.
Klinische Implikationen und Management
In der täglichen Praxis sollte bei der Beurteilung des Schweregrades der AS das Flussgradientenmuster in die klassische Messung der AVA integriert werden. Als allgemeine Regel gilt, dass ein niedriger transvalvulärer Gradient (<40 mmHg) oder eine niedrige Geschwindigkeit (<4 m/s) das Vorhandensein einer schweren AS bei Patienten mit kleiner AVA und erhaltener LV-Ejektionsfraktion nicht ausschließt. Darüber hinaus schließt eine erhaltene LV-Ejektionsfraktion (>50 %) das Vorhandensein einer myokardialen systolischen Dysfunktion und eines geringen transvalvulären Flusses bei AS nicht aus. Patienten mit NF/LG-AS haben in der Regel keine oder nur eine minimale subendokardiale Dysfunktion und ein relativ gutes Ergebnis. In dieser NF/LG-Kategorie sollte die Indikation zur AVR auf Patienten beschränkt werden, bei denen die Symptome eindeutig auf die AS zurückgeführt werden können. In der NF/HG-Kategorie ist die AVR (chirurgisch oder perkutan) die einzige Therapie, die sowohl das Überleben als auch die Symptome deutlich verbessert. Bei asymptomatischen Patienten kann eine individuelle Risikostratifizierung dazu beitragen, Patienten zu identifizieren, die von einer frühzeitigen Operation profitieren können. In den anderen Kategorien ist der NF-Zustand Zeuge einer intrinsischen Myokarddysfunktion und eines fortgeschritteneren Krankheitsprozesses. Symptomatische Patienten mit LF/HG sollten ebenfalls von einer sofortigen AVR profitieren. Bei asymptomatischen Patienten sollte auch eine individuelle Risikostratifizierung gefördert werden. Die Belastungsechokardiographie kann von Interesse sein, um Patienten mit eingeschränkter Klappencompliance und/oder erschöpfter kontraktiler LV-Reserve zu erkennen (17,18). Eine paradoxe LF/LG führt selbst bei asymptomatischen Patienten zu einem schlechten Ergebnis. In dieser Kategorie ist der Nutzen eines chirurgischen Eingriffs zwar nicht erwiesen, doch kann eine AVR bei ausgewählten symptomatischen Patienten wahrscheinlich von Vorteil sein (7,19,20) (Tabelle 1). In der klinischen Praxis ist es schwierig, diese Entität festzustellen. Bevor eine Operation in Betracht gezogen wird, sollten die Symptome mit dem Schweregrad der AS abgeglichen werden. Bei Patienten mit geringem Risiko kann eine AVR befürwortet werden. Bei Hochrisikopatienten sind zusätzliche Ergebnisstudien erforderlich, um die am besten geeignete Behandlungsmethode und den Zeitpunkt der Behandlung zu bestimmen.
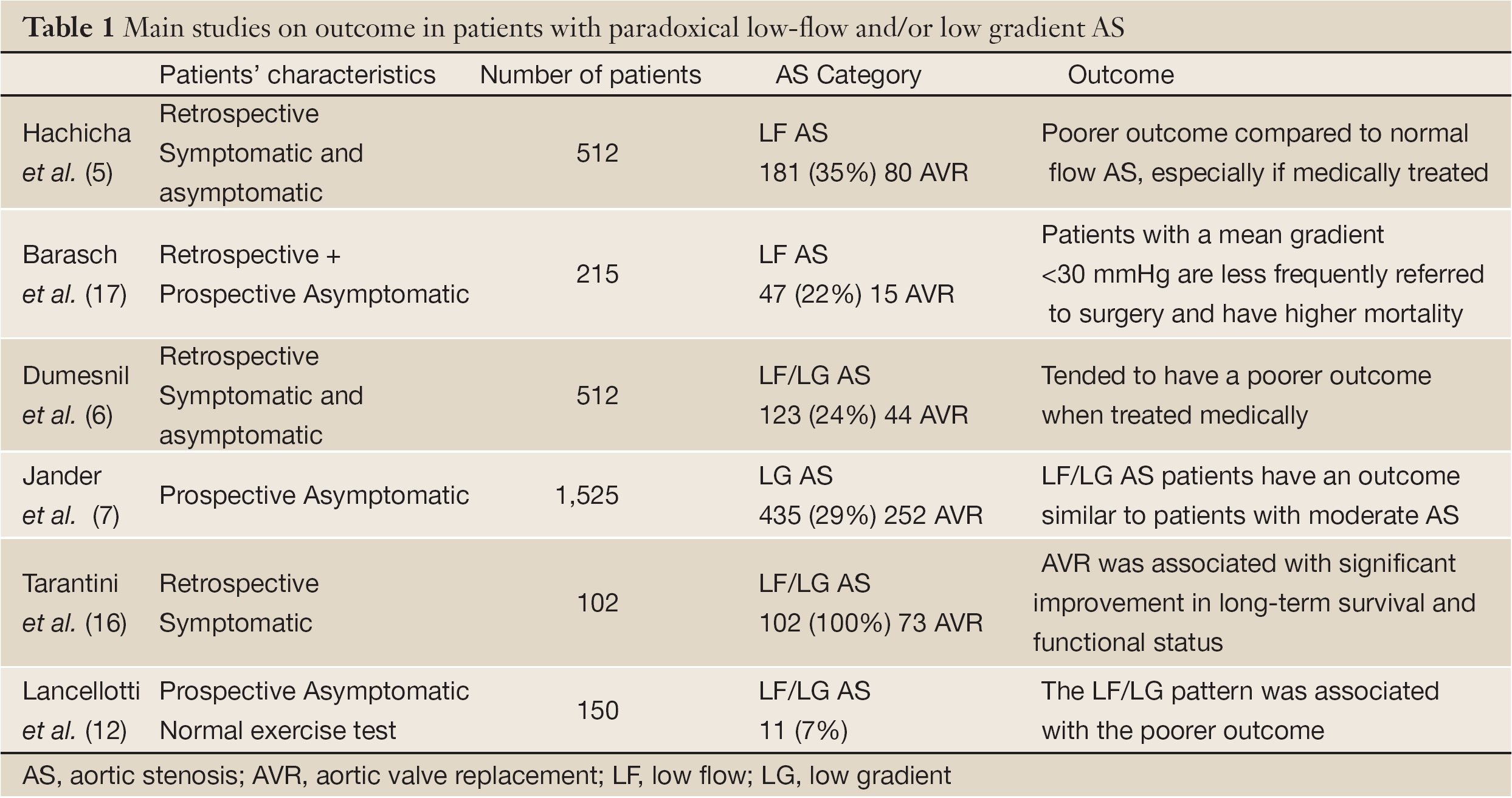
Vollständige Tabelle
Danksagung
Berichterstattung: Die Autoren erklären, dass kein Interessenkonflikt besteht.
- Lancellotti P, Donal E, Magne J, et al. Risk stratification in asymptomatic moderate to severe aortic stenosis: the importance of the valvular, arterial and ventricular interplay. Heart 2010;96:1364-71.
- Bonow RO, Carabello BA, Kanu C, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease): developed in collaboration with the Society of Cardiovascular Anesthesiologists: endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons. Circulation 2006;114:e84-231.
- Minners J, Allgeier M, Gohlke-Baerwolf C, et al. Inconsistent grading of aortic valve stenosis by current guidelines: haemodynamic studies in patients with apparently normal left ventricular function. Heart 2010;96:1463-8.
- Adda J, Mielot C, Giorgi R, et al. Low-Flow, Low-Gradient Severe Aortic Stenosis Despite Normal Ejection Fraction Is Associated With Severe Left Ventricular Dysfunction as Assessed by Speckle-Tracking Echocardiography: A Multicenter Study. Circ Cardiovasc Imaging 2012;5:27-35.
- Hachicha Z, Dumesnil JG, Bogaty P, et al. Paradoxical low-flow, low-gradient severe aortic stenosis despite preserved ejection fraction is associated with higher afterload and reduced survival. Circulation 2007;115:2856-64.
- Dumesnil JG, Pibarot P, Carabello B. Paradoxical low flow and/or low gradient severe aortic stenosis despite preserved left ventricular ejection fraction: implications for diagnosis and treatment. Eur Heart J 2010;31:281-9.
- Jander N, Minners J, Holme I, et al. Outcome of patients with low-gradient „severe“ aortic stenosis and preserved ejection fraction. Circulation 2011;123:887-95.
- Ozkan A. Low gradient „severe“ aortic stenosis with preserved left ventricular ejection fraction. Cardiovasc Diagn Ther 2012;2:19-27.
- Dumesnil JG, Pibarot P, Akins C. New approaches to quantifying aortic stenosis severity. Curr Cardiol Rep 2008;10:91-7.
- Pibarot P, Dumesnil JG. Bewertung des Schweregrads der Aortenstenose: Wenn der Gradient nicht mit der Klappenfläche übereinstimmt. Heart 2010;96:1431-3.
- Lancellotti P, Magne J. Valvuloarterial impedance in aortic stenosis: look at the load, but do not forget the flow. Eur J Echocardiogr 2011;12:354-7.
- Lancellotti P, Magne J, Donal E, et al. Clinical outcome in asymptomatic severe aortic stenosis insights from the new proposed aortic stenosis grading classification. J Am Coll Cardiol 2012;59:235-43.
- Monin JL, Lancellotti P, Monchi M, et al. Risk score for predicting outcome in patients with asymptomatic aortic stenosis. Circulation 2009;120:69-75.
- Lancellotti P, Donal E, Magne J, et al. Impact of global left ventricular afterload on left ventricular function in asymptomatic severe aortic stenosis: a two-dimensional speckle-tracking study. Eur J Echocardiogr 2010;11:537-43.
- Herrmann S, Störk S, Niemann M, et al. Low-gradient aortic valve stenosis myocardial fibrosis and its influence on function and outcome. J Am Coll Cardiol 2011;58:402-12.
- Zoghbi WA. Niedriggradige „schwere“ Aortenstenose mit normaler systolischer Funktion: Zeit für eine Verfeinerung der Leitlinien? Circulation 2011;123:838-40.
- Lancellotti P, Lebois F, Simon M, et al. Prognostic importance of quantitative exercise Doppler echocardiography in asymptomatic valvular aortic stenosis. Circulation 2005;112:I377-82.
- Maréchaux S, Hachicha Z, Bellouin A, et al. Usefulness of exercise-stress echocardiography for risk stratification of true asymptomatic patients with aortic valve stenosis. Eur Heart J 2010;31:1390-7.
- Tarantini G, Covolo E, Razzolini R, et al. Klappenersatz bei schwerer Aortenklappenstenose mit niedrigem transvalvulärem Gradienten und linksventrikulärer Ejektionsfraktion über 0,50. Ann Thorac Surg 2011;91:1808-15.
- Barasch E, Fan D, Chukwu EO, et al. Severe isolated aortic stenosis with normal left ventricular systolic function and low transvalvular gradients: pathophysiologic and prognostic insights. J Heart Valve Dis 2008;17:81-8.