Introduction
Charophyten oder basale Streptophyten; (Becker und Marin, 2009; Leliaert et al., 2012) bilden eine vielfältige taxonomische Auswahl an existierenden Süßwasser- und terrestrischen Grünalgen, die ein breites Spektrum an einzelligen, fadenförmigen und „parenchymatösen“ Formen aufweisen (Graham, 1993; Lewis und McCourt, 2004). Ein Urstamm von Charophyten tauchte vor 450-500 Millionen Jahren auf dem Land auf und besiedelte es. Diese Organismen passten sich an die terrestrischen Bedingungen an, waren in der Lage zu überleben und sich zu vermehren, wenn sie der Atmosphäre vollständig ausgesetzt waren, und einige Mitglieder entwickelten sich schließlich zu Landpflanzen (Zhong et al., 2013; Delwiche und Cooper, 2015). Diese „Terrestrisierung“ der Grünpflanzen war ein biologisches Schlüsselereignis, das die Biogeochemie und die Naturgeschichte des Planeten für immer veränderte. Die anschließende Verbreitung von Landpflanzen veränderte die Bedingungen in der Atmosphäre und im Boden und ermöglichte das Auftauchen anderer vielfältiger Lebensformen auf dem Land. Die Evolution der Landpflanzen veränderte auch die Geschichte der Menschheit, vor allem durch die Erfindung der Landwirtschaft und die daraus resultierende Entstehung der modernen menschlichen Zivilisation. Teilweise aufgrund ihrer evolutionären Bedeutung haben Charophyten in den letzten Jahrzehnten erhebliche Aufmerksamkeit von Pflanzenbiologen erhalten (Pickett-Heaps und Marchant, 1972; Pickett-Heaps, 1975; Mattox und Stewart, 1984; Becker und Marin, 2009; Harholt et al., 2016). Da jedoch weitere neue Daten über die Biologie dieser Algen gesammelt wurden, sind sie zu wichtigen Modellen für das Verständnis grundlegender Phänomene in der Biochemie, Zellbiologie, Entwicklungsbiologie, Ökologie und zunehmend auch der Molekularbiologie geworden (Delwiche und Cooper, 2015; Lemieux et al., 2016). Die Reihe Frontiers in Plant Science über „Charophyten“ veranschaulicht die Bedeutung dieser Organismen in mehreren spezifischen Bereichen der pflanzenbiologischen Forschung. Diese Mini-Review hebt die Eigenschaften von Charophyten als Modellorganismen in verschiedenen Forschungsbereichen hervor. Sie wird hoffentlich auch eine neue Generation von Wissenschaftlern ermutigen, die Verwendung dieser Algen in der Grundlagenforschung zu erweitern und ein Screening anderer Taxa zu initiieren, das wiederum zur Identifizierung und Verwendung neuer Modell-Charophyten führen kann.
Die „Aufstellung“ der Charophyten
In den 1970er und 1980er Jahren wurden ultrastrukturelle (z.B., Zellteilungsmechanismus, Substruktur des Geißelapparats) und biochemische Daten (z. B. Enzymprofile) die Hauptkriterien für die Einordnung einer Grünalge in die Charophyten-Linie (Mattox und Stewart, 1984; Lewis und McCourt, 2004; Leliaert et al., 2012). Seit den 1990er Jahren bis heute haben Studien, die sich auf molekulare Analysen von Chloroplasten- und Kerngenomen und Transkriptomen konzentrierten, frühere taxonomische und phylogenetische Schemata bestätigt und verfeinert (Timme et al., 2012; Delwiche und Cooper, 2015). Ergänzt wurde dies durch detaillierte biochemische, immunologische und zellbiologische Analysen der Zellwände von Charophyten sowie der Biosynthese- und Signalwege von Hormonen (Popper und Fry, 2003; Popper, 2008; Sørensen et al., 2010, 2011, 2012; Zhang und van Duijn, 2014; Ju et al., 2015; O’Rourke et al., 2015). Die heute existierenden Charophyten weisen im Vergleich zu anderen Grünalgentaxa eine relativ geringe Diversität auf und umfassen 13 Familien und 122 Gattungen (Becker und Marin, 2009; Leliaert et al., 2012). Nach derzeitiger phylogenetischer Auffassung werden die Charophyten in sechs Klassen eingeteilt (Abbildung 1; Delwiche und Cooper, 2015). Die Basisklasse, die Mesostigmatophyceae, wird durch eine einzige bekannte Gattung, Mesostigma, vertreten. Diese Alge ist ein einzelliger Biflagellat mit einer einzigartigen asymmetrischen Form (d. h. wie ein abgeflachtes Rettungsboot) und ist von Schichten kunstvoll gestalteter Schuppen bedeckt (Manton und Ettl, 1965; Becker et al., 1991; Domozych et al., 1991, 1992). Die zweite Klasse, die Chlorokybophyceae, besteht ebenfalls aus einer einzigen bekannten Art, Chlorokybus atmophyticus. Diese seltene Alge bildet ein sarkinoides Zellpaket, das von einer dicken gelartigen Hülle umgeben ist (Rogers et al., 1980). Es sei darauf hingewiesen, dass Mesostigma und Chlorokybus in alternativen Phylogenien als Schwesterlinien betrachtet werden, die zusammen mit allen anderen Streptophyten verwandt sind (Rodríguez-Ezpeleta et al., 2007). In der Phylogenie der sechs Klassen besteht die dritte Klasse, die Klebsormidiophyceae, aus drei Gattungen, die einfache, unverzweigte Filamente bilden (Sluiman et al., 2008), die oft Teil von „biologischen Krusten“ sind, die auf Oberflächen verschiedener terrestrischer Lebensräume wachsen. Mehrere Arten dieser Klasse können als Teil von Wüstenkrusten sogar erheblichem Austrocknungsstress widerstehen (Mikhailyuk et al., 2008, 2014; Holzinger und Karsten, 2013); andere sind tolerant gegenüber Austrocknungsstress in Umgebungen mit niedrigen Temperaturen (Stamenkovic et al., 2014; Herburger und Holzinger, 2015). Diese ersten drei Klassen bilden die „früh divergenten“ Charophyten. Die „spätdivergente“ Linie umfasst ebenfalls drei Klassen. Die Charophyceae oder Steinpilze sind häufig in Süßwasser-Ökosystemen anzutreffen und besitzen makroskopische mehrzellige Thalli, die aus Aggregaten verzweigter Fäden aus außergewöhnlich länglichen Zellen bestehen (Lewis und McCourt, 2004). Die Mitglieder dieser Gruppe haben eine auf Oogamie basierende sexuelle Fortpflanzung mit beweglichen Spermien und unbeweglichen Eiern, die beide in vielzelligen Gametangien produziert werden. Die Coleochaetophyceae bestehen aus Taxa mit mehrzelligen Thalli, die aus verzweigten fadenförmigen oder parenchymartigen Thalli bestehen (Graham, 1993; Delwiche et al., 2002). Diese Organismen weisen auch eine ausgeprägte, auf Oogamie basierende sexuelle Fortpflanzung auf. Die Coleochaetophyceae sind typischerweise an der Schnittstelle zwischen Süßwasser und terrestrischen Lebensräumen zu finden, oft als Epiphyten. Die größte und vielfältigste Gruppe der Charophyten schließlich, die Zygnematophyceae, besteht aus Einzellern und unverzweigten Fäden (Gontcharov et al., 2003; Guiry, 2013). Das Unterscheidungsmerkmal dieser Gruppe ist das Vorhandensein einer konjugationsbasierten sexuellen Fortpflanzung, die eine komplexe Zell-Zell-Signalübertragung und Adhäsion erfordert (Abe et al., 2016). Die zygnematophyceen Algen sind häufige Bewohner von Süßwasserhabitaten, die manchmal in spektakulären ephemeren Blüten auftreten, sowie von feuchten terrestrischen Substraten.

Abbildung 1. Existierende Charophyten. Die heute lebenden Charophyten werden in frühe und späte Taxa unterteilt. Zu den früh divergierenden Taxa gehören die Mesostigmatophyceae, die Chlorokybophyceae und die Klebsormidiophyceae und zu den spät divergierenden Taxa die Charophyceae, die Coleochaetophyceae und die Zygnematophyceae. Vertreter jeder Gruppe sind Mesostigma (Mesostigmatophyceae), Chlorokybus atmophyticus (Chlorokybophyceae), Klebsormidium flaccidum (Klebsormidiophyceae), Chara (Charophyceae), Coleochaete scutata (Coleochaetophyceae), und Micrasterias (Zygnematophyceae).
Charophyten als Modellorganismen
Einige Charophyten wurden ausgiebig als Modellorganismen für die Untersuchung grundlegender biologischer Prozesse verwendet. Ihre kleinen und einfachen Thalli (d.h. im Vergleich zu Landpflanzen) und ihre einfache experimentelle Manipulation sind nur zwei der Eigenschaften, die sie zu attraktiven Modellorganismen machen. Jüngste Erkenntnisse haben auch gezeigt, dass viele Charophyten mehrere bemerkenswert ähnliche Merkmale wie Landpflanzen aufweisen, darunter das Vorhandensein von Biosynthesewegen für viele Wachstumsregulatoren (Abbildung 2; Boot et al., 2012; Hori et al., 2014; Wang et al., 2014, 2015; Holzinger und Becker, 2015; Ju et al., 2015) und mehrere Zellwandpolymere (Popper, 2008; Sørensen et al., 2010, 2011, 2012; Mikkelsen et al., 2014). Aufgrund dieser beiden Eigenschaften sind Charophyten in Forschungsbereichen wie der molekularen Entwicklung von Pflanzen und der Stressphysiologie von großem Nutzen. Während viele Charophyten in einem breiten Spektrum biologischer Studien verwendet wurden, sind die folgenden Taxa am bemerkenswertesten für ihre umfassende Verwendung in mehreren Studienbereichen als Modelle:
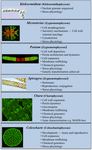
Abbildung 2. Aktuelle Modell-Charophyten. Mehrere Charophyten, darunter Klebsormidium, Micrasterias, Penium, Spirogyra, Chara und Coleochaete werden als Modelle verwendet; jede hat spezifische Eigenschaften, die sie zu einem besonders geeigneten Modell für bestimmte physiologische und biochemische Prozesse machen.
Desmiden: Die symmetrischen Modelle
Die Zygnematophyceae haben sich kürzlich als die wahrscheinlichsten lebenden Vorfahren der Landpflanzen erwiesen (Wodniok et al, 2011; Delwiche und Cooper, 2015). Die einzelligen Mitglieder der umfassenden Placoderm-Desmidengruppe sind zu wichtigen Modellen für die Aufklärung vieler grundlegender Prinzipien der Pflanzenzellbiologie und -entwicklung geworden. Große Zellgröße, bemerkenswerte Symmetrie/Form, ausgeprägte Zellwandarchitektur und ausgefeilte Endomembran-/Zytoskelettsysteme sind nur einige der Merkmale, die sie zu hervorragenden Zellsystemen für die Untersuchung von Zellphysiologie und -entwicklung machen. Die jüngste Etablierung stabiler transformierter Linien und die baldige Sequenzierung der Genome/Transkriptome ausgewählter Desmiden haben ihren Wert für botanische Studien weiter erhöht. Zwei Taxa, Micrasterias und Penium, haben sich als die am besten untersuchten Desmiden herausgestellt.
Micrasterias war in den letzten 50 Jahren aufgrund seiner einzigartigen Eigenschaften die beliebteste Desmide für die zellbiologische Forschung (Meindl, 1993; Lutz-Meindl, 2016). Die Micrasterias-Zelle weist eine bilaterale Symmetrie auf, die oft durch eine spektakulär sezierte (d. h. mehrlappige) Peripherie hervorgehoben wird. Neue Tochter-Semizellen, die durch Zellteilung entstehen, haben nicht diese komplexe Morphologie, sondern sind eher kugelförmig. Ein komplexes postzytokinetisches Entwicklungsprogramm, das mehrere hochgradig koordinierte subzelluläre Mechanismen einsetzt, erzeugt anschließend den multilobalen Phänotyp während der Expansion der Tochter-Semizellen. Dieses Programm ist auch für die Ablagerung von Polymeren zur Bildung einer primären und sekundären Zellwand verantwortlich. Diese Vorgänge konzentrieren sich auf ein großes Netzwerk von Golgi-Körpern und zugehörigen Vesikeln, die einen komplexen Sekretionsmechanismus ergeben. Dieser Prozess ist wiederum auf bestimmte Stellen der Zelloberfläche ausgerichtet, die eine multipolare Zellexpansion und die gleichzeitige Sekretion von Zellwandmakromolekülen und extrazellulärem Schleim erzeugen (Kim et al., 1996; Lutz-Meindl und Brosch-Salomon, 2000; Oertel et al., 2004; Aichinger und Lutz-Meindl, 2005). Der Transport von sekretorischen Komponenten an bestimmte Stellen der Zelloberfläche erfordert ein ausgeklügeltes Aktinomyosin-basiertes zytomotiles System und wird durch verschiedene Signaltransduktionskaskaden gesteuert (Meindl et al., 1994; Oertel et al., 2003). Darüber hinaus reagiert die Zellmorphogenese sehr empfindlich auf externen Stress (z. B. oxidativen Stress, Salzgehalt, Schwermetalle), der zu erheblichen Veränderungen in der Zelldifferenzierung führt (Darehshouri et al., 2008; Affenzeller et al., 2009; Andosch et al., 2012). Micrasterias ist ein hervorragender Organismus für die Analyse dieser subzellulären Merkmale, da er im Labor leicht zu pflegen und zu manipulieren ist und sich besonders gut für die Aufnahme hochauflösender Bilder mittels Licht- und Elektronenmikroskopie einschließlich Immunozytochemie, Focused Ion Beam-Scanning Electron Microscopy (FIB-SEM) und Electron Energy Loss Spectroscopy (EELS) eignet (Lutz-Meindl, 2007; Eder und Lutz-Meindl, 2008, 2010; Wanner et al., 2013; Lutz-Meindl et al., 2015). Darüber hinaus haben erste molekulare Analysen, einschließlich der Herstellung von transformierten Zelllinien, die Nutzung von Micrasterias weiter verbessert, insbesondere im Hinblick auf die molekulare Dynamik der Zellwandverarbeitung (Vannerum et al., 2010, 2011, 2012).
In den letzten zehn Jahren hat sich auch die Desmide, Penium margaritaceum, zu einem wertvollen Modellorganismus entwickelt (Domozych et al., 2009, 2014; Sørensen et al., 2014; Rydahl et al., 2015; Worden et al., 2015). Im Gegensatz zu Micrasterias hat Penium eine einfache zylindrische Form, besitzt nur eine primäre Zellwand und lagert während der Expansion Wandpolymere an zwei spezifischen Stellen der Zelloberfläche ab (Domozych et al., 2011). Diese relative Einfachheit ist äußerst attraktiv für die Erforschung grundlegender Prinzipien der pflanzlichen Zellentwicklung, einschließlich der Zellwandentwicklung, der Zellexpansion und der Sekretionsdynamik (Domozych et al., 2005, 2014; Ochs et al., 2014). Eine ihrer wichtigsten Eigenschaften ist, dass sie Wandpolymere besitzt, die denen vieler Landpflanzen ähnlich sind (z. B. Zellulose, Pektine, Hemizellulosen), und dass diese Polymere mit monoklonalen Antikörpern markiert werden können. Nach der Markierung lebender Zellen können diese in die Kultur zurückgebracht werden, wo die anschließende Zellexpansion und die Wandablagerung überwacht werden können (Domozych et al., 2009; Rydahl et al., 2015). Penium lässt sich auch leicht im Labor halten, und seine schnelle Wachstumsrate unter genau kontrollierten Bedingungen macht es zu einem ausgezeichneten Exemplar für groß angelegte gleichzeitige Mikroarray-Screenings vieler chemischer Wirkstoffe (durch Wachstum in Multiwell-Platten) und für die Bewertung ihrer spezifischen Auswirkungen auf die Expansion/Wandentwicklung (Worden et al., 2015). Dies trägt wesentlich dazu bei, die Rolle spezifischer subzellulärer Komponenten und Prozesse bei der Expansion/Differenzierung aufzudecken. Kürzlich hat die Isolierung stabiler transformierter Linien (Sørensen et al., 2014) das Potenzial dieser Alge für künftige Pflanzenzellstudien weiter erhöht.
Chara und Nitella: Zelluläre Giganten für die Pflanzenphysiologie
Spezies von Chara und Nitella (Charophyceae) werden seit langem als Präparate für eine Vielzahl biologischer Untersuchungen verwendet, insbesondere für solche, die sich mit zellulärer Dynamik, Ausdehnung und cytoplasmatischer Strömung befassen (Green, 1954; Probine und Preston, 1962). Ihre makroskopischen Thalli zeichnen sich durch Knoten aus, aus denen Verzweigungen und Gametangien entstehen, sowie durch Internodien, die aus besonders langgestreckten Zellen bestehen. Internodale Zellen weisen eine deutlich erkennbare Schichtung subzellulärer Komponenten auf, wobei schraubenförmig orientierte Chloroplasten einen stationären Kortex definieren, der ein Endoplasma umgibt, in dem die am schnellsten aufgezeichneten, durch Aktinomyosin erzeugten zytoplasmatischen Strömungen auftreten. Das Zytoplasma enthält verschiedene Endomembrankomponenten, die an dynamischen Membranhandelsnetzwerken (z. B. Endozytose und Exozytose) teilnehmen, die durch komplexe Signaltransduktionskaskaden gesteuert werden (Foissner und Wastenys, 2000, 2012, 2014; Sommer et al., 2015; Foissner et al., 2016). Die Internodienzellen besitzen Zellwände, die reich an Zellulose und dem Pektin Homogalacturonan (HG) sind. Der Turgor ist die Hauptantriebskraft für die Ausdehnung, und Pektin ist höchstwahrscheinlich die tragende Komponente, die die Ausdehnung der Wände steuert. Die zyklische, nicht-enzymatische Modulation und gleichzeitige Kalziumkomplexierung des HG ist der Mechanismus, der für die Steuerung der Wandmodulationen verantwortlich ist, die zur Zellexpansion führen (Proseus und Boyer, 2007, 2008, 2012; Boyer, 2016). Einer der technischen Vorteile von Chara und Nitella in der Zellforschung besteht darin, dass die Internodienzellen einzeln entfernt werden können; Endoplasma und Zellwände können „herausgeschnitten“ und dann als azelluläre Systeme für experimentelle Manipulationen verwendet werden.
Andere Thalluskomponenten wie Rhizoide haben eine organisierte polare Organisation des Zytoplasmas. Diese Zellen enthalten sedimentierbare, mineralreiche Statolithen an der Spitze, die für die Wahrnehmung der Schwerkraft zuständig sind (Hodick et al., 1998; Braun, 2002; Braun und Limbach, 2006). Diese Eigenschaft hat Chara zum ersten Charophyten im Weltraum gemacht. Während der Parabelflüge der TEXUS-Rakete konnte gezeigt werden, dass die Statolithen Spannungskräfte auf Aktinfilamente ausüben. Ein Gleichgewicht der Kräfte (d. h. Schwerkraft und die entgegenwirkende Kraft der Aktinfilamente) ist für die korrekte Positionierung der Statolithen im Rhizoid verantwortlich, die wiederum die Fähigkeit zur Reaktion auf den Schwerkraftvektor gewährleisten (Braun und Limbach, 2006). Die Verwendung von Laserpinzetten und langsam rotierender Zentrifugenmikroskopie hat gezeigt, dass die Sedimentation der Statolithen nicht ausreicht, um eine gravitropische Biegung der Rhizoidspitze zu bewirken. Vielmehr müssen sich die mineralreichen Statolithen auf bestimmten Regionen der Plasmamembran absetzen, damit gravitropische morphologische Effekte auftreten (Braun, 2002). Chara wurde auch verwendet, um andere Phänomene zu untersuchen, einschließlich der Elektrophysiologie und der Rolle und Bewegung von Hormonen (Belby, 2016).
Coleochaete für Entwicklungsstudien und Musterentwicklung
Die Bildung eines multizellulären Thallus (d. h. Gewebe, Organ) einer Pflanze erfordert präzise, räumlich regulierte Zellteilungsebenen, die durch mehrere Sätze von Genen gesteuert werden, die an bestimmten Punkten während der Entwicklung exprimiert werden (Besson und Dumais, 2011; Umen, 2014). Die Morphogenese des Thallus ist sowohl räumlich als auch zeitlich dreidimensional gesteuert und wird auch als Reaktion auf externe Stressfaktoren moduliert. In Pflanzen werden diese Entwicklungsprogramme durch das Vorhandensein von Zellwänden, die keine Zellmigration oder Gewebeflexibilität zulassen, noch komplexer. Die Aufklärung der spezifischen Ereignisse, die für die Ausprägung der Thallusform und -größe von zentraler Bedeutung sind, ist bei Landpflanzen oft schwierig, da die Auflösung spezifischer Zellverhaltensweisen in hochkomplexen und ausgedehnten Geweben/Organen oft nur schlecht möglich ist. Die Verwendung von Organismen mit einfacheren Thallusformen hat sich für das Verständnis grundlegender Entwicklungsphänomene als vorteilhaft erwiesen, und die Charophytengattung Coleochaete ist ein solches Beispiel. Bestimmte Arten (z. B. C. orbicularis, C. scutatum) bilden einen parenchymatösen scheibenförmigen Thallus, der durch eine Kombination von anti- oder peri-klinalen Zellteilungen und anschließender Expansion der äußersten Zellen nach außen wächst (Brown et al., 1994; Cook, 2004). Die Teilungsebene einer jeden Zelle folgt einfachen Regeln, die auf der Zellgröße, der Zellform und der geografischen Lage im Thallus beruhen (Dupuy et al., 2010; Besson und Dumais, 2011). Diese Eigenschaft ermöglicht die Konstruktion mathematischer Modelle, die dann zur Interpretation der mehrzelligen Morphogenese verwendet werden können (Domozych und Domozych, 2014; Umen, 2014) und wichtige Einblicke in die Evolution, Biomechanik und Physiologie von Organen und ganzen Organismen liefern. Darüber hinaus wurden einige Coleochaete-Arten ausgiebig untersucht, um die strukturellen und funktionellen Veränderungen zu bestimmen, die an einem Thallus unter Austrocknungsbedingungen auftreten (Graham et al., 2012), d. h. Schlüsselmerkmale für das Verständnis der frühen Landpflanzenevolution und der Wachstumsdynamik von Pflanzen während Dürreperioden.
Einblicke aus Genom- und Genstudien
Wie viele andere Technologien können auch molekulare Werkzeuge neue Informationen liefern, die für viele Forschungsbereiche von Bedeutung sind, einschließlich Physiologie und Entwicklung. So wurden beispielsweise Mitglieder der MADS-Box-Genfamilie aus drei Charophyten, Chara globularis, Coleochaete scutata und Closterium peracerosum-strigosum-littorale, isoliert und charakterisiert (Tanabe et al., 2005). Das Expressionsmuster der MADS-Box-Gene in den Charophyten lässt vermuten, dass sie eine Rolle bei der haploiden Entwicklung und Reproduktion spielen (Tanabe et al., 2005). Es wird angenommen, dass sie im Laufe der Evolution der Landpflanzen in die diploide Generation aufgenommen wurden und ihre Rolle in der Entwicklung weiter diversifiziert wurde (Tanabe et al., 2005). Bis heute ist Klebsormidium flaccidum der einzige Charophyt, für den ein nahezu vollständiges Kerngenom verfügbar ist (Hori et al., 2014), obwohl Chloroplasten- und Mitochondriengenome für Vertreter jeder der sechs Charophytenklassen sequenziert wurden und ESTs (expressed sequence tags) für einige Charophyten verfügbar sind (Delwiche, 2016). Das Klebsormidium-Genom hat bereits das Vorhandensein von Genen für die Synthese mehrerer Pflanzenhormone und Signalintermediate, Mechanismen zum Schutz vor hoher Lichtintensität (Hori et al., 2014) und das Vorhandensein von WRKY-Transkriptionsfaktoren der Gruppe IIb gezeigt, von denen man bisher annahm, dass sie zuerst in Moosen auftraten (Rinerson et al., 2015). Derzeit laufen mehrere Projekte zur Sequenzierung von Charophyten-Genomen (Delwiche, 2016), die detailliertere vergleichende Analysen unter Einbeziehung einer größeren Anzahl von Charophyten ermöglichen und möglicherweise neue Erkenntnisse über die evolutionären Beziehungen zwischen Arten und Genen liefern werden. Die einzigartige Position der Charophyten als die am frühesten divergierende Gruppe der Streptophyten macht sie zu einem besonders leistungsfähigen Instrument für evolutionäre Entwicklungsstudien, und neue Technologien wie die kürzlich erreichte stabile Transformation bei Penium (Sørensen et al.,
Zukünftige Verwendung von Charophyten als Modellorganismen
Ein entscheidender nächster Schritt in der Charophyten-Forschung ist die Analyse der Genome der einschließenden Taxa und vergleichende Studien mit denen von Landpflanzen. Diese Arbeit wird nicht nur wichtige Erkenntnisse über die Anpassungsmechanismen liefern, die Charophyten bei ihrem Auftauchen und ihrer erfolgreichen Besiedlung terrestrischer Lebensräume entwickelt haben, sondern auch die Verwendung der derzeitigen Modellorganismen in der Pflanzengrundlagenforschung weiter verfeinern und ausweiten. Obwohl molekulare Studien viele Forschungsbereiche unterstützen werden, sind zwei Bereiche, die unmittelbar davon profitieren werden, die Zellwandbiologie und die Dynamik von Wachstumsregulatoren in Wachstum und Entwicklung. In ersterem Bereich könnten Charophyten zur Klärung vieler grundlegender, aber noch unzureichend geklärter Phänomene beitragen, darunter die Pektin- und Zellwandproteinbiosynthese, die kontrollierte Sekretion, Ablagerung und postsekretorische Modulation von Wandpolymeren und die spezifischen, interaktiven Netzwerke für den Membranverkehr in Pflanzenzellen. Im letzteren Fall würden Charophytenmodelle dazu beitragen, die molekulare Signalübertragung, die Zellbiologie und die Entwicklungsdynamik von Wachstum und Entwicklung in Verbindung mit Hormonen wie Ethylen und Auxin zu entschlüsseln. Jüngste ökophysiologische Studien mit Charophyten bieten auch eine potenzielle Fundgrube an wichtigen Daten zur Bestimmung der Anpassung von Pflanzenzellen an Stress, einschließlich Austrocknung und Salztoleranz (Holzinger und Karsten, 2013; Pichrtová et al., 2014; Herburger et al., 2015; Holzinger und Becker, 2015; Holzinger und Pichrtová, 2016; Kondo et al., 2016). Die Zukunft der Charophyten-Forschung ist in der Tat sehr vielversprechend und wird folglich zu einem Segen für die gesamte Pflanzenbiologie werden.
Autorenbeiträge
Alle aufgeführten Autoren haben einen substanziellen, direkten und intellektuellen Beitrag zu dieser Arbeit geleistet und sie zur Veröffentlichung freigegeben.
Conflict of Interest Statement
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Acknowledgment
Diese Arbeit wurde durch NSF (USA) MCB collaborative grants 1517345 und 1517546 unterstützt.
Belby, M. J. (2016). Multi-scale characean experimental system: from electrophysiology of membrane transporters to cell-to-cell connectivity, cytoplasmic streaming and auxin metabolism. Front. Plant Sci. 7:1052. doi: 10.3389/fpls.2016.01052
CrossRef Full Text | Google Scholar
Braun, M. (2002). Schwerkraftwahrnehmung erfordert Statolithen, die sich auf spezifischen Plasmamembranbereichen in Characeen-Rhizoiden und Protonemata ansiedeln. Protoplasma 219, 150-159. doi: 10.1007/s007090200016
CrossRef Full Text | Google Scholar
Braun, M., and Limbach, C. (2006). Rhizoide und Protonemata von Armleuchteralgen: Modellzellen für die Erforschung von polarisiertem Wachstum und pflanzlicher Schwerkraftsensitivität. Protoplasma 229, 133-142. doi: 10.1007/s00709-006-0208-9
CrossRef Full Text | Google Scholar
Graham, L. E. (1993). Origin of Land Plants. New York, NY: John Wiley & Sons, 287.
Google Scholar
Herburger, K., and Holzinger, A. (2015). Lokalisierung und Quantifizierung von Kallose in den Streptophyten Grünalgen Zygnema und Klebsormidium: Korrelation mit Austrocknungstoleranz. Plant Cell Physiol. 56, 2259-2270. doi: 10.1093/pcp/pcv139
CrossRef Full Text | Google Scholar
Lemieux, C., Otis, C., and Turmel, M. (2016). Vergleichende Chloroplastengenomanalysen von streptophytischen Grünalgen decken große strukturelle Veränderungen bei den Klebsormidiophyceae, Coleochaetophyceae und Zygnematophyceae auf. Front. Plant Sci. 7:697. doi: 10.3389/fpls.2016.00697
CrossRef Full Text | Google Scholar
Lutz-Meindl, U. (2007). Einsatz der energiefiltrierenden Transmissionselektronenmikroskopie zur Bilderzeugung und Elementanalyse in pflanzlichen Organismen. Micron 38, 181-196. doi: 10.1016/j.micron.2006.03.017
CrossRef Full Text | Google Scholar
Meindl, U. (1993). Micrasteria-Zellen als Modellsystem zur Erforschung der Morphogenese. Microbiol. Rev. 57, 415-433.
Google Scholar
Pichrtová, M., Kulichova, J., and Holzinger, A. (2014). Stickstofflimitierung und langsame Trocknung induzieren Austrocknungstoleranz bei konjugierenden Grünalgen (Zygnematophyceae, Streptophyta) aus polaren Lebensräumen. PLoS ONE 9:e113137. doi: 10.1371/journal.pone.0113137
CrossRef Full Text | Google Scholar
Pickett-Heaps, J. D., and Marchant, H. J. (1972). Die Phylogenie der Grünalgen: ein neuer Vorschlag. Cytobios 6, 255-264.
Google Scholar
Stamenkovic, M., Woelken, E., and Hanelt, D. (2014). Ultrastruktur von Cosmarium-Stämmen (Zygnematophyceae, Streptiophyta), die an verschiedenen geografischen Standorten gesammelt wurden, zeigt artspezifische Unterschiede sowohl bei optimalen als auch bei Stress-Temperaturen. Protoplasma 251, 1491-1509.
Google Scholar