Einführung
Die zunehmende Insektizidresistenz und die Auswirkungen auf die Gesundheit von Mensch und Umwelt haben den Einsatz von entomopathogenen Pilzen (EPF) zur Biokontrolle gefördert (Inglis et al., 2001). Tropische Umgebungen beherbergen eine beeindruckende mikrobielle Biodiversität (Thompson et al., 2017), darunter viele Parasiten von Arthropoden (Mahe et al., 2017). Die bei weitem häufigsten kommerziell erhältlichen EPF in tropischen und subtropischen Agrarökosystemen gehören jedoch zu zwei Gattungen: Beauveria und Metarhizium (Ascomycota: Hypocreales) (Faria und Wraight, 2007; Li et al., 2010; Kumar et al., 2018; Mascarin et al., 2019). Im Folgenden wird die Literatur zur Bekämpfung von Arthropoden-Schädlingen mit Entomopathogenen mit besonderem Schwerpunkt auf diesen beiden Gattungen vorgestellt.
Metarhizium und Beauveria sind weltweit verbreitet und weisen eine erhebliche genetische Diversifizierung auf, mit einem breiten Wirtsspektrum von Insekten und großen ökologischen Nischen (Driver et al., 2000; Rehner und Buckley, 2005; Zimmermann, 2007). Viele Aspekte des Einsatzes dieser EPF zur Schädlingsbekämpfung erstrecken sich daher über Breitengradienten, und wir erörtern diese allgemein. Die Umweltbedingungen und die Artenzusammensetzung können sich jedoch zwischen tropischen und gemäßigten Regionen stark unterscheiden, so dass wir diese Faktoren mit spezifischem Bezug auf tropische Studien erörtern und allgemeine Theorien, die sich aus Modellsystemen ergeben, verwenden, um Lücken in der aktuellen Literatur zu schließen und weitere Studien anzuregen.
EPF werden im Allgemeinen als Biopestizide formuliert und als Reaktion auf Ausbrüche angewendet. Wenn jedoch der Lebensraum für den jeweiligen Pilzstamm gut an die Umwelt angepasst ist, kann die Anwendung von Pilzen auch als Inokulation dienen, bei der die EPF im Boden verbleiben und Insektenausbrüche verhindern. Hier beschreiben wir die Nischenpräferenzen entomopathogener Pilze, um Informationen über den Einsatz von EPF zur Verhinderung von Schädlingsausbrüchen zu erhalten. Wir konzentrieren uns auf zwei Arten – Beauveria bassiana und Metarhizium anisopliae -, die jedoch höchstwahrscheinlich ein breiteres Spektrum von Arten und Stämmen repräsentieren, die zuvor in Gruppen zusammengefasst wurden. Daher beziehen sich die meisten zitierten Arbeiten zu diesen Pilzarten auf Beauveria bassiana und Metarhizium anisopliae sensu lato, was auf die jüngsten taxonomischen Revisionen zurückzuführen ist (z. B. Driver et al., 2000; Bidochka et al., 2001; Inglis et al, 2019).
Beauveria und Metarhizium
Entomopathogene Pilzarten, B. bassiana und M. anisopliae, kontrollieren ein breites Spektrum von Schädlingen (Kassa et al., 2004; Castrillo et al., 2010; Migiro et al., 2010; Singha et al., 2010; Skinner et al., 2012; Akmal et al., 2013; Wraight et al., 2016). Diese Pilze können auch die Blattoberfläche einer Vielzahl von Pflanzenarten und -umgebungen besiedeln (Meyling und Eilenberg, 2006a; Garrido-Jurado et al., 2015), als Saprophyten den Boden bewohnen (Evans, 1982) oder endophytisch wachsen (Greenfield et al., 2016). Die offenbar weite Verbreitung und Vielfalt der von diesen Pilzen befallenen Pathogenwirte und die Persistenz in der Umwelt, wenn die Wirte selten sind, deuten auf einen potenziellen Wert für integrierte Schädlingsbekämpfungsprogramme an verschiedenen Standorten und unter verschiedenen Bedingungen hin (Lacey et al., 2015).
Die Persistenz und Wirksamkeit von Pilzpropagulen auf Pflanzen wird direkt von Temperatur, Feuchtigkeit, Sonnenlicht und mikrobieller Aktivität auf der Phylloplane beeinflusst (Jaronski, 2010). Ein Großteil unseres Wissens stammt aus In-vitro-Studien (Fargues et al., 1997; Luz und Fargues, 1997; Fargues und Luz, 2000; Devi et al., 2005; Shin et al., 2017). Es ist jedoch unklar, ob In-vitro-Daten auf Feldbedingungen extrapoliert werden können (Keyser et al., 2017), da Umwelteinflüsse Prozesse wie das Infektionspotenzial, die Konidienpersistenz und komplexe abiotische und biotische Wechselwirkungen beeinflussen, die in Laborumgebungen selten dupliziert werden (Inglis et al., 2001; Lacey et al., 2015).
Metarhizium und Beauveria kolonisieren leicht Pflanzenrhizosphären und bilden endophytische Assoziationen (Vega et al., 2009; Behie et al., 2015). Beauveria-Arten assoziieren mit mehreren tropischen oder subtropischen Pflanzenarten, darunter Kakao (Posada und Vega, 2005), Banane (Akello et al., 2008) und Kaffee (Vega, 2008). Nach der endophytischen Besiedlung kann Metarhizium robertsii sogar von Insekten stammenden Stickstoff auf Pflanzen übertragen (Behie et al., 2012). Die Zugehörigkeit von Beauveria und Metarhizium zu pflanzlichen Wirten in der Landwirtschaft und ihre Ökosystemleistungen (d. h. nützliche Symbiose in Pflanzen und Kontrolle von Insektenpopulationen) machen sie zu vielversprechenden Kandidaten für ihre Anwendung als Biopestizide in der tropischen Landwirtschaft. Die Verwendung von EPF als Biopestizide in einer Vielzahl von Agrarökosystemen bietet interessante und nachhaltige Möglichkeiten für die Bewirtschaftung von landwirtschaftlichen Betrieben, doch ist eine gründliche Kenntnis der endemischen Pilzarten von entscheidender Bedeutung, um Szenarien und Umgebungen zu ermitteln, in denen der Insektenerreger am wirksamsten sein wird (Meyling und Eilenberg, 2007; Meyling et al, 2009; Perez-Gonzalez et al., 2014).
Leben im Boden
Der Boden kann als Reservoir für Pilzinokulate dienen (Castrillo et al., 2010), die durch Wind, Regenspritzer und Insektenaktivität oder durch Infektion von bodenbewohnenden Insekten und radiales Hyphenwachstum über den Boden verbreitet werden (Meyling und Eilenberg, 2007). Die Wirksamkeit und Persistenz von hypokrealen Pilzen wird von der Bodenart, dem Feuchtigkeitsgehalt und den mikrobiellen Interaktionen beeinflusst (Inglis et al., 2001). Während tropische Böden eine sehr hohe organische Substanz und mikrobielle Diversität aufweisen können, hängt das jeweilige landwirtschaftliche Niveau in erster Linie von den Bewirtschaftungspraktiken ab (Moeskops et al., 2010; Bai et al., 2018), und die Textur tropischer Böden variiert stark, ohne dass es klare Unterschiede zu Systemen in gemäßigten Breiten gibt (Pulla et al., 2016). Daher sind Studien aus gemäßigten Klimazonen, die die Auswirkungen der bodenphysikalischen Eigenschaften auf die Persistenz und Wirksamkeit von EPF beschreiben, wahrscheinlich direkt auf tropische Systeme übertragbar.
Böden mit einem hohen Anteil an organischen Stoffen wimmeln oft von Mikroben, die möglicherweise antagonistische Interaktionen zwischen Mikroben ermöglichen (Inglis et al., 1998; Pal und Gardener, 2006). In Studien in gemäßigten Breiten trugen antagonistische Effekte einer erhöhten mikrobiellen Aktivität im Boden zur Hemmung von B. bassiana (Studdert und Kaya, 1990; Kessler et al., 2003; Quesada-Moraga et al., 2007), B. brongniartii (Kessler et al., 2004) und M. anisopliae (Jabbour und Barbercheck, 2009) bei. So förderte beispielsweise ein hoher Feuchtigkeitsgehalt des Bodens das Auftreten antagonistischer Organismen, was darauf schließen lässt, dass die Bodenfeuchtigkeit entweder direkt oder indirekt das Überleben der Konidien verringern könnte (Lingg und Donaldson, 1981; Jabbour und Barbercheck, 2009). Dies wurde jedoch durch andere Studien in gemäßigten Regionen widerlegt, die nur einen geringen oder gar keinen Zusammenhang zwischen der Bodenfeuchtigkeit und dem Auftreten von EPF feststellten, was möglicherweise auf eine begrenzte Schwankung des Feuchtigkeitsniveaus in den Proben oder auf Sauerstoffmangel zurückzuführen ist (Griffin, 1963; Ali-Shtayeh et al., 2003; Kessler et al, 2003).
Der Sauerstoffgehalt im Boden während der Infektion kann das Myzelwachstum, die Wärmetoleranz, die Keimung und die Virulenz gegenüber Insekten fördern (Garza-López et al., 2012; Miranda-Hernández et al., 2014; Garcia-Ortiz et al., 2015; García-Ortiz et al., 2018; Oliveira und Rangel, 2018). In vitro-Studien zeigen eine positive Korrelation zwischen angereicherten Sauerstoffkonzentrationen (26 und 30 % O2) und der Konidienqualität im Vergleich zu normalen atmosphärischen Sauerstoffwerten (21 % O2) (Miranda-Hernández et al., 2014; Garcia-Ortiz et al., 2015; García-Ortiz et al., 2018). In ähnlicher Weise gilt bei Sauerstoffmangel derselbe Kontrast in Bezug auf das Konidienwachstum und die Virulenz, der unter Umgebungssauerstoffkonzentrationen abnimmt (Garza-López et al., 2012; Oliveira und Rangel, 2018). Die Keimung ist unter hypoxischen Bedingungen geringer als bei normalen atmosphärischen Werten (Garza-López et al., 2012) und nimmt zu, wenn die Sauerstoffbedingungen angereichert werden (Miranda-Hernández et al., 2014). Daher kann die Belüftung des Bodens während des Myzelwachstums die optimale Entwicklung entomopathogener Pilze und die Schädlingsbekämpfung erleichtern.
Die Bodentextur beeinflusst die Übertragung und den Verbleib von Pilzsporen. Ein höherer Tongehalt kann die Persistenz entomopathogener Pilze fördern, wahrscheinlich aufgrund einer geringeren Porengröße und/oder der Adsorption von Konidien an Ton und organischen Partikeln (Ignoffo et al., 1977; Storey und Gardner, 1988; Quesada-Moraga et al., 2007). Ein hoher Tongehalt kann jedoch auch die Fähigkeit eines potenziellen Wirts, auf einen anderen zu treffen, beeinträchtigen, da die Porosität für das Eindringen der Konidien in tiefere Bodenschichten und die potenzielle Übertragung verringert wird (Vänninen et al., 2000; Fuxa und Richter, 2004). Daher kann die mechanische Filterung der Bodenstruktur ein wichtiger Faktor für die Persistenz und Wirksamkeit entomopathogener Pilze bei der Anwendung im Boden sein (Storey und Gardner, 1988). So verbesserte sich beispielsweise die Wirksamkeit von B. bassiana gegen die Rote Feuerameise Solenopsis invicta, wenn es auf feuchtere Böden ausgebracht wurde, was die Übertragung der Konidien und die Infektionsraten förderte (Fuxa und Richter, 2004).
Nischenpräferenz
Die Habitatselektionshypothese
Biotische Interaktionen können die Persistenz von EPF in den Tropen verändern (Jaronski, 2010), insbesondere die Habitatselektionshypothese für Metarhizium-Arten legt nahe, dass dies ein wesentlicher Unterschied zwischen gemäßigten und tropischen Regionen ist (Bidochka et al., 2002). Bidochka und Small (2005) schlugen vor, dass Metarhizium-Genotypen mit Lebensraumtypen in gemäßigten und polaren Regionen assoziiert sind, während sie in (sub)tropischen Regionen eher mit bestimmten Wirtsinsekten verbunden sind. Die Autoren vermuten auch, dass M. anisopliae ursprünglich aus Südostasien stammt, heute aber eine Ansammlung kryptischer Arten umfasst, von denen viele große geografische Barrieren überwinden. Studien zu Beauveria und Metarhizium in gemäßigten Breiten haben gezeigt, dass sie die Wahl ihres Lebensraums der Assoziation mit Insektenwirten vorziehen (Meyling und Eilenberg, 2006b; Meyling et al., 2009; Ormond et al., 2010). Die Assoziationen von M. anisopliae mit Insektenwirten in höheren Breitengraden wurden auf den Lebensraum des Insekts zurückgeführt, was darauf hindeutet, dass abiotische Faktoren möglicherweise die genetische Struktur der Population beeinflussen (Bidochka et al, 2001).
Takatsuka (2007) charakterisierte Beauveria-Isolate aus Japan mit ISSR-PCR und fand keine Hinweise auf eine langfristige Koevolution zwischen dem Pilz und den Insektenwirten, was die Hypothese von Bidochka et al. (2002) stützt, dass Variationen in der Persistenz des freilebenden, saprophytischen Stadiums eines fakultativen Insektenpathogens die genetische Struktur der Population bestimmen. Im Gegensatz dazu vermuteten Bridge et al. (1997) eine Koevolution zwischen tropischen M. flavoviride var. minus-Isolaten eines einzigen Genotyps und solchen Insekten, die zur Überfamilie der Acridoidea gehören. Tropische Isolate von M. flavoviride var. minus mit Wirtspräferenzmerkmalen unterschieden sich von denen mit europäischer Herkunft. Interessanterweise ist die Mehrzahl der Isolate in den Veröffentlichungen, die die Hypothese von Bidochka und Small (2005) bezüglich der Assoziation von Metarhizium spp. mit Insektenwirtsarten unterstützen, tropischen Ursprungs (Rombach et al., 1986; St. Leger et al., 1992; Bridge et al., 1993, 1997; Leal et al., 1994; Tigano-Milani et al., 1995). Zukünftige Analysen sind jedoch erforderlich, um diese Beziehungen zu definieren.
Metarhizium-Stämme haben sich an bestimmte Umgebungen angepasst und unterstützen vielseitige Lebensstrategien (Lovett und St. Leger, 2015). Anpassungen der Umweltstressreaktionen können aus der Anpassung an abiotische (z. B. Temperatur, UV-Strahlung und Feuchtigkeit) und biotische Faktoren im Zusammenhang mit der Infektion eines Wirts (z. B. antimikrobielle und Verhaltensstressoren) resultieren (Lovett und St. Leger, 2015; Ortiz-Urquiza und Keyhani, 2015). Konidien, die unter abiotischem und biotischem Stress produziert werden, können einem breiteren Umweltspektrum standhalten und die Virulenz gegenüber Insekten verbessern (Li et al., 2015; Rangel et al., 2015). So kann beispielsweise die Überwindung des beißenden Wirtsfiebers während der Infektion zu thermotoleranteren entomopathogenen Pilzisolaten führen (Fargues et al., 1997; Blanford und Thomas, 2000; Rangel et al., 2005). Defensive Verhaltensmerkmale bei Heuschrecken können zu Unterschieden zwischen entomopathogenen Pilzarten und ihrer Wirksamkeit bei der Bekämpfung von Schädlingspopulationen bei unterschiedlichen Temperaturen führen (Inglis et al., 1999). Heuschreckennymphen, die mit B. bassiana und M. acridum infiziert waren, wiesen eine geringere Sterblichkeit auf, wenn die Temperatur erhöht wurde, und M. acridum übertraf B. bassiana bei der Nymphensterblichkeit bei höheren Temperaturen erheblich (Inglis et al., 1999).
Ausgehend von den Beweisen, die in erster Linie für Metarhizium vorgelegt wurden, stellen wir zwei allgemeine Hypothesen für EPF auf: (i) Abiotische Faktoren sind die primären Determinanten der genetischen Struktur von Populationen in höheren Breitengraden, da der Insektenerreger sich an saisonale und extreme Umweltbedingungen anpassen muss. (ii) Umgekehrt sind biotische Faktoren (Interaktionen mit anderen Arten und Pilz-Wirt-assoziierte Infektionswege) die primären Regulatoren der genetischen Struktur von EPF-Populationen in niedrigeren Breitengraden. Im Folgenden werden diese Hypothesen im Lichte der jüngsten Forschung bewertet. Um unsere Hypothesen visuell darzustellen, haben wir ein konzeptionelles Modell erstellt (Abbildung 1). Dieses soll unsere Hypothesen qualitativ beschreiben, um künftige Forschungen anzuregen, und nicht allein als mathematisches Modell dienen.
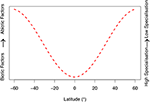
Abbildung 1. Qualitatives konzeptionelles Modell basierend auf den von uns entwickelten Hypothesen. Die Spezifität der entomopathogenen Pilzgemeinschaften ändert sich mit dem Breitengrad, entsprechend den biotischen und abiotischen Faktoren. Biotische Faktoren hängen mit den Interaktionen mit dem Wirt und anderen Mikroben zusammen (d. h. koevolutionäre Wettrüsten und Infektionswege). Zu den abiotischen Faktoren gehören Umweltvariablen wie Temperatur, Feuchtigkeit, UV-Strahlung sowie oxidative und osmotische Stressfaktoren. Der Breitengrad wurde auf 60°N und 60°S begrenzt, da die klimatischen Extreme jenseits dieser Schwellenwerte für Pilzgemeinschaften in dieser Abbildung nicht berücksichtigt sind. Wir stellen die Hypothese auf, dass entomopathogene Pilze in niedrigeren Breitengraden trotz des erhöhten Drucks durch andere Pilzarten idealere Umweltbedingungen vorfinden und eine stärkere Wirtsabwehr aufweisen (weitere Informationen finden Sie in den Abschnitten „Abiotische Bedingungen und Anpassung“ und „Biotische Interaktionen und Anpassung“ im Haupttext). Dies entspricht einer zunehmenden Spezialisierung entomopathogener Pilze.
Abiotische Bedingungen und Anpassung
Pilze, die in höheren Breitengraden beheimatet sind, erfahren aufgrund der Saisonalität eine größere Temperaturspanne (Wielgolaski und Inouye, 2003). Daher können abiotische Stressfaktoren (insbesondere die Temperatur) in höheren Breitengraden die Populationsgenetik und Anpassungsfähigkeit von EPF maßgeblich beeinflussen. In gemäßigten Regionen müssen sich EPF an ein breites Spektrum und höhere klimatische Intensitäten anpassen (Maggi et al., 2013; Wang et al., 2017), wobei abiotische Faktoren in erster Linie das Überleben des generalistischen Pathogens beeinflussen (Bidochka et al., 2001; Lennon et al., 2012). Im Gegensatz dazu stellen wir die Hypothese auf, dass biotische Faktoren in niedrigen Breitengraden, wie z. B. Artenreichtum und Pathogen-Insekten-Assoziationen, die ein koevolutionäres Wettrüsten vorantreiben, die Lebensgeschichte von EPF überwiegend beeinflussen. Phylogenetische B. bassiana clustern nach Lebensraumtyp eher in saisonal variablen hohen Breiten (Ormond et al., 2010), obwohl eine Studie keinen saisonalen Effekt in Regionen mit subtropischem Klima fand (Garrido-Jurado et al., 2015). Phylogenetisch strukturierte Untersuchungen legen nahe, dass B. bassiana die Genregulation an die Umweltbedingungen anpasst, wobei die Anpassung an den Lebensraum die Populationsdynamik bestimmt (Bidochka et al., 2002; Xiao et al., 2012). Somit könnten Unterschiede im Ausmaß der saisonalen Umweltbedingungen in verschiedenen Breitengraden zu den beobachteten zeitlichen Unterschieden in der Populationsdynamik von B. bassiana zwischen den Studien beitragen.
Umweltbedingungen in der Nähe der Überlebensgrenzen entomopathogener Pilze können die lokale Anpassung vorantreiben, wenn diese Grenzen regelmäßig erreicht werden (Doberski, 1981; Vidal et al., 1997). Die optimale Temperatur für Wachstum und Virulenz von Metarhizium- und Beauveria-Arten gegenüber Insektenwirten liegt im Allgemeinen zwischen 25 und 30 °C (Luz und Fargues, 1997; Ekesi et al., 1999; Devi et al., 2005; Bugeme et al., 2009). Aufgrund der Umwelt, in der sich die Erreger entwickelt haben (Fargues et al., 1997; Bugeme et al., 2009; Alali et al., 2019), gibt es jedoch erhebliche Unterschiede in der thermischen Präferenz einer Pilzart und ihren Auswirkungen auf potenzielle Wirte, und einzelne Stämme können sich in ihren thermischen Optima unterscheiden (Doberski, 1981; Thomas und Jenkins, 1997; Alali et al., 2019). M. acridum-Isolate, die aus einer heißen Umgebung stammen, zeigten bei höheren Temperaturen eine bessere Leistung als solche, die aus einem viel kühleren Klima stammen (Thomas und Jenkins, 1997). In ähnlicher Weise zeigten subtropische B. bassiana-Stämme, die in heißeren Gebieten Syriens gesammelt wurden, eine größere Thermotoleranz als der Ausreißer, der an einem Standort mit niedrigeren Temperaturen gesammelt wurde (Alali et al., 2019). Was die Virulenz gegenüber Insekten betrifft, so waren Isolate von B. bassiana aus gemäßigten Breiten bei niedrigen Temperaturen (2 bis 6 °C) signifikant wirksamer gegen den Ulmenborkenkäfer (Scolytus scolytus F.) als Isolate von M. anisopliae aus tropischen und subtropischen Breiten (Doberski, 1981), obwohl es unmöglich ist, die Unterschiede zwischen den Pilzarten von den Unterschieden zu trennen, die sich aus den geografischen Quellen der beiden Pilzstämme ergeben. B. bassiana und M. anisopliae sind auch empfindlich gegenüber ultravioletter Strahlung, weshalb UV-Schutzmittel in ölbasierten Feldspritzen verwendet werden (Inglis et al., 1995; Shin et al., 2017; Kumar et al., 2018). Die UV-Toleranz variiert häufig zwischen Isolaten aus verschiedenen Breitengraden (Braga et al., 2001; Fernandes et al., 2008) und Habitattypen (Bidochka et al., 2001). Isolate von B. bassiana und M. anisopliae, die sich näher am Äquator befinden, weisen eine höhere UV-Toleranz auf, während kälteangepasste Populationen aus höheren Breitengraden im Allgemeinen optimale Bedingungen bei kälteren Temperaturen vorfinden (Fernandes et al., 2008). In Kanada sind Metarhizium-Isolate, die in bewaldeten Lebensräumen vorkommen, weniger tolerant gegenüber UV-Strahlung und kälteaktiver als in landwirtschaftlich genutzten Gebieten (Bidochka et al., 2001). Somit ist die abiotische Selektion in hohen Breitengraden (z. B., UV-Exposition in einem bestimmten Habitattyp) für bestimmte genetische Gruppen von Pilz-Entomopathogenen ihre Wirksamkeit in der Landwirtschaft beeinflussen, insbesondere wenn die Isolate aus bewaldeten oder heckenartigen Habitaten stammen.
Biotische Interaktionen und Anpassung
Tropische Wälder beherbergen eine hohe entomopathogene Mykotaxa-Vielfalt, in denen die Teleomorphen (Sexualstadien) von hypokrealen Pilzen am häufigsten vorkommen und in ihrem Wirtsspektrum oft spezialisierter sind als asexuelle Morphotypen (Evans, 1982; Vega et al., 2012; Hu et al., 2014). Im Gegensatz dazu bewohnen sich asexuell entwickelnde EPF (Anamorphe) sowohl tropische als auch gemäßigte Klimazonen (Vega et al., 2012). Laborstudien in Modellsystemen, die die Biodiversität erhöhten, beobachteten eine entsprechende Intensivierung des evolutionären Wettrüstens zwischen Wirten und Parasiten (Betts et al., 2018). Auch die genetische Vielfalt und Wirtsspezifität einiger Pilzarten legt nahe, dass Wirtsinsekten durch eine Kaskade von Abwehr- und Gegenwehrmechanismen einen starken Selektionsdruck auf Pathogene ausüben können (Maurer et al., 1997; Evans et al., 2011; Mukherjee und Vilcinskas, 2018). Metarhizium hat sich beispielsweise häufig von spezialisierten zu generalistischen Insektenpathogenen entwickelt; eine Ausweitung des Wirtsspektrums, die mit der Besiedlung eines größeren Breitengrades durch den Pilz zusammenfällt (Bidochka und Small, 2005; Hu et al., 2014). In Regenwaldgebieten mit hoher Artendichte kann die hohe tropische Pilzvielfalt jedoch einem stärkeren Druck durch Wirte und Konkurrenten ausgesetzt sein, was das Auftreten von Pathogenen wie der teleomorphen Gattung Cordyceps (Evans, 1982; Sung et al., 2007; Aung et al., 2008) und spezialisierten Pilz-Entomopathogenen der Gattung Ophiocordyceps (Aung et al., 2008; Evans et al., 2011; Araújo et al., 2015) begünstigen kann. Phylogenomische Analysen legen nahe, dass Beauveria spp. das asexuelle Lebensstadium der Cordyceps-Linie ist (Xiao et al., 2012). Obwohl Beauveria direkte genetische Verbindungen zu Cordyceps aufweist, sind die generalistischen Beauveria und Metarhizium in den Lebensräumen des tropischen Regenwaldes weniger verbreitet und werden häufiger in der Landwirtschaft angetroffen (Rehner, 2005; Aung et al., 2008). Der Unterschied in der Lebensweise zwischen diesen Spezialisten und Generalisten könnte auf den Verlust der durch Wiederholung induzierten Punktmutationen in B. bassiana und Metarhizium spp. zurückgeführt werden (was darauf schließen lässt, dass der Sexualzyklus bei beiden Pilzen selten ist), was bei diesen Pilzpathogenen eine Voraussetzung für die Ausbreitung von Genfamilien war (Xiao et al., 2012; Lovett und St. Leger, 2017).
Angesichts des wahrscheinlichen südostasiatischen Ursprungs von Metarhizium (dem Kontinent mit der höchsten genotypischen Diversität) (Bidochka und Small, 2005; Lovett und St. Leger, 2017) und der anschließenden evolutionären Veränderungen in der Spezifität (Hu et al., 2014), könnte eine geografische Ausdehnung auf gemäßigte Regionen mit einem generalistischeren Wirtsspektrum einhergegangen sein. Wir stellen die Hypothese auf, dass dies zum Teil auf den geringeren Reichtum an Wirtsarten in gemäßigten Regionen zurückzuführen sein könnte (Thompson et al., 2017) und auf die Notwendigkeit, sich an eine größere Variation der klimatischen Bedingungen anzupassen, indem die Anpassung auf abiotische Bedingungen konzentriert wird. Eine offene Frage ist, wie die größere potenzielle Wirtsvielfalt in tropischen Umgebungen diesen Selektionsdruck verändert. Zukünftige Forschungen darüber, wie das Wettrüsten zwischen Insekten und Erregern die Zusammensetzung der Gemeinschaft bei Veränderungen des Breitengrades verändert, würden das Management von Entomopathogenen in verschiedenen Breitengraden verbessern. Darüber hinaus werden empirische Auswertungen von Pilzen, die in verschiedenen Breitengraden gesammelt wurden, und Laborexperimente unser Wissen über endemische Pilzarten und ihre Bedeutung innerhalb eines bestimmten Systems sowie ihre angemessene Verwendung in Biokontrollsystemen verbessern.
Verbesserung der Persistenz von Pilzen und Prävention von Insektenausbrüchen
Die Fähigkeit einiger Pilzarten, große geografische Barrieren zu überwinden (d.h., Die Fähigkeit einiger Pilzarten, große geografische Barrieren zu überwinden (d. h. sie sind kosmopolitisch), bedeutet nicht, dass die Anwendung von Pilzpathogenen als landwirtschaftliches Biopestizid die Persistenz von Pilzen gewährleistet. Vielmehr muss die Eignung eines pilzlichen Krankheitserregers für die Zielumgebung erforscht werden, einschließlich der interaktiven Auswirkungen einzelner biotischer/abiotischer Faktoren. Die Bemühungen sollten sich auf endemische Pilzgemeinschaften konzentrieren und innerhalb ihres abgeleiteten Systems angewendet werden. Regionale Unterschiede zwischen dem geeigneten Pilzanwendungstyp, dem Wirtsspektrum (d.h. Generalist vs. Spezialist) und den dominierenden Umweltfaktoren (biotisch/abiotisch) auf die Leistung des Erregers können den langfristigen Erfolg der entomopathogenen Biokontrolle besser vorhersagen und dazu beitragen, Insektenausbrüche zu verhindern.
Autorenbeiträge
AM schrieb den ersten Entwurf. AM und TN trugen wesentlich zu den nachfolgenden Entwürfen bei.
Finanzierung
AM wurde durch einen Zuschuss von AusIndustry Innovations Connections an TN unterstützt.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Akello, J., Dubois, T., Coyne, D., und Kyamanywa, S. (2008). Wirkung der endophytischen Beauveria bassiana auf die Populationen des Bananenrüsslers, Cosmopolites sordidus, und deren Schäden in gezüchteten Bananenpflanzen. Entomol. Exp. Appl. 129, 157-165. doi: 10.1111/j.1570-7458.2008.00759.x
CrossRef Full Text | Google Scholar
Akmal, M., Freed, S., Malik, M. N., and Gul, H. T. (2013). Wirksamkeit von Beauveria bassiana (Deuteromycotina: Hypomycetes) gegen verschiedene Blattlausarten unter Laborbedingungen. Pak. J. Zool. 45, 71-78.
Google Scholar
Alali, S., Mereghetti, V., Faoro, F., Bocchi, S., Al Azmeh, F., and Montagna, M. (2019). Thermotolerante Isolate von Beauveria bassiana als potenzielles Mittel zur Bekämpfung von Schadinsekten in subtropischen Klimazonen. PLoS ONE 14:e0211457. doi: 10.1371/journal.pone.0211457
PubMed Abstract | CrossRef Full Text | Google Scholar
Ali-Shtayeh, M. S., Mara’i, A.-B. B. M., und Jamous, R. M. (2003). Verteilung, Vorkommen und Charakterisierung entomopathogener Pilze in landwirtschaftlichen Böden im palästinensischen Gebiet. Mycopathologia 156, 235-244. doi: 10.1023/A:1023339103522
PubMed Abstract | CrossRef Full Text | Google Scholar
Araújo, J. P. M., Evans, H. C., Geiser, D. M., Mackay, W. P., and Hughes, D. P. (2015). Entschlüsselung der Vielfalt hinter dem Ophiocordyceps unilateralis-Komplex: drei neue Arten von Zombie-Ameisenpilzen aus dem brasilianischen Amazonasgebiet. Zootaxa 22, 224-238. doi: 10.11646/phytotaxa.220.3.2
CrossRef Full Text | Google Scholar
Aung, O. M., Soytong, K., and Hyde, K. (2008). Diversität entomopathogener Pilze in den Regenwäldern der Provinz Chiang Mai, Thailand. Fungal Divers. 30, 15-22.
Google Scholar
Bai, Z., Caspari, T., Gonzalez, M. R., Batjes, N. H., Mäder, P., Bünemann, E. K., et al. (2018). Auswirkungen landwirtschaftlicher Bewirtschaftungspraktiken auf die Bodenqualität: eine Übersicht über Langzeitexperimente für Europa und China. Agric. Ecosyst. Environ. 265, 1-7. doi: 10.1016/j.agee.2018.05.028
CrossRef Full Text | Google Scholar
Behie, S. W., Jones, S. J., and Bidochka, M. J. (2015). Plant tissue localization of the endophytic insect pathogenic fungi Metarhizium and Beauveria. Fungal Ecol. 13, 112-119. doi: 10.1016/j.funeco.2014.08.001
CrossRef Full Text | Google Scholar
Behie, S. W., Zelisko, P., and Bidochka, M. J. (2012). Endophytische insektenparasitische Pilze verlagern Stickstoff direkt von Insekten auf Pflanzen. Science 336, 1576-1577. doi: 10.1126/science.1222289
PubMed Abstract |Ref Full Text | Google Scholar
Betts, A., Gray, C., Zelek, M., MacLean, R. C., and King, K. C. (2018). Hohe Parasitenvielfalt beschleunigt Wirtsanpassung und Diversifizierung. Science 360, 907-911. doi: 10.1126/science.aam9974
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., Kamp, A. M., Lavender, T. M., Dekoning, J., and De Croos, J. N. (2001). Habitatassoziation in zwei genetischen Gruppen des insektenpathogenen Pilzes Metarhizium anisopliae: Aufdeckung kryptischer Arten? Appl. Environ. Microbiol. 67, 1335-1342. doi: 10.1128/AEM.67.3.1335-1342.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., Menzies, F. V., and Kamp, A. M. (2002). Genetische Gruppen des insektenpathogenen Pilzes Beauveria bassiana sind mit Habitat- und thermischen Wachstumsvorlieben verbunden. Arch. Microbiol. 178, 531-537. doi: 10.1007/s00203-002-0490-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., and Small, C. L. (2005). „Phylogeography of Metarhizium, an insect pathogenic fungus,“ in Insect-Fungal Associations: Ecology and Evolution, eds F. E. Vega and M. Blackwell (New York, NY: Oxford University Press), 75-118.
Google Scholar
Blanford, S., and Thomas, M. B. (2000). Thermisches Verhalten von zwei Stechmückenarten: Auswirkungen von Lebensraum und Jahreszeit auf die Körpertemperatur und die möglichen Auswirkungen auf die Biokontrolle mit Krankheitserregern. Environ. Entomol. 29, 1060-1069. doi: 10.1603/0046-225X-29.5.1060
CrossRef Full Text | Google Scholar
Braga, G., Flint, S., Miller, C., Anderson, A., and Roberts, D. (2001). Variabilität in der Reaktion auf UV-B zwischen Arten und Stämmen von Metarhizium, isoliert von Standorten in Breitengraden von 61°N bis 54°S. J. Invertebr. Pathol. 78, 98-108. doi: 10.1006/jipa.2001.5048
PubMed Abstract | CrossRef Full Text | Google Scholar
Bridge, P. D., Prior, C., Sagbohan, J., Lomer, C. J., Carey, M., and Buddie, A. (1997). Molekulare Charakterisierung von Metarhizium-Isolaten aus Heuschrecken und Grashüpfern. Biodivers. Conserv. 6, 177-189. doi: 10.1023/A:1018387918686
CrossRef Full Text | Google Scholar
Bridge, P. D., Williams, M. A. J., Prior, C., and Paterson, R. R. M. (1993). Morphologische, biochemische und molekulare Merkmale von Metarhizium anisopliae und M. flavoviride. J. Gen. Microbiol 139, 1163-1169. doi: 10.1099/00221287-139-6-1163
CrossRef Full Text | Google Scholar
Bugeme, D. M., Knapp, M., Boga, H. I., Wanjoya, A. K., und Maniania, N. K. (2009). Einfluss der Temperatur auf die Virulenz von Pilzisolaten von Metarhizium anisopliae und Beauveria bassiana gegenüber der zweifleckigen Spinnmilbe Tetranychus urticae. Mycopathologia 167, 221-227. doi: 10.1007/s11046-008-9164-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Castrillo, L. A., Bauer, L. S., Liu, H., Griggs, M. H., and Vandenberg, J. D. (2010). Charakterisierung von Beauveria bassiana (Ascomycota: Hypocreales) Isolaten in Verbindung mit Agrilus planipennis (Coleoptera: Buprestidae) Populationen in Michigan. Biol. Control 54, 135-140. doi: 10.1016/j.biocontrol.2010.04.005
CrossRef Full Text | Google Scholar
Devi, K. U., Sridevi, V., Mohan, C. M., and Padmavathi, J. (2005). Wirkung von hoher Temperatur und Wasserstress auf die In-vitro-Keimung und das Wachstum von Isolaten des entomopathogenen Pilzes Beauveria bassiana (Bals.) Vuillemin. J. Invertebr. Pathol. 88, 181-189. doi: 10.1016/j.jip.2005.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Doberski, J. W. (1981). Vergleichende Laboruntersuchungen an drei pilzlichen Pathogenen des Ulmenborkenkäfers Scolytus scolytus: Wirkung von Temperatur und Luftfeuchtigkeit auf die Infektion durch Beauveria bassiana, Metarhizium anisopliae und Paecilomyces farinosus. J. Invertebr. Pathol. 37, 195-200. doi: 10.1016/0022-2011(81)90075-6
CrossRef Full Text | Google Scholar
Driver, F., Milner, R. J., and Trueman, J. W. H. (2000). Eine taxonomische Revision von Metarhizium basierend auf einer phylogenetischen Analyse von rDNA-Sequenzdaten. Mycol. Res. 104, 134-150. doi: 10.1017/S0953756299001756
CrossRef Full Text | Google Scholar
Ekesi, S., Maniania, N. K., and Ampong-Nyarko, K. (1999). Wirkung der Temperatur auf die Keimung, das radiale Wachstum und die Virulenz von Metarhizium anisopliae und Beauveria bassiana auf Megalurothrips sjostedti. Biocontrol Sci. Technol. 9, 177-185. doi: 10.1080/09583159929767
CrossRef Full Text | Google Scholar
Evans, H. C. (1982). Entomogene Pilze in tropischen Waldökosystemen: eine Bestandsaufnahme. Ecol. Entomol. 7, 47-60. doi: 10.1111/j.1365-2311.1982.tb00643.x
CrossRef Full Text | Google Scholar
Evans, H. C., Elliot, S. L., and Hughes, D. P. (2011). Verborgene Vielfalt hinter dem Zombie-Ameisenpilz Ophiocordyceps unilateralis: Four new species described from carpenter ants in Minas Gerais, Brazil. PLoS ONE 6:e17024. doi: 10.1371/journal.pone.0017024
PubMed Abstract | CrossRef Full Text | Google Scholar
Fargues, J., Goettel, M. S., Smits, N., Ouedraogo, A., and Rougier, M. (1997). Wirkung der Temperatur auf das vegetative Wachstum von Beauveria bassiana-Isolaten unterschiedlicher Herkunft. Mycologia 89, 383-892. doi: 10.1080/00275514.1997.12026797
CrossRef Full Text | Google Scholar
Fargues, J., and Luz, C. (2000). Auswirkungen schwankender Feuchtigkeits- und Temperaturregime auf das Infektionspotenzial von Beauveria bassiana für Rhodnius prolixus. J. Invertebr. Pathol. 75, 202-211. doi: 10.1006/jipa.1999.4923
PubMed Abstract | CrossRef Full Text | Google Scholar
Faria, M. R. D., and Wraight, S. P. (2007). Mykoinsektizide und Mykoakarizide: eine umfassende Liste mit weltweiter Abdeckung und internationaler Klassifizierung der Formulierungstypen. Biol. Control 43, 237-256. doi: 10.1016/j.biocontrol.2007.08.001
CrossRef Full Text | Google Scholar
Fernandes, E. K., Rangel, D. E. N., Moraes, Á. M. L., Bittencourt, V. R. E. P., and Roberts, D. W. (2008). Kälteaktivität von Beauveria und Metarhizium, und Thermotoleranz von Beauveria. J. Invertebr. Pathol. 98, 69-78. doi: 10.1016/j.jip.2007.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuxa, J. R., and Richter, A. R. (2004). Auswirkungen der Bodenfeuchtigkeit und -zusammensetzung sowie des Pilzisolats auf die Prävalenz von Beauveria bassiana in Laborkolonien der roten importierten Feuerameise (Hymenoptera: Formicidae). Environ. Entomol. 33, 975-981. doi: 10.1603/0046-225X-33.4.975
CrossRef Full Text | Google Scholar
García-Ortiz, N., Figueroa-Martínez, F. J., Carrasco-Navarro, U., Favela-Torres, E., and Loera, O. (2018). Die Sauerstoffkonzentration in Kulturen moduliert die Proteinexpression und enzymatische antioxidative Reaktionen in Metarhizium lepidiotae Konidien. Fungal Biol. 122, 487-496. doi: 10.1016/j.funbio.2017.10.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Garcia-Ortiz, N., Tlecuitl-Beristain, S., Favela-Torres, E., and Loera, O. (2015). Production and quality of conidia by Metarhizium anisopliae var. lepidiotum: critical oxygen level and period of mycelium competence. Appl. Microbiol. Biotechnol. 99, 2783-2791. doi: 10.1007/s00253-014-6225-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Garrido-Jurado, I., Fernandez-Bravo, M., Campos, C., and Quesada-Moraga, E. (2015). Diversity of entomopathogenic Hypocreales in soil and phylloplanes of five Mediterranean cropping systems. J. Invertebr. Pathol. 130, 97-106. doi: 10.1016/j.jip.2015.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Garza-López, P. M., Konigsberg, M., Gómez-Quiroz, L. E., and Loera, O. (2012). Physiologische und antioxidative Reaktion von Beauveria bassiana Bals (Vuill.) auf unterschiedliche Sauerstoffkonzentrationen. World J. Microbiol. Biotechnol. 28, 353-359. doi: 10.1007/s11274-011-0827-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Greenfield, M., Gomez-Jimenez, M. I., Ortiz, V., Vega, F. E., Kramer, M., and Parsa, S. (2016). Beauveria bassiana und Metarhizium anisopliae kolonisieren endophytisch Maniokwurzeln nach einer Inokulation mit Bodenwasser. Biol. Control 95, 40-48. doi: 10.1016/j.biocontrol.2016.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Griffin, D. M. (1963). Bodenfeuchtigkeit und die Ökologie von Bodenpilzen. Biol. Rev. 38, 141-166. doi: 10.1111/j.1469-185X.1963.tb00781.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Hu, X., Xiao, G., Zheng, P., Shang, Y., Su, Y., Zhang, X., et al. (2014). Trajektorie und genomische Determinanten der Pilz-Pathogen-Speziation und Wirtsanpassung. Proc. Natl. Acad. Sci. U.S.A. 111, 16796-16801. doi: 10.1073/pnas.1412662111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ignoffo, C. M., Garcia, C., Hostetter, D. L., and Pinnell, R. E. (1977). Vertikale Bewegung von Konidien von Nomuraea rileyi durch Sand- und Lehmböden. J. Econ. Entomol. 70, 163-164. doi: 10.1093/jee/70.2.163
CrossRef Full Text | Google Scholar
Inglis, G., Goettel, M. S., Butt, T., and Strasser, H. (2001). „Use of hyphomycetous fungi for managing insect pests“, in Fungi as Biocontrol Agents: Progress, Problems and Potential, eds T. M. Butt, C. Jackson, and N. Magan (Oxfordshire: CABI Publishing), 23-69. doi: 10.1079/9780851993560.0023
CrossRef Full Text | Google Scholar
Inglis, G. D., Duke, G. M., Goettel, M. S., Kabaluk, J. T., and Ortega-Polo, R. (2019). Biogeographie und genotypische Diversität von Metarhizium brunneum und Metarhizium robertsii in nordwestlichen nordamerikanischen Böden. Can. J. Microbiol. 65, 261-281. doi: 10.1139/cjm-2018-0297
PubMed Abstract | CrossRef Full Text | Google Scholar
Inglis, G. D., Duke, G. M., Kawchuk, L. M., and Goettel, M. S. (1999). Einfluss oszillierender Temperaturen auf die kompetitive Infektion und Besiedlung der Wanderheuschrecke durch Beauveria bassiana und Metarhizium flavoviride. Biol. control 14, 111-120. doi: 10.1006/bcon.1998.0666
CrossRef Full Text | Google Scholar
Inglis, G. D., Goettel, M. S., and Johnson, D. L. (1995). Einfluss von ultravioletten Lichtschutzmitteln auf die Persistenz des entomopathogenen Pilzes Beauveria bassiana. Biol. Control 5, 581-590. doi: 10.1006/bcon.1995.1069
CrossRef Full Text | Google Scholar
Inglis, G. D., Johnson, D. L., Kawchuk, L. M., and Goettel, M. S. (1998). Auswirkung von Bodentextur und Bodensterilisation auf die Anfälligkeit von eierlegenden Heuschrecken gegenüber Beauveria bassiana. J. Invertebr. 71, 73-81. doi: 10.1006/jipa.1997.4698
PubMed Abstract | CrossRef Full Text | Google Scholar
Jabbour, R., and Barbercheck, M. E. (2009). Auswirkungen der Bodenbewirtschaftung auf entomopathogene Pilze beim Übergang zum ökologischen Landbau in einer Futtergetreidefruchtfolge. Biol. Control 51, 435-443. doi: 10.1016/j.biocontrol.2009.08.004
CrossRef Full Text | Google Scholar
Jaronski, S. T. (2010). Ökologische Faktoren bei der inundativen Anwendung von pilzlichen Entomopathogenen. Biocontrol 55, 159-185. doi: 10.1007/s10526-009-9248-3
CrossRef Full Text | Google Scholar
Kassa, A., Stephan, D., Vidal, S., and Zimmermann, G. (2004). Labor- und Feldbewertung verschiedener Formulierungen von Metarhizium anisopliae var. acridum submerser Sporen und aerialer Konidien für die Bekämpfung von Heuschrecken und Grashüpfern. Biocontrol 49, 63-81. doi: 10.1023/B:BICO.0000009384.46858.aa
CrossRef Full Text | Google Scholar
Kessler, P., Enkerl, J., Schweize, C., and Keller, S. (2004). Survival of Beauveria brongniartii in the soil after application as a biocontrol agent against the European cockchafer Melolontha melolontha. Biocontrol 49, 563-581. doi: 10.1023/B:BICO.0000036441.40227.ed
CrossRef Full Text | Google Scholar
Kessler, P., Matzke, H., and Keller, S. (2003). Der Einfluss von Ausbringungszeitpunkt und Bodenfaktoren auf das Vorkommen von Beauveria brongniartii, das als biologisches Bekämpfungsmittel im Boden ausgebracht wird. J. Invertebr. Pathol. 84, 15-23. doi: 10.1016/j.jip.2003.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Keyser, C. A., Fernandes, É. K. K., Rangel, D. E. N., Foster, R. N., Jech, L. E., Reuter, K. C., et al. (2017). Laboratory bioassays and field-cage trials of Metarhizium spp. isolates with field-collected Mormon crickets (Anabrus simplex). Biocontrol 62, 257-268. doi: 10.1007/s10526-016-9782-8
CrossRef Full Text | Google Scholar
Kumar, K. K., Sridhar, J., Murali-Baskaran, R. K., Senthil-Nathan, S., Kaushal, P., Dara, S. K., et al. (2018). Mikrobielle Biopestizide für die Schädlingsbekämpfung in Indien: aktueller Stand und Zukunftsaussichten. J. Invertebr. Pathol. 165, 74-81. doi: 10.1016/j.jip.2018.10.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lacey, L. A., Grzywacz, D., Shapiro-Ilan, D. I., Frutos, R., Brownbridge, M., and Goettel, M. S. (2015). Insektenpathogene als biologische Bekämpfungsmittel: zurück in die Zukunft. J. Invertebr. Pathol. 132, 1-41. doi: 10.1016/j.jip.2015.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Leal, S. C. M., Bertioli, T. M., Butt, T. M., and Peberdy, J. F. (1994). Charakterisierung von Isolaten des entomopathogenen Pilzes Metarhizium anisopliae durch RAPD-PCR. Mycol. Res. 98, 1077-1081. doi: 10.1016/S0953-7562(09)80436-X
CrossRef Full Text | Google Scholar
Lennon, J. T., Aanderud, Z. T., Lehmkuhl, B. K., and Schoolmaster, D. R. Jr. (2012). Kartierung des Nischenraums von Bodenmikroorganismen mithilfe von Taxonomie und Merkmalen. Ecology 93, 1867-1879. doi: 10.1890/11-1745.1
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, F., Shi, H.-Q., Ying, S.-H., and Feng, M.-G. (2015). Distinct contributions of one Fe- and two Cu/Zn-cofactored superoxide dismutases to antioxidation, UV tolerance and virulence of Beauveria bassiana. Fungal Genet. Biol. 81, 160-171. doi: 10.1016/j.fgb.2014.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Z. B., Alves, S., Roberts, D., Fan, M., Delalibera, I., Tang, J., et al. (2010). Biologische Schädlingsbekämpfung in Brasilien und China: Geschichte, aktuelle Programme und Gründe für ihre Erfolge mit entomopathogenen Pilzen. Biocontrol Sci. Technol. 20, 117-136. doi: 10.1080/09583150903431665
CrossRef Full Text | Google Scholar
Lingg, A. J., and Donaldson, M. D. (1981). Biotische und abiotische Faktoren, die die Stabilität der Konidien von Beauveria bassiana im Boden beeinflussen. J. Invertebr. Pathol. 38, 191-200. doi: 10.1016/0022-2011(81)90122-1
CrossRef Full Text | Google Scholar
Lovett, B., and St. Leger, R. J. (2015). Stress ist bei Metarhizium eher die Regel als die Ausnahme. Curr. Genet. 61, 253-261. doi: 10.1007/s00294-014-0447-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett, B., and St. Leger, R. J. (2017). The insect pathogens. Microbiol. Spectr. 5, 1-19. doi: 10.1128/microbiolspec.FUNK-0001-2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Luz, C., and Fargues, J. (1997). Temperatur- und Feuchtigkeitsanforderungen für die Keimung von Konidien eines Isolats von Beauveria bassiana, pathogen für Rhodnius prolixus. Mycopathologia 138, 117-125. doi: 10.1023/A:1006803812504
PubMed Abstract | CrossRef Full Text | Google Scholar
Maggi, O., Tosi, S., Angelova, M., Lagostina, E., Fabbri, A. A., Pecoraro, L., et al. (2013). Adaptation von Pilzen, einschließlich Hefen, an kalte Umgebungen. Plant Biosyst. 147, 247-258. doi: 10.1080/11263504.2012.753135
CrossRef Full Text | Google Scholar
Mahe, F., de Vargas, C., Bass, D., Czech, L., Stamatakis, A., Lara, E., et al. (2017). Parasiten dominieren hyperdiverse Bodenprotistengemeinschaften in neotropischen Regenwäldern. Nat. Ecol. Evol. 1:0091. doi: 10.1038/s41559-017-0091
PubMed Abstract | CrossRef Full Text | Google Scholar
Mascarin, G. M., Lopes, R. B., Delalibera, I., Fernandes, E. K. K., Luz, C., and Faria, M. (2019). Aktueller Stand und Perspektiven von pilzlichen Entomopathogenen, die zur mikrobiellen Bekämpfung von Arthropoden-Schädlingen in Brasilien eingesetzt werden. J. Invertebr. Pathol. 165, 46-53. doi: 10.1016/j.jip.2018.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Maurer, P., Couteaudier, Y., Girard, P. A., Bridge, P. D., and Riba, G. (1997). Genetische Diversität von Beauveria bassiana und Verwandtschaft mit dem Wirtsinsektenbereich. Mycol. Res. 101, 159-164. doi: 10.1017/S0953756296002213
CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2006a). Isolierung und Charakterisierung von Beauveria bassiana-Isolaten aus Phylloplanen der Heckenvegetation. Mycol. Res. 110, 188-195. doi: 10.1016/j.mycres.2005.09.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2006b). Vorkommen und Verteilung von bodenbürtigen entomopathogenen Pilzen in einem einzigen ökologischen Agrarökosystem. Agric. Ecosyst. Environ. 113, 336-341. doi: 10.1016/j.agee.2005.10.011
CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2007). Ökologie der entomopathogenen Pilze Beauveria bassiana und Metarhizium anisopliae in Agrarökosystemen der gemäßigten Breiten: Potenzial für die biologische Schädlingsbekämpfung. Biol. Control 43, 145-155. doi: 10.1016/j.biocontrol.2007.07.007
CrossRef Full Text | Google Scholar
Meyling, N. V., Lubeck, M., Buckley, E. P., Eilenberg, J., and Rehner, S. A. (2009). Gemeinschaftszusammensetzung, Wirtsspektrum und genetische Struktur des pilzlichen Entomopathogens Beauveria in angrenzenden landwirtschaftlichen und halbnatürlichen Lebensräumen. Mol. Ecol. 18, 1282-1293. doi: 10.1111/j.1365-294X.2009.04095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Migiro, L. N., Maniania, N. K., Chabi-Olaye, A., and Vandenberg, J. (2010). Pathogenität von Isolaten der entomopathogenen Pilze Metarhizium anisopliae und Beauveria bassiana (Hypocreales: Clavicipitaceae) für die adulte Erbsenminiermotte (Diptera: Agromyzidae) und Aussichten für ein Autoinokulationsgerät für die Infektion auf dem Feld. Environ. Entomol. 39, 468-475. doi: 10.1603/EN09359
PubMed Abstract | CrossRef Full Text | Google Scholar
Miranda-Hernández, F., Saucedo-Castañeda, G., Alatorre-Rosas, R., and Loera, O. (2014). Sauerstoffreiche Kulturbedingungen verbessern die Konidieninfektiosität und die Qualität von zwei Stämmen von Isaria fumosorosea für potenziell verbesserte Biokontrollverfahren. Pest Manage. Sci. 70, 661-666. doi: 10.1002/ps.3605
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeskops, B., Sukristiyonubowo Buchan, D., Sleutel, S., Herawaty, L., Husen, E., et al. (2010). Mikrobielle Gemeinschaften und Aktivitäten im Boden bei intensivem ökologischem und konventionellem Gemüseanbau in West Java, Indonesien. Appl. Soil Ecol. 45, 112-120. doi: 10.1016/j.apsoil.2010.03.005
CrossRef Full Text | Google Scholar
Mukherjee, K., and Vilcinskas, A. (2018). Der entomopathogene Pilz Metarhizium robertsii kommuniziert während der Infektion mit dem Insektenwirt Galleria mellonella. Virulence 9, 402-413. doi: 10.1080/21505594.2017.1405190
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira, A. S., and Rangel, D. E. N. (2018). Transient anoxia during Metarhizium robertsii growth increases conidial virulence to Tenebrio molitor. J. Invertebr. Pathol. 153, 130-133. doi: 10.1016/j.jip.2018.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Ormond, E. L., Thomas, A. P., Pugh, P. J., Pell, J. K., and Roy, H. E. (2010). Ein Pilzerreger in Zeit und Raum: Die Populationsdynamik von Beauveria bassiana in einem Nadelwald. FEMS Microbiol. Ecol. 74, 146-154. doi: 10.1111/j.1574-6941.2010.00939.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ortiz-Urquiza, A., and Keyhani, N. O. (2015). Stressantwortsignalisierung und Virulenz: Erkenntnisse aus entomopathogenen Pilzen. Curr. Genet. 61, 239-249. doi: 10.1007/s00294-014-0439-9
CrossRef Full Text | Google Scholar
Pal, K. K., and Gardener, M. B. (2006). Biological control of plant pathogens. Plant Health Instr. doi: 10.1094/PHI-A-2006-1117-02Available online at: http://www.apsnet.org/edcenter/advanced/topics/Pages/BiologicalControl.aspx
CrossRef Full Text | Google Scholar
Perez-Gonzalez, V. H., Guzman-Franco, A. W., Alatorre-Rosas, R., Hernandez-Lopez, J., Hernandez-Lopez, A., Carrillo-Benitez, M. G., et al. (2014). Spezifische Diversität der entomopathogenen Pilze Beauveria und Metarhizium in mexikanischen Agrarböden. J. Invertebr. Pathol. 119, 54-61. doi: 10.1016/j.jip.2014.04.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Posada, F., and Vega, F. E. (2005). Etablierung des pilzlichen Entomopathogens Beauveria bassiana (Ascomycota: Hypocreales) als Endophyt in Kakaosetzlingen (Theobroma cacao). Mycologia 97, 1195-1200. doi: 10.1080/15572536.2006.11832729
PubMed Abstract | CrossRef Full Text | Google Scholar
Pulla, S., Riotte, J., Suresh, H. S., Dattaraja, H. S., und Sukumar, R. (2016). Controls of soil spatial variability in a dry tropical forest. PLoS ONE 11:e0153212. doi: 10.1371/journal.pone.0153212
PubMed Abstract | CrossRef Full Text | Google Scholar
Quesada-Moraga, E., Navas-Cortes, J. A., Maranhao, E. A., Ortiz-Urquiza, A., and Santiago-Alvarez, C. (2007). Faktoren, die das Vorkommen und die Verteilung entomopathogener Pilze in natürlichen und kultivierten Böden beeinflussen. Mycol. Res. 111(Pt 8), 947-966. doi: 10.1016/j.mycres.2007.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Rangel, D. E. N., Braga, G. U. L., Anderson, A. J., and Roberts, D. W. (2005). Variabilität in der konidialen Thermotoleranz von Metarhizium anisopliae-Isolaten unterschiedlicher geographischer Herkunft. J. Invertebr. Pathol. 88, 116-125. doi: 10.1016/j.jip.2004.11.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rangel, D. E. N., Braga, G. U. L., Fernandes, É. K. K., Keyser, C. A., Hallsworth, J. E., and Roberts, D. W. (2015). Stresstoleranz und Virulenz von insektenpathogenen Pilzen werden durch die Umweltbedingungen während der Konidienbildung bestimmt. Curr. Genet. 61, 383-404. doi: 10.1007/s00294-015-0477-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehner, S., and Buckley, E. (2005). A Beauveria phylogeny inferred from nuclear ITS and EF1-alpha sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia 97, 84-98. doi: 10.3852/mycologia.97.1.84
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehner, S. A. (2005). „Phylogenetics of the insect pathogenic genus Beauveria“, in Insect-Fungal Associations: Ecology and Evolution, eds F. E. Vega and M. Blackwell (New York, NY: Oxford University Press), 3-27.
Google Scholar
Rombach, M. C., Humber, R. A., and Roberts, D. W. (1986). Metarhizium flavoviride var. minus, var. nov., ein Erreger von Pflanzen- und Blatthüpfer auf Reis auf den Philippinen und Salomonen. Mycotaxon 27, 87-92.
Google Scholar
Shin, T. Y., Bae, S. M., Kim, D. J., Yun, H. G., and Woo, S. D. (2017). Evaluation of virulence, tolerance to environmental factors and antimicrobial activities of entomopathogenic fungi against two-spotted spider mite, Tetranychus urticae. Mycoscience 58, 204-212. doi: 10.1016/j.myc.2017.02.002
CrossRef Full Text | Google Scholar
Singha, D., Singha, B., and Dutta, B. K. (2010). Potential of Metarhizium anisopliae and Beauveria bassiana in the control of tea termite Microtermes obesi Holmgren in vitro and under field conditions. J. Pest. Sci. 84, 69-75. doi: 10.1007/s10340-010-0328-z
CrossRef Full Text | Google Scholar
Skinner, M., Gouli, S., Frank, C. E., Parker, B. L., and Kim, J. S. (2012). Management von Frankliniella occidentalis (Thysanoptera: Thripidae) mit Granulatformulierungen entomopathogener Pilze. Biol. Control 63, 246-252. doi: 10.1016/j.biocontrol.2012.08.004
CrossRef Full Text | Google Scholar
St. Leger, R. J., May, B., Allee, L. L., Frank, D. C., Staples, R. C., and Robers, D. W. (1992). Genetische Unterschiede bei Allozymen und bei der Bildung von Infektionsstrukturen zwischen Isolaten des entomopathogenen Pilzes Metarhizium anisopliae. J. Invertebr. 60, 89-101. doi: 10.1016/0022-2011(92)90159-2
CrossRef Full Text | Google Scholar
Storey, G. K., and Gardner, W. A. (1988). Bewegung eines wässrigen Sprays von Beauveria bassiana in das Profil von vier Böden in Georgia. Environ. Entomol. 17, 135-139. doi: 10.1093/ee/17.1.135
CrossRef Full Text | Google Scholar
Studdert, J. P., and Kaya, H. K. (1990). Auswirkung von Wasserpotential, Temperatur und Lehmbeschichtung auf das Überleben von Beauveria bassiana-Konidien in einem Lehm- und Torfboden. J. Invertebr. Pathol. 55, 417-427. doi: 10.1016/0022-2011(90)90086-L
CrossRef Full Text | Google Scholar
Sung, G.-H., Hywel-Jones, N. L., Sung, J.-M., Luangsa-ard, J. J., Shrestha, B., und Spatafora, J. W. (2007). Phylogenetische Klassifizierung von Cordyceps und den clavicipitaceous Pilzen. Stud. Mycol. 57, 5-59. doi: 10.3114/sim.2007.57.01
PubMed Abstract | CrossRef Full Text | Google Scholar
Takatsuka, J. (2007). Characterization of Beauveria bassiana isolates from Japan using inter-simple-sequence-repeat-anchored polymerase chain reaction (ISSR-PCR) amplification. Appl. Entomol. Zool. 42, 563-571. doi: 10.1303/aez.2007.563
CrossRef Full Text | Google Scholar
Thomas, M. B., and Jenkins, N. E. (1997). Auswirkungen der Temperatur auf das Wachstum von Metarhizium flavoviride und die Virulenz bei der Buntschrecke, Zonocerus variegatus. Mycol. Res 101, 1469-1474. doi: 10.1017/S0953756297004401
CrossRef Full Text | Google Scholar
Thompson, L. R., Sanders, J. G., McDonald, D., Amir, A., Ladau, J., Locey, K. J., et al. (2017). Ein gemeinschaftlicher Katalog enthüllt die multiskalige mikrobielle Vielfalt der Erde. Nature 551, 457-463. doi: 10.1038/nature24621
PubMed Abstract | CrossRef Full Text | Google Scholar
Tigano-Milani, M. S., Gomes, A. C. M. M., and Sobral, B. W. S. (1995). Genetische Variabilität unter brasilianischen Isolaten des entomopathogenen Pilzes Metarhizium anisopliae. J. Invertebr. 65, 206-210. doi: 10.1006/jipa.1995.1031
CrossRef Full Text | Google Scholar
Vänninen, I., Tyni-Juslin, J., and Hokkanen, H. (2000). Persistenz von vergrößerten Metarhizium anisopliae und Beauveria bassiana in finnischen landwirtschaftlichen Böden. Biocontrol 45, 201-222. doi: 10.1023/A:1009998919531
CrossRef Full Text | Google Scholar
Vega, F. E. (2008). Insektenpathologie und pilzliche Endophyten. J. Invertebr. Pathol. 98, 277-279. doi: 10.1016/j.jip.2008.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Vega, F. E., Goettel, M. S., Blackwell, M., Chandler, D., Jackson, M. A., Keller, S., et al. (2009). Pilzliche Entomopathogene: neue Erkenntnisse über ihre Ökologie. Fungal Ecol. 2, 149-159. doi: 10.1016/j.funeco.2009.05.001
CrossRef Full Text | Google Scholar
Vega, F. E., Meyling, N. V., Luangsa-ard, J. J., and Blackwell, M. (2012). „Fungal entomopathogens,“ in Insect Pathology, eds F. E. Vega and H. K. Kaya (Cambridge, MA: Academic Press), 171-220. doi: 10.1016/B978-0-12-384984-7.00006-3
CrossRef Full Text | Google Scholar
Vidal, C., Fargues, J., and Lacey, L. A. (1997). Intraspezifische Variabilität von Paecilomyces fumosoroseus: Wirkung der Temperatur auf das vegetative Wachstum. J. Invertebr. 70, 18-26. doi: 10.1006/jipa.1997.4658
CrossRef Full Text | Google Scholar
Wang, M., Tian, J., Xiang, M., and Liu, X. (2017). Lebensstrategie kälteangepasster Pilze am Beispiel einiger repräsentativer Arten. Mycology 8, 178-188. doi: 10.1080/21501203.2017.1370429
PubMed Abstract | CrossRef Full Text | Google Scholar
Wielgolaski, F. E., and Inouye, D. W. (2003). „High latitude climates,“ in Phenology: An Integrative Environmental Science, ed M. D. Schwartz (Dordrecht: Springer), 175-194. doi: 10.1007/978-94-007-0632-3_12
CrossRef Full Text | Google Scholar
Wraight, S. P., Ugine, T. A., Ramos, M. E., and Sanderson, J. P. (2016). Efficacy of spray applications of entomopathogenic fungi against western flower thrips infesting greenhouse impatiens under variable moisture conditions. Biol. Control 97, 31-47. doi: 10.1016/j.biocontrol.2016.02.016
CrossRef Full Text | Google Scholar
Xiao, G., Ying, S. H., Zheng, P., Wang, Z. L., Zhang, S., Xie, X. Q., et al. (2012). Genomische Perspektiven auf die Evolution der Entomopathogenität von Beauveria bassiana. Sci. Rep. 2:483. doi: 10.1038/srep00483
PubMed Abstract | CrossRef Full Text | Google Scholar
Zimmermann, G. (2007). Review on safety of the entomopathogenic fungus Metarhizium anisopliae. Biocontrol Sci. Technol. 17, 879-920. doi: 10.1080/09583150701593963
CrossRef Full Text | Google Scholar