Abstract
Der antrochoanale Polyp (ACP) ist eine einseitige, solitäre, birnenförmige Masse mit einem zystischen Stiel, die sich von den entzündlichen Polypen durch die Bildung eines eingeschnürten Sackes unterscheidet, der sich zur Hälfte im Antrum maxillare und zur anderen Hälfte in der Nase befindet und in unterschiedlichem Ausmaß in den Nasopharynx ausdehnt. Die ACP wird klinisch diagnostiziert, wobei bildgebende Untersuchungen wie die Computertomographie und die Kernspintomographie zur Differentialdiagnose herangezogen werden. Mikroskopisch gesehen fehlen bei ACP kleine Schleimhautdrüsen und ein gut ausgeprägtes eosinophiles Entzündungsinfiltrat, die Becherzellen des Oberflächenepithels sind weniger häufig als bei Sinunasalpolypen. Die einzige bekannte Behandlung ist die Operation, wobei die vollständige Entfernung durch eine funktionelle endoskopische Nasennebenhöhlenchirurgie mit Behandlung des obstruierten Ostiumkomplexes den derzeitigen Standard darstellt.
Schlüsselwörter
Antrochoanaler Polyp, Einseitiger Polyp
Abkürzungen
ACP: Antrochoanaler Polyp; CT: Computertomographie; MRI: Magnetresonanztomographie; SNP: Sinunasaler Polyp; FESS: Funktionelle endoskopische Sinus-Chirurgie; CWL: Caldwell-Luc-Verfahren; HPV: Humanes Papillomavirus; IP: Invertiertes Papillom
Einführung
Die erste bekannte veröffentlichte Beschreibung von Polypen, die aus dem Antrum der Kieferhöhle entspringen, stammt aus dem Jahr 1961 von dem niederländischen Anatomen Fredyk Ruysch. 1753 beschrieb Palfyn einen Polyp mit zwei Säcken aus der Kieferhöhle. 1891 beschrieb Zuckerland einen Fall eines solitären Polypen aus der Kieferhöhle. 1906 war Professor Gustav Killian der erste, der den Begriff antrochoanaler Polyp (ACP) verwendete und ihn als eine einseitige, solitäre, birnenförmige Masse mit einem zystischen Stiel beschrieb, die sich von den regulären Polypen durch die Bildung eines verengten Sackes unterscheidet, der sich zur Hälfte im Antrum maxillaris und zur anderen Hälfte in der Nase und im Nasopharynx befindet; diese Definition wird immer noch verwendet und gab dem ACP den Namen Killian-Polyp.
Die bilaterale nasale Polyposis ist eine klinische Erkrankung, die bei 1-4 % der kaukasischen Bevölkerung auftritt. Die ACP macht 4-6 % aller Nasenpolypen aus und steigt bei Kindern auf bis zu 35 % an. Es gibt keinen eindeutigen Geschlechtsunterschied im pädiatrischen Alter, am häufigsten tritt sie bei Kindern und jungen Erwachsenen auf. Bei Erwachsenen ist eine männliche Prävalenz berichtet worden.
Physiopathologie
Es gibt noch keine bestätigte Theorie über die Physiopathologie der ACP, obwohl es akzeptiert ist, dass es von einer Antralzyste, einem häufigen gutartigen Tumor des Antrums des Oberkiefers, der in 8-10% der Bevölkerung vorhanden ist, entstehen könnte, wurde vorgeschlagen, dass sie durch eine azinäre Schleimhautobstruktion als Folge einer chronischen Phlogose entstehen. Die Bildung einer Antrumzyste reicht nicht aus, um von einer ACP zu sprechen. 2009 stellten Frosini, et al. die Hypothese auf, dass chronische Entzündungsfaktoren, ob allergisch oder infektiös, die Entwicklung einer Antralzyste verursachen, die den akzessorischen Kieferhöhlenausgang und den natürlichen Kieferhöhlenausgang teilweise verschließt, wodurch ein ventilartiges Merkmal entsteht, das den Eintritt von Luft in die Kieferhöhle ermöglicht, wodurch ein Druckabfall senkrecht zur Wand der Struktur entsteht, der den Ausgang blockiert, was zur Erhöhung des Drucks beiträgt, der die Zyste dazu zwingt, außerhalb des akzessorischen Ausgangs zu hernieren, wodurch die ACP-Bildung ermöglicht wird. Ein weiterer vorgeschlagener Mechanismus für die Bildung der antralen Zyste ist, dass eine lymphatische Obstruktion, primär oder sekundär zu einer chronischen Sinusitis, eine Rolle bei der Bildung von ACP spielt. Es wurde ein Zusammenhang zwischen Humanen Papillomaviren (HPV) und Sinus-Nasenpolypen (SNP) vorgeschlagen, eine deutsche Studie von 257 Gewebeproben (166 NP, 39 ACP und 52 Kontrollnasenmuscheln) fand HPV-DNA in 15.1 % der NP, 53,8 % der ACP und 5,8 % der Kontrollgruppe, allerdings mit einem statistischen Unterschied. Das Vorhandensein von HPV-DNA in ACP war auf das Epithel beschränkt, mit niedrigen Transkriptionsproteinen, die Autoren schlagen vor, dass es eine Assoziation gibt, aber nicht als ursächlicher Faktor für ihre Entwicklung. Auch die Expression von Basic Fibroblast Growth Factor und Transforming Growth Factor-β ist signifikant höher in ACP als in Gewebe von Patienten mit chronischer Rhinosinusitis entfernt , auch Ebenen der Muzin-Gen-Expression, einschließlich MUC5AC, MUC5B und MUC8, zeigt eine höhere Expression als chronische Rhinosinusitis . Nasenabweichung und höhere Kieferhöhlenvolumina wurden mit ACP in Verbindung gebracht, ohne dass eine Ursache-Wirkungs-Beziehung bestand.
Histologie
Bei ACP fehlen kleine Schleimhautdrüsen und ein gut entwickeltes eosinophiles Entzündungsinfiltrat, die Becherzellen des Oberflächenepithels sind weniger häufig als bei einer SNP, auch die Basalmembran ist in den meisten Fällen von ACP unauffällig. Plattenepithel-Metaplasien an der Oberfläche werden bei ACP beobachtet, aber nicht so häufig bei SNP. Bei Ausdehnung auf den Nasopharynx wird eine chronische Entzündung in viel größerem Ausmaß festgestellt. Es ist nicht ungewöhnlich, dass ein ACP eine zystische Degeneration des Stromas erfährt, mit einem locker netzartigen Muster oder „pseudoangiomatösem“ Wachstum als Ergebnis einer chronischen oder subakuten vaskulären Beeinträchtigung, diese Art von Polypen werden oft als eigene klinische Entität beschrieben .
Anzeichen und Symptome
ACP ist eine klinische Diagnose mit histopathologischer Bestätigung. Der klassische ACP-Patient hat eine einseitige Nasenobstruktion und Nasenausfluss, mit einer glatten polypoiden Masse, die vom mittleren Meatus ausgeht und sich in die Choana, den Nasopharynx und schließlich in die Mundhöhle ausbreitet (Abbildung 1). In einigen Fällen wird über eine rote, hypervaskularisierte Masse berichtet, bilaterale ACP wurden, wenn auch sehr selten, berichtet. Auch kann mit Erwachsenen Atemnot , Dysphagie und obstruktive Schlafapnoe präsentiert werden.
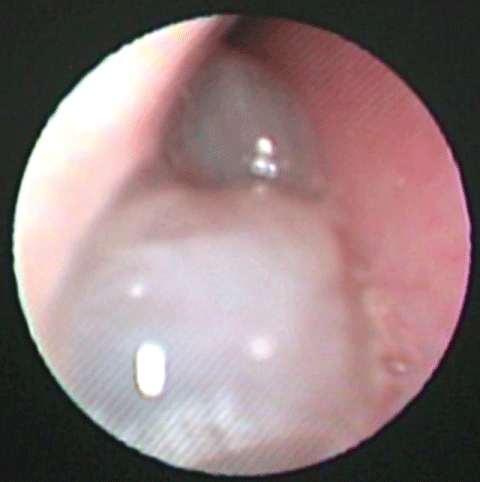 Abbildung 1: Nasenspiegelung einer ACP, einer glatten, nicht brüchigen polypoiden Masse, die die rechte Nasenhöhle ausfüllt. Abbildung 1
Abbildung 1: Nasenspiegelung einer ACP, einer glatten, nicht brüchigen polypoiden Masse, die die rechte Nasenhöhle ausfüllt. Abbildung 1
Bildgebung
Die Bildgebung hilft, andere Diagnosen auszuschließen und den chirurgischen Plan für die Entfernung des ACP zu erstellen. Der Befund der Computertomographie (CT) ist eine homogen getrübte, nicht-erhöhende, hypoattenuierende Massenläsion in der Kieferhöhle, die sich durch ein erweitertes Ostium erstreckt, mit einer variablen Ausdehnung auf die Choana und den Nasopharynx, ohne Anzeichen einer Knochenzerstörung (Abbildung 2). Es gibt keine pathognomonischen Zeichen in der Magnetresonanztomographie (MRT), zeigt sich aber oft als T1 hypointens und hyperintens in T2 mit einer peripheren Anreicherung im zystischen Teil, wenn intravenöser Kontrast verabreicht wird .
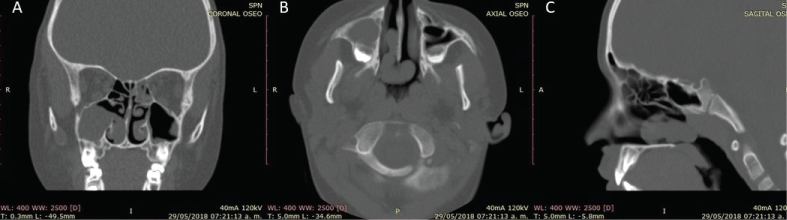 Abbildung 2: Koronale CT-Aufnahme eines Patienten mit einem rechtsseitigen ACP (Antrochoanaler Polyp); A) zeigt eine volle rechte Kieferhöhle mit einem freien Hauptostium bei gleichzeitiger Trübung des linken hinteren Siebbeins; B) axiale CT-Aufnahme; C) sagittale CT-Aufnahme, die die homogen getrübte Masse zeigt, die sich durch die Choana erstreckt, ohne Infiltration oder Knochenresorption. Abbildung 2
Abbildung 2: Koronale CT-Aufnahme eines Patienten mit einem rechtsseitigen ACP (Antrochoanaler Polyp); A) zeigt eine volle rechte Kieferhöhle mit einem freien Hauptostium bei gleichzeitiger Trübung des linken hinteren Siebbeins; B) axiale CT-Aufnahme; C) sagittale CT-Aufnahme, die die homogen getrübte Masse zeigt, die sich durch die Choana erstreckt, ohne Infiltration oder Knochenresorption. Abbildung 2
Differenzialdiagnose
Die Differenzialdiagnose für ein ACP muss das juvenile nasopharyngeale Angiofibrom einschließen, ein seltener Gefäßtumor, der fast ausschließlich bei jungen männlichen Patienten (10-25 Jahre) auftritt und mit einseitiger nasaler Obstruktion und Epistaxis beginnt. Bildgebende Untersuchungen zeigen eine stark vergrößerte Masse mit Gewebezerstörung und Knochenumbau. Ein weiterer Tumor, der ausgeschlossen werden muss, ist das Rhabdomyosarkom, ein bösartiger Tumor mit einer bimodalen Verteilung zwischen 2 bis 4 und 12 bis 16 Jahren. Wenn der Nasopharynx betroffen ist, können seine Anzeichen und Symptome eine einseitige Nasenobstruktion mit oder ohne Nasenausfluss sein, im MRT zeigt er sich als isointenses T1- und iso- bis hypointenses T2-Signal mit variabler Kontrastmittelanreicherung. Andere häufige Differentialdiagnosen sind die Variationen des ACP, die Choanalpolypen, die aus dem Ethmoid oder Sphenoid Sinus entstehen, und der gewöhnliche SNP.
Obwohl im pädiatrischen Alter nicht häufig, sind andere Diagnosen, an die man denken sollte, das umgekehrte Papillom (IP), ein gutartiger Tumor der Nasennebenhöhlen, der von der Kieferhöhle ausgehen kann und am häufigsten im fünften und sechsten Lebensjahrzehnt diagnostiziert wird, IP kann als rötlich-grauer, lobulierter Tumor gefunden werden, der fester und brüchiger als ein entzündlicher Polyp ist. IP kann im CT mit einer Knochenlyse verbunden sein, im MRT ist er hypointens in T1, mit homogener Anreicherung und einem zerebriformen Aspekt in T2. Andere seltene Pathologien sind das olfaktorische Neuroblastom, die Meningoenzephalozele, das Lymphom oder das Hämangiom.
Behandlung
Die Entfernung des Polypen durch funktionelle endoskopische Sinus-Chirurgie (FESS) mit gleichzeitiger Behandlung des obstruierten Sinus-Komplexes, ein sicheres Verfahren mit relativ geringen Komplikationen wie Synechien oder Epistaxis, ist der Grundstein für die Lösung von ACP in allen Altersgruppen. Externe Verfahren wie das Caldwell-Luc-Verfahren (CWL), das Mini-Caldwell-Luc-Verfahren oder die transcanine Sinuskopie können ebenfalls für die endgültige Behandlung eingesetzt werden, werden aber derzeit nur verwendet, wenn der Ursprung der ACP nicht gefunden werden kann, oder bei Revisionsoperationen in einem kombinierten Ansatz. In der pädiatrischen Altersgruppe lagen die Rezidive bei der kombinierten Methode bei 0 %, bei der alleinigen FESS bei 17,7 % und bei der CWL bei 9,1 %.
Nachsorge
Die empfohlene Nachsorge für Patienten mit ACP beträgt 2 Jahre, um 95 % der Rezidive zu erkennen. Wie bei jeder FESS wird eine routinemäßige Nasenendoskopie in der Praxis empfohlen, um Synechien vorzubeugen und zu behandeln, um Komplikationen zu minimieren. Über Rezidive wurde 6 Monate bis 3 Jahre nach dem Eingriff berichtet, wobei die Rezidivrate in der pädiatrischen Altersgruppe höher war als in der Erwachsenengruppe. Diese Unterschiede könnten durch die Schwierigkeit, den ACP-Ursprung zu finden, die FESS ohne abgewinkelte Endoskope und Instrumente und die enge Nasenanatomie der pädiatrischen Gruppe erklärt werden.
Schlussfolgerungen
Das ACP ist ein gutartiger Tumor der Kieferhöhle, der in unterschiedlichem Ausmaß in die Nasenhöhle vorstößt, fast immer einseitig, häufiger bei Kindern, ohne Geschlechtsunterschied in dieser Altersgruppe, mit einer männlichen Prädisposition in der Altersgruppe der Erwachsenen. Trotz intensiver Forschung ist die genaue Physiopathologie der ACP noch immer unbekannt, so dass es noch keine Möglichkeit der Prävention gibt. Bildgebende Untersuchungen helfen bei der Operationsplanung und Differenzialdiagnose, aber die Standarddiagnose ist immer noch klinisch. Die einzige Behandlung besteht in einem chirurgischen Eingriff, einschließlich der vollständigen Entfernung des Polypen und der Behandlung des damit verbundenen obstruierten Sinuskomplexes, vorzugsweise durch eine funktionelle endoskopische Sinusoperation. Die Nachbeobachtung des Patienten sollte mindestens 2 Jahre betragen, wobei es keinen Standard dafür gibt, wie der Patient nachbeobachtet werden sollte.
Interessenkonflikt
Die Autoren erklären, dass sie keinen Interessenkonflikt haben.
Finanzierungsquelle
Es gibt keine Finanzierungsquelle.
- Ruysch F (1691) Observation um anatomica chirurgicaram antur- ca.
- Palfyn J (1753) Anatomie chirurgicale. Paris.
- Zuckerkandl E (1892) Normale und pathologische Anatomie der Nasenholme. Wien.
- Killian G (1906) The origin of choanal polypi. Lancet 2: 81-82.
- Montague ML, McGarry GW (2004) Familiäre antrochoanale Polyposis – Ein Fallbericht. Eur Arch Otorhinolaryngology 261: 507-508.
- Towbin R, Dunbar JS, Bove K (1979) Antochoanal polyps. AJR Am J Roentgenol 132: 27-31.
- Woolley Audie L, Clary Randall A, Lusk Rodney P (1996) Antrochoanal polyps in children. Am J Otolaryngol 17: 368-373.
- Schramm VL Jr, Efferon MZ (1980) Nasale Polypen bei Kindern. Laryngoscope 90: 1488-1495.
- Maldonado M, MartÍnez A, Alobid I, Mullol J (2004) The antrochoanal polyp. Rhinology 42: 178-182.
- Orvidas LJ, Beatty CW, Weaver AL (2001) Antrochoanale Polypen bei Kindern. Am J Rhinol 15: 321-325.
- Settipane GA, Chafee FII (1977) Nasal polyps in asthma and rhinitis. A review of 6037 patients. J Allergy Clin Immunol 59: 17-21.
- Berg O, Carenfelt C, Silfversward C, Sobin A (1988) Origin of the choanal polyp. Arch Otolaryngol Head Neck Surg 114: 1270-1271.
- Chen JK, Schloss MD, Azouz ME (1989) Antrochoanal polyps: 10-Jahres-Retrospektive Studie in der pädiatrischen Population mit einem Überblick über die Literatur. J Otolaryngol 18: 168-172.
- Frosini P, Picarella G, De Campora (2009) Antrochoanal polyp: Analysis of 200 cases. Acta Otorhinolaryngol Ital 29: 21-26.
- Mostafa HS, Fawzy TO, Jabri WR, Ayad E (2014) Lymphatic obstruction: Ein neuer ätiologischer Faktor bei der Bildung von antrochoanalen Polypen. Ann Otol Rhinol Laryngol 123: 381-386.
- Piquet JJ, Chevalier D, Leger GP, Rouquette I, Leconte-Houcke M (1992) Endonasal microsurgery of antro-choanal polyps. Acta Otorhinolaryngol Belg 46: 267-271.
- Knör M, Tziridis K, Agaimy A, Zenk J, Wendler O (2015) Human Papillomavirus (HPV) prevalence in nasal and antrochoanal polyps and association with clinical data. PLoS One 10: e0141722.
- Mahfouz ME, Elsheikh MN, Ghoname NF (2006) Molecular profile of the antrochoanal polyp: Hochregulierung des grundlegenden Fibroblasten-Wachstumsfaktors und des transformierenden Wachstumsfaktors beta in der Kieferhöhlenschleimhaut. Am J Rhinol20: 466-470.
- Balikci HH, Ozkul MH, Uvacin O, Yasar H, Karakas M, et al. (2013) Antrochoanal polyposis: Analysis of 34 cases. Eur Arch Otorhinolaryngol 270: 1651-1654.
- Aydın S, Taskin U, Orhan I, Altas B, Oktay MF, et al. (2015) The analysis of the maxillary sinus volumes and the nasal septal deviation in patients with antrochoanal polyps. Eur Arch Otorhinolaryngology 272: 3347-3352.
- Ozcan C, Zeren H, Talas DU, Küçükoğlu M, Görür K (2005) Antrochoanal polyp: Eine transmissionselektronen- und lichtmikroskopische Studie. Eur Arch Otorhinolaryngol 262: 55-60.
- Chung SK, Chang BC, Dhong HJ (2002) Surgical, radiologic, and his- tologic findings of the antrochoanal polyp. Am J Rhinol 16: 71-76.
- Skladzien J, Litwin JA, Nowogrodzka-Zagorska M, Wierzchowski W (2001) Morphologische und klinische Merkmale von antrochoanalen Polypen: Vergleich mit chronischen entzündungsbedingten Polypen der Kieferhöhle. Auris Nasus Larynx 28: 137-141.
- Lee DH, Yoon TM, Lee JK, Lim SC (2016) Difference of antrochoanal polyp between children and adults. Int J Pediatr Otorhinolaryngol 84: 143-146.
- Sabino HAC, Faria FM, Tamashiro E, Lima WTA, Valera FCP (2014) Bilateral antrochoanal polyp: Case report. Brazilian Journal of Otorhinolaryngology 80: 182-183.
- Yilmaz YF, Titiz A, Özcan M, Tezer MS, Ozlugedik S, et al. (2007) Bilateral antrochoanal polyps in an adult: A case report. B-ENT 3: 97-99.
- Whittle TT, Benzie S, Graham D (2017) Prolapsed antrochoanal polyp: Eine ungewöhnliche Ursache für akute Atemnot bei Erwachsenen. BMJ Case Rep.
- Swischuk LE, Hendrick EP (2000) Antrochoanal polyp originating from sphenoid sinus causing acute dysphagia. 358-360.
- Veerappan I, Ramar R, Navaneethan N, Dharmapuri Yaadhavakrishnan RP (2013) Antrochoanal polyp presenting as obstructive sleep apnea. Indian J Pediatr 80: 959-961.
- Weder S, Landis BN, Banz Y, Caversaccio M, Dubach P (2011) Pädiatrischer Verkehrsunfall und obstruktive Schlafapnoe durch antrochoanale Polypen: Fallbericht und Literaturübersicht. Int J Pediatr Otorhinolaryngol 75: 1359-1363.
- Pruna X, Iban˜ez JM, Serres X, Garriga V, Barber I, et al. (2000) Antrochoanal polyps in children: CT-Befunde und Differentialdiagnose. Eur Radiol 10: 849-851.
- Yaman H, Yilmaz S, Karali E, Guclu E, Ozturk O (2010) Evaluation and management of antrochoanal polyps. Clin Exp Otorhinolaryngol 3: 110-114.
- Boghani Z, Husain Q, Kanumuri VV, Khan MN, Sangvhi S, et al. (2013) Juvenile nasopharyngeal angiofibroma: A systematic review and comparison of endoscopic, endoscopic-assisted, and open resection in 1047 cases. Laryngoscope 123: 859-869.
- Íleri F, Köybaşioǧlu A, Uslu S (1998) Clinical presentation of a sphenochoanal polyp. Eur Arch Otorhinolaryngology 255: 138-139.
- İla K, Topdağ M, Öztürk M, İşeri M, Aydın Ö, et al. (2015) Retrospective analysis of surgical treatment of choanal polyps. Kulak Burun Bogaz Ihtis Derg 25: 144-151.
- Bugter O, Monserez DA, Van Zijl FVWJ, Baatenburg De Jong RJ, Hardillo JA (2017) Surgical management of inverted papilloma; A single-center analysis of 247 patients with long follow-up. J Otolaryngol Head Neck Surg 46: 67.
- Barnes L, Eveson JW, Reichart P, Sidransky D (2005) World Health Organization Classification of Tumours. Pathologie und Genetik von Kopf-Hals-Tumoren. Lyon: IARC Press.
- Lisan Q, Laccourreye O, Bonfils P (2016) Sinonasal inverted papilloma: Von der Diagnose bis zur Behandlung. Eur Ann Otorhinolaryngol Head Neck Dis 133: 337-341.
- Grainger AJ, Zammit-Maempel I (2001) Antrochoanal polyps in children. Eur Radiol 11: 347.
- Galluzzi F, Pignataro L, Maddalone M, Garavello W (2018) Recurrences of surgery for antrochoanal polyps in children: A systematic review. Int J Pediatr Otorhinolaryngol 106: 26-30.
- Chaiyasate S, Roongrotwattanasiri K, Patumanond J, Fooanant S (2015) Antrochoanal polyps: Wie lange sollte die Nachsorge nach der Operation sein? International Journal of Otolaryngology 2015: 1-5.
Citation
Islas FAE, González JLT, Camarillo JMM (2018) Antrochoanal Polyp: A Literature Update. J Otolaryngol Rhinol 4:049. doi.org/10.23937/2572-4193.1510049