Tetrachlorkohlenstoff kann als CCl4 ausgedrückt werden und besteht aus einem Kohlenstoffmolekül und vier Chlormolekülen. Tetrachlorkohlenstoff ist unpolar. Warum ist Tetrachlorkohlenstoff unpolar? Es ist unpolar, weil die Dipolmomente des Moleküls gleichmäßig um das zentrale Kohlenstoffatom verteilt sind. Das bedeutet, dass sich ihre individuellen Wirkungen aufheben, und das Molekül ist neutral.
Die vier Chloratome sind symmetrisch an den vier Ecken eines Tetraeders angeordnet, und jedes von ihnen ist durch eine Einfachbindung mit dem Kohlenstoffatom in der Mitte des Moleküls verbunden. Folglich hat CCl4 weder ein positives noch ein negatives Dipolmoment. Wenn ein anderes Atom als Chlor an einer anderen Stelle im Molekül positioniert wäre, hätte das Molekül ein Dipolmoment und CCl4 wäre folglich polar.
„Wir definieren die organische Chemie als die Chemie der Kohlenstoffverbindungen.“ – August Kekule
Das ist die schnelle Antwort auf die Polarität von Tetrachlorkohlenstoff. Es wäre jedoch von Vorteil, über die Polarität von Molekülen im Allgemeinen zu sprechen und Tetrachlorkohlenstoff und seine Eigenschaften zu untersuchen, um zu verstehen, warum es in der Natur unpolar ist.
Was bedeutet es, dass ein Molekül Polarität hat?
Wenn man den Begriff polar hört, denkt man wahrscheinlich an den Nord- und Südpol der Erde. Diese Nord- und Südpole befinden sich an entgegengesetzten Enden der Erde, ähnlich wie eine Batterie einen positiven und einen negativen Pol haben kann. Auch Moleküle und die Bindungen zwischen Atomen können eine Polarität haben. Ein Molekül wird als polar definiert, wenn die Atome, aus denen das Molekül besteht, so angeordnet sind, dass ein Ende des Moleküls positiv und das andere Ende des Moleküls negativ geladen ist.
Ein polares Molekül entsteht, wenn ein Atom mit hoher Elektronegativität sich mit einem Atom mit schwächerer Elektronegativität verbindet oder verbindet. Das entstehende Molekül hat einen Bereich mit hoher Elektronegativität und einen Bereich mit niedrigerer Elektronegativität oder elektrischen Polen. Eines der berühmtesten Beispiele für ein polares Molekül ist das Wasser, das dank seiner polaren Natur die Grundlage für das Leben auf der Erde bildet.
Im Gegensatz dazu haben unpolare Moleküle keine elektrischen Pole, und die Elektronen in ihnen sind gleichmäßiger verteilt. Unpolare Moleküle haben keine nennenswerte Ladung an beiden Enden des Moleküls. Die meisten Kohlenwasserstoff-Flüssigkeiten sind von Natur aus unpolar.
Zusammenfassend lässt sich sagen, dass ein Molekül mit Dipolen, die sich nicht gegenseitig aufheben, polar ist, während unpolare Moleküle solche sind, bei denen sich die Ladungen der Atome gegenseitig aufheben und keine Ladung an einem Ende des Moleküls oder dem anderen vorhanden ist.
Beispiele für polare Moleküle
Wie bereits erwähnt, ist Wasser ein polares Molekül. Die Bindungen, die zwischen den Sauerstoff- und Wasserstoffatomen bestehen, sind so verteilt, dass beide Seiten des Atoms, sowohl die Sauerstoff-Wasserstoff- als auch die Bindungen, gleichmäßig verteilt sind. Das Ergebnis ist, dass die Sauerstoffseite, oder die Oberseite des Moleküls, eine leicht negative Ladung hat, während die Wasserstoffatome, oder die Unterseite des Moleküls, eine leicht positive Ladung hat.
Ethanol ist ein polares Molekül, weil die Sauerstoffatome im Molekül eine höhere Elektronegativität haben als die anderen Atome. Die Sauerstoffatome ziehen aufgrund ihres höheren Elektronegativitätspotenzials mehr Elektronen an, und die -OH-Bindungsgruppen im Molekül sind insgesamt negativ geladen, auch wenn die negative Ladung sehr gering ist.
„Leben existiert im Universum nur, weil das Kohlenstoffatom bestimmte außergewöhnliche Eigenschaften besitzt.“ – James Jeans
HINWEIS
Andere Beispiele für polare Moleküle sind Schwefeldioxid (SO2), Schwefelwasserstoff (H2S) und Ammoniak (NH3).
Bitte beachten Sie, dass ein Molekül aus polaren Bindungen bestehen und dennoch unpolar sein kann. Ein Beispiel ist Kohlendioxid, das vier Bindungen hat, aber die Dipolmomente des Moleküls neutralisieren sich gegenseitig, so dass das Molekül unpolar ist.
Beispiele für unpolare Moleküle

Beispiele für unpolare Moleküle sind Stickstoff, Methan, Ozon und Sauerstoff. Dies sind homonukleare Moleküle oder Moleküle, die aus Atomen nur eines Elements bestehen. Zu den unpolaren Molekülen, die nicht homonuklear sind, gehören das bereits erwähnte Kohlendioxid und Methan. Toluol und Benzin sind ebenfalls Beispiele für unpolare Stoffe. In der Regel sind Kohlenstoffverbindungen unpolar, obwohl es einige Ausnahmen gibt, wie z. B. Kohlenmonoxid. Kohlenmonoxid ist von Natur aus linear, was ein Molekül normalerweise unpolar machen würde, aber der Elektronegativitätsunterschied zwischen dem Sauerstoff- und dem Kohlenstoffmolekül ist so groß, dass das Molekül polar ist. Alkine lösen sich nicht in Wasser und gelten daher als unpolare Moleküle. Die Edelgase werden ebenfalls als unpolare Moleküle eingestuft, da sie nur aus einzelnen Atomen ihrer jeweiligen Elemente bestehen, wie z. B. Neon, Helium, Argon und Krypton.
Vorhersage der Polarität eines Moleküls
Die Untersuchung der Elektronegativitätswerte der Atome in einem Molekül hilft bei der Feststellung, ob das Molekül wahrscheinlich polar oder unpolar ist oder nicht. Signifikante Unterschiede zwischen den Elektronegativitätswerten bedeuten, dass die Elektronen gleichmäßig zwischen den Atomen im Molekül verteilt sind. Da die Elektronen einem Atom näher sind als einem anderen, wird dieser Bereich des Moleküls polar sein. Um die Polarität des gesamten Moleküls zu bestimmen, müssen jedoch alle Bindungen berücksichtigt werden.
Der entscheidende Faktor für die Polarität oder Unpolarität eines Moleküls ist seine Geometrie. Wenn ein Ende des Moleküls negativ und das andere Ende positiv geladen ist, ist das Molekül polar. Wenn die Ladungen jedoch gleichmäßig verteilt sind und ein zentrales Atom umkreisen, ist das Molekül wahrscheinlich unpolar. Auf diese Weise lässt sich vorhersagen, ob ein Molekül polar oder unpolar sein wird. Nicht jedes Molekül hat ein Dipolmoment, was die Vorhersage der Polarität eines Moleküls etwas schwieriger machen kann. Beispielsweise haben Moleküle, die in einer geometrischen Ebene gespiegelt werden können, kein Dipolmoment, da Dipolmomente nur einen einzigen Punkt umfassen können.
Fakten über Tetrachlorkohlenstoff
Tetrachlorkohlenstoff wurde erstmals Mitte des 18. Jahrhunderts von dem französischen Chemiker Henri Victor Regnault entdeckt. Die Chemikalie wurde durch eine Kombination von Chlor und Chloroform entdeckt. Heutzutage wird Tetrachlorkohlenstoff jedoch hauptsächlich aus Methan gewonnen. Bei der Herstellung von Tetrachlorkohlenstoff werden häufig die Nebenprodukte von Chlorierungsreaktionen zur Gewinnung der Verbindung verwendet. Dazu gehören die Nebenprodukte bei der Herstellung von Chloroform und Dichlormethan. Tetrachlorkohlenstoff ist von Natur aus recht flüchtig und verströmt einen Geruch, der an chemische Reinigungsmittel erinnert. Tetrachlorkohlenstoff ist auch ein Lösungsmittel und eignet sich daher zum Lösen unpolarer Stoffe wie Öle und Fette.
Tetrachlorkohlenstoff hat viele verschiedene Anwendungen und wurde als Reinigungsmittel, als Kühlmittel und in Feuerlöschern eingesetzt. Tetrachlorkohlenstoff wird oft bei der Herstellung von Lavalampen verwendet, um das Wachs schwerer zu machen.
„… Ist das Kohlenstoffmolekül mit Gedanken ausgekleidet?“ – Saul Bellow
Aufgrund der Umweltauswirkungen von Tetrachlorkohlenstoff ist dessen Produktion seit den 1980er Jahren stark zurückgegangen. Das Protokoll von Montréal schränkte die Produktion von Fluorchlorkohlenwasserstoffen ein, und da Tetrachlorkohlenstoff ein wichtiger Bestandteil bei der Herstellung von FCKW ist, ging die Produktion von Tetrachlorkohlenstoff in der Folge stark zurück. Die gesundheitsschädlichen Wirkungen von Tetrachlorkohlenstoff haben ebenfalls zu einem Rückgang der Produktion geführt, und obwohl Tetrachlorkohlenstoff früher häufig als Lösungsmittel verwendet wurde, wird er heute nur noch selten für solche Zwecke eingesetzt.
Tetrachlorkohlenstoff ist extrem lebergiftig, und andere leberschädigende Stoffe werden oft mit der Toxizität von Tetrachlorkohlenstoff verglichen. Hohe Konzentrationen von Tetrachlorkohlenstoff können nicht nur die Leber, sondern auch die Nieren schädigen. Eine längere Exposition gegenüber Tetrachlorkohlenstoff kann zu einem Koma oder zum Tod führen. Die Exposition gegenüber dieser Chemikalie kann auch das Krebsrisiko erhöhen.
Warum ist Tetrachlorkohlenstoff polar?
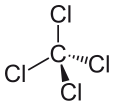
Nachdem wir gesehen haben, was ein Molekül polar macht, und uns einige Beispiele für polare Moleküle angesehen haben, können wir nun besser verstehen, warum Tetrachlorkohlenstoff ein unpolares Molekül ist. Um festzustellen, ob ein Molekül polar oder unpolar ist, sollte man zunächst die Elektronegativitätswerte der Atome im Molekül berechnen. Die Polarität der Bindung zwischen zwei Atomen muss ermittelt werden, und alle Bindungen müssen berücksichtigt werden, wenn man versucht, die Polarität des Moleküls zu bestimmen. Der Unterschied in der Elektronegativität zwischen Chlorid und Kohlenstoff, im Falle von Tetrachlorkohlenstoff, ist jedoch nicht der einzige Faktor, der berücksichtigt werden muss. Auch die Form des Moleküls muss berücksichtigt werden. Es gibt zwar Dipole im Molekül, aber die lineare Form von Tetrachlorkohlenstoff bedeutet, dass sich die Auswirkungen der verschiedenen Dipolmomente im Molekül gegenseitig aufheben und das Molekül daher neutral oder unpolar ist.