Apoptose

Apoptose, oder programmierter Zelltod, ist ein hochregulierter Weg für einen Organismus, Zellen selektiv zu eliminieren. Dieser Prozess spielt eine wichtige Rolle bei der Embryogenese, der Erhaltung der Größe eines Organismus und der Beseitigung geschädigter oder abnormaler Zellen. Die Bedeutung der Apoptose für die menschliche Gesundheit wird durch die vielen Krankheiten unterstrichen, die auf eine gestörte Apoptose zurückzuführen sind. Eine Fehlregulierung der Apoptose wird mit verschiedenen Krebsarten, neurologischen und kardiovaskulären Störungen sowie Autoimmunkrankheiten in Verbindung gebracht.
Man unterscheidet üblicherweise zwischen zwei verschiedenen Arten der Apoptose: dem intrinsischen Weg, der durch Mitochondrien als Reaktion auf interne Stimuli wie DNA-Schäden vermittelt wird, und dem extrinsischen Weg, der durch extrazelluläre Todesrezeptoren vermittelt wird (z. B. Bindung von FasL an den FasLG-Rezeptor) (Abbildung 1). Beide Wege beruhen auf Proteasen, den so genannten Initiator-Caspasen, die eine Kaskade von Effektor-Caspasen aktivieren, was zur Apoptose führt. Die Wechselwirkung zwischen dem intrinsischen und dem extrinsischen Weg wird durch den Todesagonisten (Bid) vermittelt, der mit der BH-3-Domäne interagiert.
Der intrinsische Weg (Abbildung 1) wird durch Bcl-2-Homologieproteine initiiert. Im klassischen Apoptoseweg werden die Bcl-2-Proteine Bax und Bak als Reaktion auf interne Stimuli wie DNA-Schäden oder oxidativen Stress aktiviert. Diese beiden Proteine interagieren anschließend mit Bid und werden in die äußere Mitochondrienmembran eingebaut. Dies führt zu dem Punkt, an dem es bei der Apoptose kein Zurück mehr gibt – der Permeabilisierung der äußeren Mitochondrienmembran (MOMP). MOMP führt zur Freisetzung von pro-apoptotischen Faktoren wie Cytochrom c in das Zytoplasma. Cytochrom c im Zytoplasma bindet APAF-1 und dATP, um pro-Caspase-9 zu rekrutieren und das Apoptosom zu bilden. Die Apoptosombildung löst die Spaltung von pro-Caspase-9 in ihre aktive Proteaseform, Caspase-9, aus. Caspase-9 ist eine Initiator-Caspase, die dann nachgeschaltete Effektor-Caspasen wie Caspase-3 und -7 durch Proteolyse aktiviert und so die Caspase-Kaskade auslöst, die zur Apoptose führt.
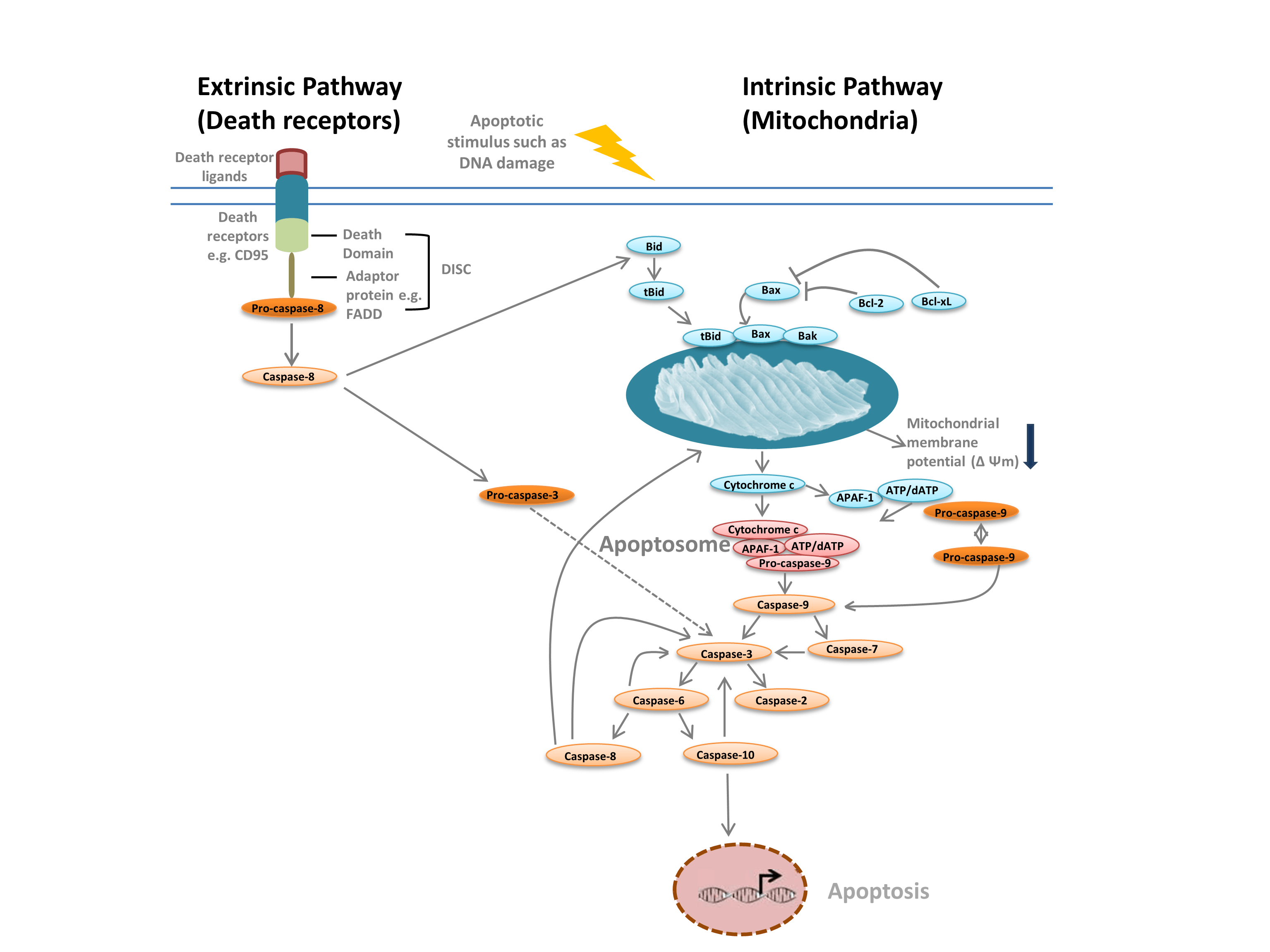
Abbildung 1. Wege der Apoptose.
Der extrinsische Weg wird durch die Bindung von Liganden an Todesrezeptoren ausgelöst. Nach der Ligandenbindung oligomerisieren die Todesrezeptoren und rekrutieren Adaptorproteine wie FADD. Dies ermöglicht die Rekrutierung von Pro-Caspase-8, der inaktiven Form von Initiator-Caspase-8, und die Bildung des Todesinduzierenden Signalisierungskomplexes (DISC). Pro-Caspase-8 oligomerisiert und wird in seine aktive Form, Caspase-8, gespalten, die wiederum die Effektor-Caspase-3 spaltet und aktiviert. Caspase-3 wiederum aktiviert proteolytisch verschiedene andere Caspasen, was zur Apoptose führt. In einigen Fällen kann die Aktivierung des extrinsischen Weges auch zur Aktivierung des intrinsischen Weges führen, der durch Bid vermittelt wird.
Apoptose unterscheidet sich vom unprogrammierten Zelltod/der Nekrose. Die Nekrose ist ein ungeregelter Prozess, der durch äußere Schäden ausgelöst wird und sich in mehreren wesentlichen Punkten von der Apoptose unterscheidet (Tabelle 1). Da wir jedoch mehr über Apoptose und Nekrose gelernt und neue Mechanismen des Zelltods wie die Nekroptose identifiziert haben, sind die Grenzen zwischen Apoptose und Nekrose unschärfer geworden. Die in Tabelle 1 dargestellten Unterscheidungsmerkmale sind jedoch nach wie vor hilfreiche Leitlinien.
Tabelle 1. Merkmale von Apoptose und Nekrose.
| Apoptose | Nekrose |
| Zellen schrumpfen | Zellen schwellen an |
| Phagozyten/Makrophagen verschlingen Zellen | Zell Trümmer werden freigesetzt |
| Der Prozess ist nicht-entzündlich | Der Prozess ist entzündlich |
Es ist sinnvoll, diesen Prozess bei der Analyse der Apoptose in Phasen zu unterteilen:
- Apoptose wird eingeleitet und Signalkaskaden werden aktiviert
- Zellen schrumpfen und runden sich ab, vermittelt durch Caspasen
- Organellen verändern ihre Form und die Membranen beginnen zu platzen
- Kernkondensation beginnt
- DNA-Fragmentierung kann beobachtet werden
- Apoptotische Körper werden gebildet
- Apoptotische Körper werden phagozytiert
Diese apoptotischen Stufen, können zusammen mit den bekannten Mediatoren der Apoptose als Identifikatoren der Apoptose verwendet werden. Bei der Auswahl eines Apoptose-Assays sollten Sie sich überlegen, welche Frage Sie stellen möchten. Caspase-Aktivitäts-Assays sind ausgezeichnete Indikatoren für die Einleitung der Apoptose, während DNA-Fragmentierungs-Assays verwendet werden können, um Zellen in den späten Stadien der Apoptose zu identifizieren, wenn sie unwiderruflich dem programmierten Zelltod verfallen sind.
Bei der Durchführung von Apoptose-Assays ist es immer ratsam, Lebensfähigkeitsfarbstoffe wie Propidiumiodid (PI) zu verwenden, um apoptotische Zellen von nekrotischen Zellen zu unterscheiden und Zellen oder Gewebe unter dem Mikroskop visuell auf wichtige morphologische Indikatoren der Apoptose zu untersuchen.
Assessing Apoptosis
1. Morphologische Veränderungen
Mit Hilfe der Zeitraffer-Bildgebung von lebenden Zellen kann die Apoptose in Echtzeit verfolgt werden, und sie ist besonders nützlich, um das Auftreten von Membranen zu erkennen. Bei Geweben kann die Transmissionselektronenmikroskopie verwendet werden, um viele der strukturellen Veränderungen zu erkennen, die mit den Stadien der Apoptose einhergehen. Gewebe können auch mit Hämatoxylin und Eosin gefärbt werden, um Makrophagen sichtbar zu machen, die apoptotische Zellen verschlungen haben. Acridinorange (AO) ist ein weiterer Farbstoff, der häufig zur Visualisierung apoptotischer Zellen verwendet wird. Dieser weit verbreitete Lebensfähigkeits- und Proliferationsfarbstoff kann zur Beurteilung der Apoptose verwendet werden, da sich sein Emissionsspektrum in der sauren Lysosomenumgebung zu Orange verschiebt; dies macht den Farbstoff nützlich für die Identifizierung verschlungener apoptotischer Zellen. DNA-bindende Farbstoffe wie DAPI, Hoechst, Propidiumjodid (PI) und 7-AAD können verwendet werden, um das Blebbing des Zellkerns sichtbar zu machen, während die Zellschrumpfung entweder in einem Durchflusszytometer als Verringerung der Vorwärtsstreuung (FSC) oder visuell mit Hilfe der Lichtmikroskopie nachgewiesen werden kann.
2. Veränderungen des mitochondrialen Membranpotenzials
Veränderungen des Membranpotenzials zeigen an, dass eine Zelle den „Point of no return“ überschritten hat und nun in die Apoptose übergeht. Ein Zusammenbruch des mitochondrialen Membranpotenzials kann durch Durchflusszytometrie oder Immunfluoreszenz unter Verwendung potentiometrischer Farbstoffe nachgewiesen werden.
Tetramethylrhodaminethylester (TMRE), Tetramethylrhodaminmethylester (TMRM) und JC-1 sind häufig verwendete potentiometrische Farbstoffe. TMRE und TMRM lagern sich in den Mitochondrien nicht apoptotischer Zellen an und fluoreszieren hell orange oder rot. In apoptotischen Zellen mit vermindertem mitochondrialem Membranpotenzial liegen diese Farbstoffe im gesamten Zytoplasma in ihrer monomeren Form vor und zeigen eine verminderte rote Fluoreszenz. Die Farbstoffe können in Kombination mit Fluorophor-markierten Inhibitor of Caspase Assays (FLICA) (siehe nächster Abschnitt) verwendet werden, um apoptotische Zellen anhand von zwei Merkmalen zu identifizieren: Abbau des mitochondrialen Membranpotenzials und Caspase-Aktivierung (Abbildung 2).
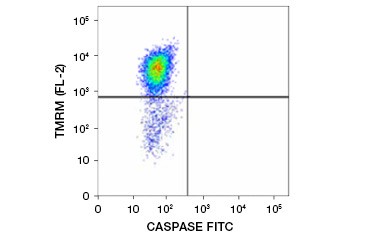
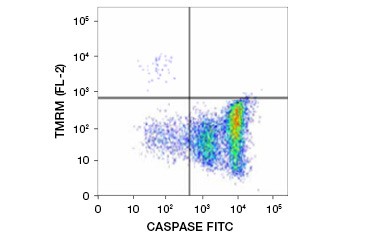
Abbildung 2. Nachweis der Reduktion des mitochondrialen Membranpotenzials und der Caspase-Aktivierung durch Durchflusszytometrie. Der gleichzeitige Verlust der orangefarbenen Fluoreszenz von TMRM und der Anstieg der grünen Fluoreszenz, der die mit dem FAM-FLICA Polycaspase Kit gemessene Caspase-Aktivierung anzeigt, weist auf apoptotische Zellen hin (unterer rechter Quadrant).
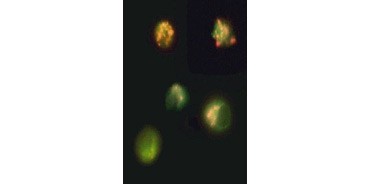
Abb. 3. Zusammenbruch des mitochondrialen Membranpotenzials, dargestellt mit JC-1. Jurkat-Zellen wurden mit MitoPT JC-1 angefärbt. Nicht-apoptotische Zellen (oben) zeigen rot gefärbte Mitochondrien, während Zellen in verschiedenen Stadien der Apoptose eine grüne zytoplasmatische Fluoreszenz aufweisen.
JC-1 aggregiert auch in Mitochondrien nicht-apoptotischer Zellen und ist in apoptotischen Zellen in der Zelle verteilt. Im Gegensatz zu TMRE und TMRM , die eine reduzierte Fluoreszenz aufweisen, ändert JC-1 seine Farbe von rot nach grün. Dies ermöglicht eine einfache Unterscheidung zwischen nicht-apoptotischen rot fluoreszierenden Zellen und apoptotischen grün fluoreszierenden Zellen (Abbildung 3). Diese Assays können mit Hilfe der Fluoreszenzmikroskopie, eines Durchflusszytometers oder eines entsprechend ausgestatteten Mikroplattenlesegeräts abgelesen werden.
3. Caspase-Aktivierung
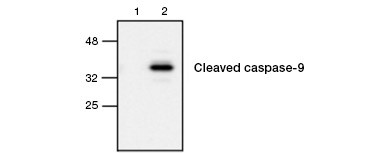
Abb. 4. Aktive Caspase-9 wird durch Western Blot nachgewiesen. Western-Blot-Analyse von unbehandelten (Spur 1) und Etoposid-behandelten (Spur 2) Zellen, die mit Kaninchen-Antikörper gegen Caspase-9 (aktiv) markiert wurden. Aktive, gespaltene Caspase-9 wird nur bei der Induktion der Apoptose mit Etoposid nachgewiesen.
Die Aktivierung von Caspase ist ein entscheidendes Merkmal der Apoptose. Die wichtigsten apoptotischen Caspasen sind die Initiator-Caspasen 3, 6 und 7 und die Effektor-Caspasen 2, 8, 9 und 10, die üblicherweise untersucht werden. Die Caspase-Aktivierung kann entweder durch die verringerte Größe der Pro-Caspasen, wenn sie gespalten werden, oder durch die Verwendung von Antikörpern, die nur mit der gespaltenen, aktivierten Form interagieren, nachgewiesen werden (Abbildung 4). Beide Ansätze können mittels Western Blotting abgelesen werden, während der letztgenannte Ansatz auch für fluoreszierende und immunhistochemische Assays angepasst werden kann, indem Antikörper gewählt werden, die mit Fluorophoren oder Biotin konjugiert sind. Diese Assays sind sowohl mit fixierten als auch mit unfixierten Zellen kompatibel.
Eine Sache, die man im Auge behalten sollte, ist, dass Initiator-Caspasen im Apoptose-Signalweg weit stromaufwärts liegen und dass ihre Aktivierung nicht immer zur Apoptose führt. Es ist daher ratsam, Assays für Initiator-Caspasen mit Assays für Effektor-Caspasen zu kombinieren oder, noch besser, mit Sonden für Ereignisse, die dem Point of no Return nachgeschaltet sind, wie z. B. MOMP.
Eine andere Klasse von Caspase-Aktivierungsassays sind fluorophor-markierte Caspase-Substrate, wie z. B. FLICA-Assays. FLICA-Assays binden kovalent und irreversibel an aktivierte Caspasen; nicht gebundener Inhibitor diffundiert aus den Zellen und/oder kann durch Waschen entfernt werden. Diese Inhibitoren sind entweder mit roten oder grünen Farbstoffen fusioniert erhältlich. Die Fluoreszenzintensität kann als quantitatives Maß für die Caspase-Aktivität verwendet werden – apoptotische Zellen mit hoher Caspase-Aktivität zeigen mehr Fluoreszenz als solche mit geringer Caspase-Aktivität. FLICA Assays sind mit lebenden Zellen, Gewebeschnitten und dünnen gefrorenen Schnitten kompatibel, jedoch nicht mit fixierten Zellen oder in Paraffin eingebettetem Gewebe, und können durch Quantifizierung der Fluoreszenzintensität unter Verwendung von Fluoreszenzmikroskopie, Durchflusszytometrie (Abbildung 2) oder einem Mikroplattenlesegerät abgelesen werden.
Um fundierte Schlussfolgerungen aus Caspase-Aktivitäts-Assays zu ziehen, ist es immer ratsam, mehr als ein Target auszuwählen.
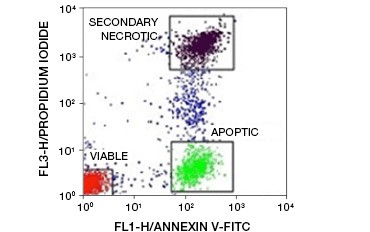
Abbildung 5. Annexin-V-Konjugate können verwendet werden, um apoptotische von nekrotischen und lebensfähigen Zellen zu unterscheiden. Dot-Plot von mit Annexin V:FITC gefärbten Ramos-Zellen im Vergleich zu Propidiumjodid. Es sind drei verschiedene Populationen zu erkennen.
4. Phosphatidylserin-Externalisierung
Ein Schlüsselmerkmal der Apoptose, das bereits in frühen Stadien nachweisbar ist, ist die Externalisierung von Phosphatidylserin (PS), einem Phospholipid, das in gesunden Zellen ausschließlich in der inneren Membran vorkommt. Annexin-V bindet Phosphatidylserin und Annexin-V-Konjugate können daher zur Bewertung der Apoptose verwendet werden. Diese Tests werden in der Regel mittels Durchflusszytometrie unter Verwendung von fluorophormarkiertem Annexin-V durchgeführt. Durch die Kombination dieses Farbstoffs mit einem beliebigen Lebensfähigkeitsfarbstoff wie PI können apoptotische Zellen von nekrotischen Zellen unterschieden werden. In diesen zweifarbigen Durchflusszytometrie-Experimenten lassen sich drei Populationen leicht unterscheiden: Annexin-V/PI doppelt-negative lebensfähige Zellen, Annexin-V-positive/PI-negative apoptotische Zellen und Annexin-V/PI doppelt-positive sekundäre nekrotische Zellen
(Abbildung 5).
Die Phosphatidylserin-Externalisierung ist ein dynamischer, reversibler Prozess, bis eine Zelle nach MOMP in die Apoptose übergeht. Mit Annexin-V-Konjugaten ist es unmöglich, frühe, reversible Stadien der Apoptose von den späteren Stadien der Apoptose zu unterscheiden, wenn eine Zelle dem Tod geweiht ist. Polaritätssensitive Indikatoren für Lebensfähigkeit und Apoptose (pSIVA-Sonden) sind Biosensoren, die PS reversibel binden und sich daher ein- und ausschalten, wenn PS von der äußeren zur inneren Membran wechselt (Abbildung 6). Ein weiterer Vorteil des pSIVA-Assays ist, dass die pSIVA-Sonden im Gegensatz zu Annexin-V-Konjugaten ohne Waschschritte direkt zu den Zellen gegeben werden können. Dieser Assay kann mit Hilfe der Immunzytochemie und der Immunfluoreszenzmikroskopie, einschließlich der Bildgebung von lebenden Zellen, abgelesen werden, was einen einfachen Vergleich der Unterschiede in den Apoptoseraten als Reaktion auf verschiedene experimentelle Behandlungen in Echtzeit ermöglicht. Da die Apoptose in Echtzeit überwacht wird, ist dieser Assay nicht mit fixierten Zellen kompatibel.
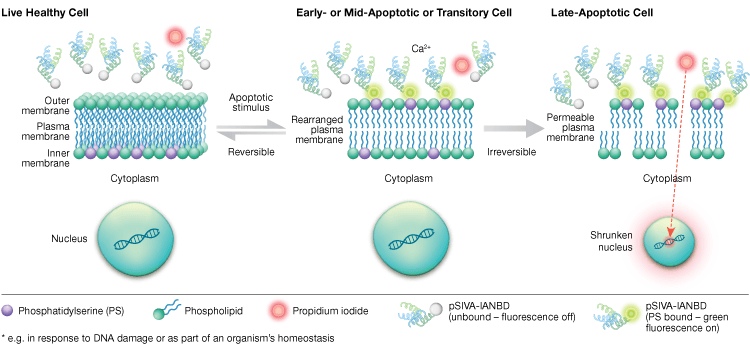
Abb. 6. Der pSIVA-Assay kann lebende, früh apoptotische und spät apoptotische Zellen unterscheiden, indem er die Externalisierung und Internalisierung von Phosphatidylserin in Echtzeit überwacht.
5. DNA-Fragmentierung
DNA-Fragmentierung ist eines der späteren Stadien der Apoptose und wird in der Regel durch den Nachweis von DNA-Leitern mit Hilfe der Agarose-Elektrophorese oder der TUNEL-Methode (terminal deoxynucleotidyl transferase dUTP nick end labeling) analysiert.
Ein entscheidendes Merkmal der Apoptose ist die Fragmentierung der DNA in ~180 bp-Fragmente durch Caspase-aktivierte Endonukleasen. Extrahierte genomische DNA auf einem Agarosegel zeigt daher charakteristische DNA-Leiter, die bei Zellen, die durch andere Mechanismen wie Nekrose absterben, nicht zu sehen sind.
Die TUNEL-Methode ist eine weitere Möglichkeit, die Bildung von Oligonukleosomen durch Caspase-aktivierte Endonuklease nachzuweisen. Bei der DNA-Spaltung entstehen 3′-Hydroxylgruppen (3′-OH-Gruppen). Beim TUNEL-Assay wird das Enzym terminale Desoxynukleotidyltransferase (TdT) verwendet, um BrdU an diese 3′-OH-Gruppen anzuhängen. Eingebundenes BrdU kann dann mit Anti-BrdU-Antikörpern, die mit Biotin oder einem Fluorophor markiert sind, nachgewiesen werden. Dieser Test ist mit der Durchflusszytometrie, der Immunhistochemie und der Immunfluoreszenz kompatibel und kann durch die Verwendung von -TdR anstelle von BrdU in ein Radiomarkierungsverfahren umgewandelt werden. Die Zellen müssen nach der BrdU-Inkorporation vor der Färbung fixiert werden.
Die DNA-Fragmentierung kann auch durchflusszytometrisch mit dem Sub-G1-Assay gemessen werden. Die kleinen, ~180 bp, DNA-Fragmente, die während der Apoptose entstehen, treten aus den Zellen aus, wodurch der Gesamt-DNA-Gehalt der apoptotischen Zellen sinkt. Durch Anfärben der DNA mit PI können hypodiploide apoptotische Zellen im Sub-G1-Peak des PI-Histogramms gezählt werden.
6. Multiplex-Apoptosemarker-Panels
Schließlich verkaufen viele Anbieter Panels für die Multiplex-Immunoassay-Analyse von Zellpopulationen. Mit diesen Panels können mehrere Apoptosemarker gleichzeitig getestet werden.
Unabhängig von der Methode, die zum Nachweis von Apoptose verwendet wird, müssen geeignete Kontrollen einbezogen werden, da die Versuchsbedingungen und der Zelltyp die Leistung einiger Assays verändern können. Es sind immer Positiv- und Negativkontrollen vorzusehen. Dazu gehören Kontrollen mit Vehikel, um die Auswirkungen der Lösungsmittel zu berücksichtigen, anwendungsspezifische Kontrollen, um Faktoren wie die Autofluoreszenz bei Immunfluoreszenzexperimenten zu kontrollieren, und Ladekontrollen für Western Blotting.
Tabelle 2. Zusammenfassung der Assays zum Nachweis von Apoptosemerkmalen.
| Apoptosestadium | Reagenzien für den Nachweis | Anwendung |
| PS flipping | Annexin-V-Konjugate, pSIVA-Sonden | Durchflusszytometrie, Mikroskopie |
| Signalkaskaden initiiert | FLICA, Caspase-Antikörper | Durchflusszytometrie, Mikroskopie, Western Blot |
| MOMP | TMRM, TMRE, JC-1 | Durchflusszytometrie, Mikroskopie, Mikroplatten-Reader |
| Zellschrumpfung | Durchflusszytometrie, Mikroskopie | |
| Membrane blebbing | Hämatoxylin + Eosin | Mikroskopie |
| Kernkondensation | DAPI, Hoechst, PI, 7-AAD | Mikroskopie |
| DNA-Fragmentierung | TUNEL, Sub-G1-Assay, DNA-Laddering | Agarosegel, Durchflusszytometrie, Mikroskopie |
| Phagozytose apoptotischer Körper | Acridinorange, Hämatoxylin + Eosin | Durchflusszytometrie, Licht- und Elektronenmikroskopie |