
Zuvor wurde die Wissenschaft hinter siliziumbasiertem Leben als Science Fiction bezeichnet. Siliziumverbindungen sind auf unveränderliche kristalline Anordnungen beschränkt, während Kohlenstoffverbindungen, d.h. organische Verbindungen, eine große Vielfalt von Molekülen bilden können, so dass jede stabile molekulare Anordnung spontan gebildet werden könnte und die natürliche Auslese jene Moleküle begünstigen würde, die Leben ermöglichen. Im präbiotischen Wettbewerb zwischen den Silizium- und Kohlenstoffbasen für das Leben würde höchstwahrscheinlich der Kohlenstoff dominieren. Betrachten wir jedoch die Alternative, bei der Wasser durch eine sehr bekannte, aber unwahrscheinliche Chemikalie ersetzt würde. Könnte Leben in einer Welt existieren, die von Ozeanen, Seen und Flüssen voller Ammoniak beherrscht wird?
Der Zusammenbruch
Ammoniak ist ein giftiger Stoff für Menschen, Insekten und sogar Bakterien. Es ist der Hauptbestandteil einiger industrieller Lösungs- und Reinigungsmittel und stellt eine Gefahr für die Umwelt dar. Ammoniak ist sogar ein wesentlicher Bestandteil eines Rezepts, das zur Herstellung von hochwirksamen Sprengstoffen verwendet wird. Wie könnte etwas so Tödliches wie Ammoniak die Entstehung und Entwicklung lebender Organismen ermöglichen? Ob Sie es glauben oder nicht, Ammoniak hat viele der gleichen molekularen Eigenschaften wie eine andere bekannte Verbindung, die für das Leben unerlässlich ist: Wasser. Einige Astrobiologen schlagen vor, dass sich Leben in einem ammoniakhaltigen Medium entwickeln könnte, so wie sich das Leben auf der Erde in einem wasserhaltigen Medium entwickelte. Stellen Sie sich vor: Dieselbe Substanz, von der bekannt ist, dass sie Metalle auflöst, die Haut verbrennt, die Umwelt verschmutzt und bei unsachgemäßer Vermischung in die Luft geht, könnte auf einigen außerirdischen Welten das „Wasser des Lebens“ sein (und ich spreche nicht von Dune).
Betrachten wir zunächst, warum Ammoniak ein möglicher Kandidat ist. Ammoniak und Wasser sind beide polare Moleküle. Die Elektronegativität der Sauerstoff- und Stickstoffatome ist größer als die Elektronegativität ihrer Wasserstoffgegenstücke. Der Unterschied in der Elektronegativität zwischen dem Zentralatom (ob Stickstoff oder Sauerstoff) und den Wasserstoffatomen bewirkt, dass die Moleküle polar werden. Das Zentralatom nimmt eine leicht negative Ladung an und die Wasserstoffatome werden leicht positiv. Dies macht Ammoniak und Wasser zu starken Lösungsmitteln, da sie Salze und kleine polare Moleküle auflösen können.
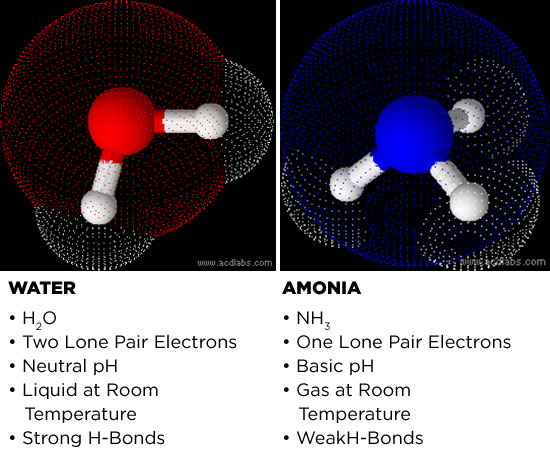
Einige der physikalischen Eigenschaften von Wasser sind auch bei Ammoniak vorhanden. Beide Medien können Elektrizität leiten, wenn auch nur schwach, und die Koordination von positiv geladenen Wasserstoffen mit negativ geladenen Teilen benachbarter Moleküle bildet eine der stärksten zwischenmolekularen Kräfte, die in der Chemie bekannt sind: die Wasserstoffbrückenbindung. Dies ist vergleichbar mit der elektrostatischen Bindung eines Objekts mit einer positiven Ladung an einem Ende an eine negative Ladung eines anderen Objekts. Um es mit den Worten des Laien auszudrücken: Wasserstoffbrückenbindungen ermöglichen es polaren Molekülen, sehr gut aneinander zu haften, was der Grund dafür ist, dass Wasser eine so hohe Oberflächenspannung und einen so hohen Siedepunkt hat.
In diesem Sinne ist Wasser ein vielseitiges Lösungsmittel: Es kann fast „alles“ lösen, und die Löslichkeit ist unter präbiotischen Bedingungen von wesentlicher Bedeutung. Es kann viele Salze und kleine, polare organische Moleküle wie Zucker und Aminosäuren auflösen. Die Löslichkeit von organischen Verbindungen und Salzen ist für das Leben sehr wichtig, da sie Reaktionsgemische puffert, um Änderungen des pH-Werts, des Salzgehalts und sogar der Oxidationsstufen zu widerstehen. Eine Umgebung, die das Leben am besten unterstützt, ist eine mit stabilen Konzentrationen essentieller Biomoleküle.
Ein weiteres sehr wichtiges Merkmal der physikalischen Eigenschaften von Wasser ist die hydrophobe Wirkung großer, unpolarer Verbindungen. Unpolare und polare Substanzen vermischen sich in Lösung nicht sehr gut, weshalb unpolare Moleküle dazu neigen, sich in einer Lösung aus polaren Molekülen zusammenzuballern. Mit anderen Worten: Unpolare Moleküle haften viel fester aneinander, wenn sie von polaren Molekülen umgeben sind.
Der hydrophobe Effekt ist für den Prozess der Abiogenese von entscheidender Bedeutung, da er die Bildung von Mizellen und Proteinen fördert. Ohne den hydrophoben Effekt könnten sich Lipide nicht zu Zellmembranen verbinden, und Aminosäurepolymere könnten sich nicht zu funktionellen Proteinen und Enzymen falten.
Auch wenn Ammoniak die Fähigkeit hat, Wasserstoffbrücken zu bilden, ist seine Polarität im Vergleich zu der von Wasser gering. Ammoniak ist weniger in der Lage, Wasserstoffbrücken zu bilden, und folglich sind auch die hydrophobe Wirkung und die Löslichkeit organischer Moleküle schwächer.
Dies stellt für die Abiogenese ein Problem dar. Kleine bioorganische Moleküle würden sich nicht sehr gut in Ammoniak lösen. Proteine und Membranen können in einer Ammoniaklösung instabil sein, weil sie sich möglicherweise nicht richtig falten. Membranen und Lipide sind ein noch größeres Problem: Wenn die Zellmembranen nicht ausreichend zusammenhalten, könnten die Zellen schon bei leichten Umweltveränderungen auseinanderbrechen. Das Leben wäre in einer Umgebung aus Ammoniak weniger anpassungsfähig als in einer Umgebung aus Wasser.
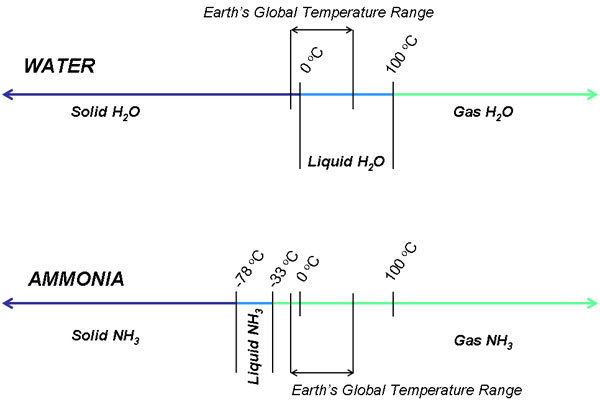
Die Stabilität von flüssigem Ammoniak selbst gibt Anlass zur Sorge. Theoretisch kann Leben nur in einer Flüssigkeit existieren, nicht in einem Gas oder einem Feststoff. Wenn es zu schnell oder zu leicht verdampft, kann es für die Organismen schwieriger werden, sich an die Umwelt anzupassen. Ammoniak liegt bei Raumtemperatur als Gas vor, während Wasser als Flüssigkeit in einem Temperaturbereich von 0 bis 100 Grad Celsius stabil ist. Das liegt an der Stärke der Wasserstoffbrückenbindungen: Je stärker die Wasserstoffbrückenbindungen sind, desto wahrscheinlicher ist es, dass die Moleküle lange genug zusammenbleiben, um zu einer Flüssigkeit zu kondensieren. Ammoniak hat eine schwache Wasserstoffbindung, weshalb die Temperatur unter normalem Atmosphärendruck drastisch gesenkt werden muss, um Ammoniak im flüssigen Zustand zu stabilisieren; wir sprechen hier von einer Welt, die eine 4 Milliarden Jahre dauernde Eiszeit durchmachen muss. Ein kalter, toter Planet ist kaum ein idealer Kandidat, um Leben zu beherbergen.

Oberfläche von Andoria.
Der Siedepunkt von Ammoniak liegt bei -33 Grad Celsius unter einem Druck von 14,7 psi, was bedeutet, dass flüssiges Ammoniak nur unterhalb dieser Temperatur bei dem atmosphärischen Druck der Erde stabil ist. Angenommen, die Faltung, Zusammenballung und Löslichkeit organischer Moleküle wäre thermodynamisch wahrscheinlich, dann müsste eine globale Temperatur von -78 Grad Celsius und -33 Grad bei 14,7 psi eingehalten werden. Dies ist ein zu enger Bereich für das Gedeihen von Organismen; jede leichte Klimaschwankung kann das Überleben von Leben auf Ammoniakbasis gefährden. Der Stoffwechsel der Nährstoffe und die Vermehrung der Organismen würden durch Perioden mit extremen Tiefst- und Höchstwerten gestört.
Die einzige Lösung für dieses Problem ist die Kondensation eines Gases bei höherem atmosphärischen Druck statt bei niedrigerer Temperatur. Gas kann unter extremem Druck zu einer Flüssigkeit kondensiert werden, und die Temperatur kann weit über dem normalen Siedepunkt gehalten werden (was eine gute Nachricht für ein ammoniakhaltiges Klima ist, in dem das Leben Wärme braucht, um zu gedeihen). Ammoniak kondensiert unter einem Druck, der 12,1 Tausend Erdatmosphären entspricht, bei etwa 37 Grad Celsius zu einer Flüssigkeit. Leider haben wir noch keine Möglichkeit entdeckt oder Hypothesen aufgestellt, wie ein Planet eine derart dichte Atmosphäre beherbergen könnte. Die Venus, ein terrestrischer Planet mit der dichtesten heute bekannten Atmosphäre, hat einen Druckwert von 93 bar an der Oberfläche; dies entspricht kaum der atmosphärischen Anforderung von 12.000 bar. Jupiter, die nächstbeste Wahl, hat nur einen Maximaldruck von etwa 1000 bar im Zentrum des Planeten; auch dies ist für unsere Zwecke kaum ideal. Es ist unwahrscheinlich, dass auf ähnlichen Planeten der Atmosphärendruck hoch genug ist, um Ammoniak zu einer Flüssigkeit zu kondensieren, was jedoch nicht bedeutet, dass Leben auf Ammoniakbasis nicht auf andere Weise entstehen kann.
Das abschließende Urteil
Ammoniakbasiertes Leben ist kein Hauptthema von Star Trek, und ich habe mich immer gefragt, warum es nie in die Serie aufgenommen wurde. Leider ist es unwahrscheinlich, dass es ein Science Fact ist. Es ist wichtig, darauf hinzuweisen, dass viele Dinge, die in der Wissenschaft zunächst für unmöglich gehalten wurden, schließlich von der Wissenschaft bewiesen wurden, zumindest bis zu einem gewissen Grad. Wie ich in meinen Artikeln immer wieder betone: Nur weil etwas höchst unwahrscheinlich erscheint, heißt das nicht, dass es nicht möglich ist. Wir müssen erst noch Leben auf Ammoniakbasis oder überhaupt Leben anderswo entdecken, bevor irgendjemand, auch ich, sagen kann, dass es ammoniakhaltige Außerirdische geben kann oder nicht. In Ermangelung absoluter Beweise sind Spekulationen das Beste, worauf wir hoffen können.
In diesem Sinne möchte ich mit diesem großartigen Auszug aus Carl Sagans Cosmos schließen, in dem er ein wahrscheinliches Szenario entwirft, in dem sich Leben auf einer Welt wie dem Jupiter entwickeln könnte.
Gerade weil etwas unwahrscheinlich erscheint, sind wir in der Wissenschaft immer wieder erstaunt, dass manchmal, egal wie unwahrscheinlich, das Gegenteil der Fall ist. Selbst wenn Organismen auf Ammoniakbasis nach unseren irdischen Maßstäben nicht existieren, bedeutet das noch lange nicht, dass sie nicht auch auf andere Weise entstehen können.
Tom Caldwell hat einen Bachelor of Science in Biochemie von der UCLA. Derzeit arbeitet er an seinem Doktorat in Molekularbiologie.