08. August 2019
Wenn man ApoE und Alzheimer erwähnt, dreht sich das Gespräch um das E4-Allel, das stärkste Anfälligkeitsgen für die Krankheit. Aber ApoE hat auch eine andere Seite, nämlich ApoE2. Obwohl diese Isoform vor Alzheimer schützt, haben Wissenschaftler sie kaum untersucht. Jetzt wird ApoE2 genauer unter die Lupe genommen, denn die Wissenschaftler fragen sich, wie manche Menschen ihre geistige Schärfe bis ins hohe Alter bewahren. Auf der Alzheimer’s Association International Conference, die vom 14. bis 18. Juli in Los Angeles stattfand, zeigte eine Studie über die ApoE-Genotypen in 5.000 durch Autopsie bestätigten Fällen von Alzheimer, dass bei Menschen mit zwei Kopien von E2 das Demenzrisiko um atemberaubende 90 Prozent sinkt, verglichen mit Menschen mit dem üblichen E3/E3-Genotyp. Andere Arbeiten deuten darauf hin, dass dies darauf zurückzuführen sein könnte, dass ApoE2 die Amyloid- und Tau-Pathologie reduziert und das Volumen der grauen Substanz in kritischen Gehirnregionen erhöht. Die Vorteile von E2 scheinen spezifisch für die Alzheimer-Krankheit und nicht allgemein für die Neurodegeneration zu sein.
ApoE ist das wichtigste Cholesterin-tragende Protein im Gehirn. Es wurde seit seiner Entdeckung als Alzheimer-Risiko-Gen in den frühen 1990er Jahren untersucht, doch seit kurzem wird es als Drehscheibe für gliale Reaktionen auf die Ablagerung von Amyloid- und Tau-Aggregaten entdeckt (Aug 2018 news; Sept 2017 news). Das Gen existiert in drei polymorphen Allelen – E2, E3 und E4 – mit einer weltweiten Häufigkeit von 8 Prozent, 78 Prozent bzw. 14 Prozent. Es sind auch mehrere mutierte Formen bekannt, zum Beispiel die sogenannten Heidelberg-, Pittsburgh- und Christchurch-Mutationen (Feussner et al., 1992; Kamboh et al., 1999; Wardell et al., 1987).
ApoE4 wird von den Alzheimer-Forschern bei weitem am meisten beachtet, da es das Alzheimer-Risiko je nach Studienpopulation um das bis zu 15-fache erhöht und bei 40 Prozent der Menschen mit Alzheimer auftritt. E2, das schützende Allel, wurde bisher kaum beachtet, da es das am wenigsten verbreitete der drei Allele ist und in AD-Proben weitgehend fehlt. Menschen mit einer Kopie von E2 haben ein halb so hohes Risiko, an Alzheimer zu erkranken, wie Menschen mit dem häufigeren Genotyp E3/E3. Aber hat das zusätzliche E2 eine darüber hinausgehende Wirkung? „Wir wussten nicht, ob die E2-Dosis ein unterschiedliches Risiko mit sich bringt, d. h. ob das E2/2-Risiko signifikant niedriger ist als das E2/3-Risiko“, sagte Eric Reiman bei der Vorstellung der Studie.
Um das herauszufinden, beschlossen Reiman und seine Kollegen vom Banner Alzheimer’s Institute, Phoenix, Gyungah Jun von der Boston University, Joseph Arboleda vom Massachusetts Eye and Ear, Yakeel Quiroz vom Massachusetts General Hospital und Kollegen vom AD Genetics Consortium, die Daten von vielen Gehirnen zu untersuchen. Sie analysierten den Beitrag aller drei ApoE-Allele zum Demenzrisiko und zur Pathologie in 5.007 Gehirnen des ADGC. Diese Stichprobe umfasste 4.018 durch Autopsie bestätigte Alzheimer-Demenzfälle sowie 989 pathologisch und kognitiv nicht betroffene Spender. Diese Kohorte bietet nicht nur eine ausreichende Anzahl von E2/E2-Homozygoten, sondern vermeidet auch das Problem der Fehldiagnose, da Demenzerkrankungen, die nicht auf Alzheimer zurückzuführen sind, sowie Personen, die zum Zeitpunkt des Todes eine Alzheimer-Pathologie, aber keine Demenz aufwiesen, ausgeschlossen wurden.
Wie erwartet waren ApoE2-Homozygoten selten – nur 24 von mehr als 5.000 Personen oder 0,5 Prozent. Im Vergleich zu anderen Genotypen war die Wahrscheinlichkeit, an Alzheimer zu erkranken, bei ihnen deutlich geringer. E2-Homozygote machten 0,1 Prozent der Fälle, aber 1,9 Prozent der gesunden Kontrollen aus. Im Gegensatz dazu machten ApoE4/4-Homozygote 15,6 Prozent der Fälle und nur 1 Prozent der Kontrollen aus. Mit anderen Worten: 19 der 24 ApoE2/2-Träger waren kognitiv gesund, aber nur 10 von 633 ApoE4/4-Trägern.
E2-Homozygote hatten eine 66-prozentige Risikoreduktion, sogar im Vergleich zu E2/3-Trägern, eine 87-prozentige Risikoreduktion im Vergleich zum häufigsten Genotyp, E3/3, und eine satte 99,6-prozentige Risikoreduktion im Vergleich zu Personen mit E4/4. Grundsätzlich erkranken die meisten Menschen mit E4/4 an Alzheimer-Demenz, während nur wenige mit ApoE 2/2 daran erkranken.
Der Besitz von zwei E2-Allelen korreliert mit weniger Amyloid-Plaque und Tau-Neurofibrillen-Wirrwarr-Pathologie. Die schützende Wirkung von ApoE2 auf die Tau-Pathologie war auch dann noch erkennbar, wenn die Amyloid-Plaque-Belastung berücksichtigt wurde. Dies spiegelt jüngste Tierdaten wider, die darauf hindeuten, dass ApoE4 die Tau-Pathologie unabhängig von Amyloid verschlechtert (Shi et al., 2017).
Das Hauptergebnis der neuen Studie spiegelt die Ergebnisse einer früheren Studie von Pieter-Jelle Visser, Universität Maastricht, Niederlande, und Kollegen wider. Sie hatten in einer Stichprobe von 7.583 Personen 16 ApoE2/2-Träger gefunden, von denen 10 kognitiv normal und amyloid-negativ waren, während 301 der 386 ApoE4/4-Träger in der Stichprobe an Alzheimer-Demenz erkrankten. Diese Stichprobe wurde jedoch nicht pathologisch bestätigt (Jansen et al., 2015).
Wie wichtig ist eine neuropathologische Bestätigung? Reiman et al. verglichen die aus der autopsiebestätigten Kohorte abgeleiteten Risikoschätzungen mit denen, die aus einer Kohorte von 23 857 lebenden Personen berechnet wurden, bei denen klinisch eine wahrscheinliche Alzheimer-Demenz diagnostiziert wurde oder die kognitiv normal waren und deren Amyloid-Status unbekannt war. In dieser Analyse wurden sowohl die schützende Wirkung von 2/2 als auch das erhöhte Risiko aufgrund von 4/4 unterschätzt. So fanden die Wissenschaftler beispielsweise heraus, dass das Chancenverhältnis zwischen E4/E4 und E3/E3 in der klinischen Stichprobe 10,7 betrug, während es bei den pathologisch bestätigten Fällen 31,22 betrug. Auch die Dosiseffekte für E2 und E4 wurden in der lebenden Stichprobe unterschätzt. Daher liefert die Autopsieanalyse aktualisierte und wahrscheinlich genauere Risikoschätzungen für alle ApoE-Genotypen, so Reiman und Kollegen, zumindest für diese nicht-hispanischen weißen Forschungsteilnehmer.
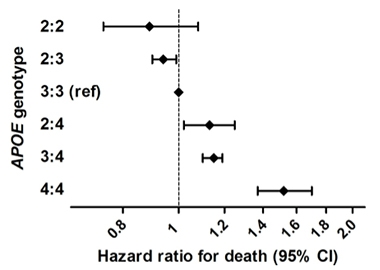
Lebensverlängernd. In einer großen epidemiologischen Studie, die sechs bevölkerungsbasierte Kohorten von Menschen europäischer Abstammung zusammenfasste, hatten ApoE2-Homozygoten ein geringeres Sterberisiko als andere Genotypen. ApoE4-Homozygote hatten das höchste Risiko.
Der Einfluss von ApoE auf die Alzheimer-Krankheit unterscheidet sich bekanntermaßen zwischen ethnischen Gruppen. Diese Art von Studie ist notwendig, um mehr unterschiedliche Probanden, mehr E2/2-Homozygote und mögliche Auswirkungen der ApoE-Allele auf das Überleben zu berücksichtigen, die die Ergebnisse verfälschen könnten. Dennoch sagte Reiman: „Unsere Ergebnisse deuten darauf hin, dass die ApoE2-Homozygotie mit einem außergewöhnlich niedrigen Alzheimer-Risiko verbunden ist, dass der Einfluss von APOE und seinen Varianten auf das Alzheimer-Risiko deutlich größer ist als bisher angenommen, und dass es einen zwingenden Grund gibt, Behandlungen zu entdecken, die diese schützende Wirkung fördern.“
Das deckt sich mit den jüngsten Ergebnissen von Sudha Seshadri, University of Texas Health, San Antonio, Frank Wolters, Erasmus Medical Center, Rotterdam, Niederlande, und Kollegen. In einer Studie mit 38.537 Personen aus sechs bevölkerungsbasierten Kohorten fanden sie einen Überlebensvorteil für ApoE2-Träger (Wolters et al., 2019). Sie identifizierten 239 E2-Homozygote, die am längsten lebten. Die Wirkung von E2 wurde nur teilweise durch seine Auswirkungen auf die Blutfette oder Gefäßerkrankungen erklärt. E4-Homozygote hatten das höchste Sterberisiko, was weitgehend auf die Assoziation mit Demenz zurückzuführen war. Seshadri erklärte gegenüber Alzforum, dass die Forscher AD und kognitive Veränderungen sowie Amyloid- und Tau-PET-Messungen in dieser Stichprobe untersuchen werden.
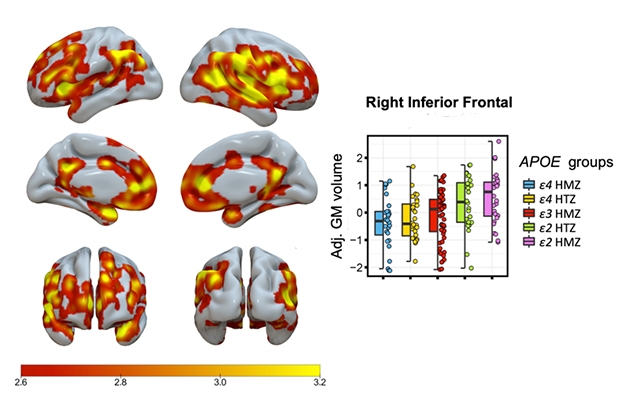
Bit für Bit. Die Schattierung zeigt Bereiche mit einer signifikanten schrittweisen, mit dem ApoE-Genotyp zusammenhängenden Zunahme des Volumens der grauen Substanz an, wobei E4/4-Homozygote das geringste und E2/2-Homozygote das höchste Volumen aufweisen. Die Grafik zeigt Daten für eine Gehirnregion.
Wie kann ApoE2 die Widerstandsfähigkeit fördern? Um das herauszufinden, präsentierte Gemma Salvadó, Barcelonaβeta Brain Research Center, Spanien, eine Studie, in der sie und Koautoren Bildgebungsdaten aus verschiedenen Proben von so vielen älteren ApoE2-Homozygoten wie möglich zusammenstellten. Ihr Ziel war es, die Gehirnstruktur von E2/2-Trägern mit der anderer ApoE-Genotypen zu vergleichen.
Bisher wurde E2 mit subtilen Veränderungen der Gehirnmorphologie bei gesunden Menschen in Verbindung gebracht, darunter eine langsamere Hippocampus-Atrophie im Alter und größere Hippocampi im mittleren Alter (Chiang et al., 2010; Fennema-Notestine et al., 2011). In der Kindheit wurde berichtet, dass E2-Träger dickere entorhinale Kortexe haben als E3-Homozygoten oder E4-Träger (Shaw et al., 2007). Diese Studien konzentrierten sich jedoch alle auf Menschen mit einer E2-Kopie.
Um herauszufinden, was dieses zusätzliche E2 bewirken würde, sammelte und analysierte Salvadó MRT-Daten von kognitiv nicht beeinträchtigten Menschen aus der ALFA-Studie in Barcelona (Molinuevo et al. 2016), der Kohorte des Amsterdam University Medical Center, den frei zugänglichen OASIS-Bildgebungsstudien und ADNI. Sie fand 28 E2/E2-Homozygote. Sie glich jeden von ihnen mit fünf anderen Probanden desselben Zentrums in Bezug auf Alter, Geschlecht und Bildungsstand sowie mit einem von jedem anderen ApoE-Genotyp ab. Das ergab insgesamt 168 Probanden mit einem Durchschnittsalter von 62 Jahren.
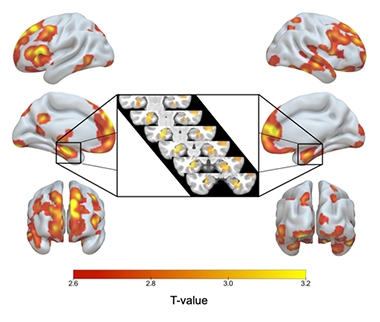
ApoE2/2 über 3/3. Die rote bis gelbe Schattierung zeigt Hirnregionen an, in denen ApoE2-Homozygoten mehr graue Substanz hatten als E3-Homozygoten, einschließlich beider Hippocampi (Inset).
Im Vergleich zu den E3/3-Homozygoten wiesen die E2/2-Homozygoten ein größeres Volumen an grauer Substanz im Hippocampus und in anderen für AD charakteristischen Bereichen auf, einschließlich des medialen temporalen Kortex, des inferioren temporalen, temporalen Pols, des Precuneus und der superioren parietalen Regionen. E2-Homozygote wiesen auch mehr graue Substanz in Bereichen auf, die mit der kognitiven Widerstandsfähigkeit im Alter zusammenhängen, nämlich in den anterioren cingulären und medialen präfrontalen Bereichen (Arenaza-Urquijo et al., 2019; Harrison et al., 2018). Im Vergleich zu E2/3-Heterozygoten wiesen die E2-Homozygoten nur wenige signifikante Unterschiede in der grauen Substanz auf, aber sie hatten einen noch größeren Hippocampus als die 2/3er.
Salvadó berichtete über eine stufenweise, genotypbezogene Zunahme des Volumens der grauen Substanz, wobei E4/4-Homozygote das geringste, E3/3 das mittlere, E2/3 das höhere und E2/2 das höchste Volumen aufwiesen (siehe Abbildung unten).

ApoE2/2 über 2/3. Verglichen mit dem nächst-protektiveren Genotyp, ApoE2/3, haben E2-Homozygote nur in einigen kleinen Bereichen mehr graue Substanz.
Sie glaubt, dass die größere graue Substanz in strategischen Hirnbereichen den E2-Homozygoten helfen könnte, mit der Alzheimer-Pathologie fertig zu werden, falls und wenn sie auftritt. Da ApoE2 den entorhinalen Kortex bereits in der Kindheit aufpolstert, könnte die Widerstandsfähigkeit auf Entwicklungsprozesse zurückzuführen sein, sagte sie.
„Dies sind sehr wichtige Ergebnisse“, kommentierte Reiman. „Sie deuten darauf hin, dass, wenn Atrophie wie die Erosion des Reifenprofils ist, E2-Homozygote mit mehr Profil beginnen könnten“, sagte er. Salvadó versucht, die Studie zu erweitern, um mehr Homozygote aus zusätzlichen Kohorten und andere Bildgebungsverfahren zu untersuchen.
Terry Goldberg, Columbia University, New York, untersucht seit Jahren mögliche Mechanismen der ApoE2-vermittelten Neuroprotektion (Conejero-Goldberg et al., 2014). Auf der AAIC präsentierte Goldberg Ergebnisse über die Beziehung zwischen ApoE-Allelen und Neuropathologie bei Alzheimer und weitete die Analyse auf andere Krankheiten aus.
Er verwendete Daten von 1.557 Gehirnen aus der Datenbank des National Alzheimer’s Coordinating Center, die sowohl klinische als auch neuropathologische Bewertungen enthielten. Da er nur so wenige E2-Homozygote hatte, fasste Goldberg die Genotypen E2/E2 und E2/E3 in einer Gruppe von 130 zusammen. In dieser kombinierten Gruppe wies eines von vier Gehirnen neuropathische AD-Veränderungen auf, verglichen mit 40 Prozent der E3/3-, 65 Prozent der E3/4- und 85 Prozent der E4/4-Patienten. In Übereinstimmung mit früheren Arbeiten wiesen die E2-Träger die mildeste Amyloid-Pathologie, die wenigsten neuritischen Plaques und die mildeste Tau-Pathologie auf. Eine statistische Mediationsanalyse deutete darauf hin, dass die Assoziation von ApoE2 mit einer geringeren Anzahl von Tangles zum Teil durch seine Wirkung auf Amyloid zustande kam und zum Teil unabhängig von Amyloid war. Das deckt sich mit den Ergebnissen von Reiman.
Auch in diesem Datensatz schützte ApoE2 stark, auch wenn Goldberg die Homozygoten nicht analysierte: E2 senkte das Risiko für Amyloid- und Tau-Pathologie um die Hälfte im Vergleich zu E3 und um 90 Prozent im Vergleich zu E4.
Welcher Schutz ist stärker, E2 oder E4? Beim Vergleich der Genotypen E2/E4 und E3/E4 stellte Goldberg ein vergleichbares Ausmaß an Pathologie fest. Wenn überhaupt, dann war die E2/E4-Paarung schlechter. Dies deutet darauf hin, dass E4 die schützende Wirkung von E2 aufhebt. „Man könnte sagen, dass E4 toxisch ist“, so Goldbergs Schlussfolgerung. Das deutet darauf hin, dass Therapien, bei denen virale Konstrukte verwendet werden, um E2 in E4-exprimierendes Hirngewebe einzubringen, möglicherweise nicht hilfreich sind, sagte er.
Wie sieht es mit anderen neurodegenerativen Erkrankungen aus?
Die Literatur bietet gemischte Ergebnisse zu E2 und E4 bei frontotemporaler Demenz. Einige Studien deuten darauf hin, dass E2 das Risiko erhöht (März 2016), während andere Studien ihm einen Schutz zuschreiben und das Risiko auf E4 schieben (Mishra et al., 2017). Auf der AAIC berichtete Goldberg, dass E2 bei 103 Fällen von frontotemporaler Demenz mit einer schwereren TDP-43-Pathologie und bei 28 Fällen von Morbus Pick und 51 Fällen von progressiver supranukleärer Lähmung mit einer stärkeren Tau-Pathologie verbunden war. Er gab zu bedenken, dass diese Zahlen so klein sind, dass die Ergebnisse verfälscht sein könnten. Goldberg weiß nicht, ob diese Patienten C9ORF72- oder Progranulin-Mutationen aufwiesen, und die TDP-43-Akkumulation kann altersabhängig sein. In Fällen von α-Synuclein-Pathologie fand Goldberg heraus, dass ApoE4 die Ausbreitung der Lewy-Körperchen-Pathologie außerhalb ihres Ursprungs im Mittelhirn in limbische und neokortikale Bereiche fördert und E2 diese reduziert
Zusammengenommen unterstreichen diese Studien eine erneute Würdigung des enormen Einflusses, den ApoE auf die Pathogenese der Alzheimer-Krankheit ausübt (siehe zum Beispiel Wu und Zhao, 2016). Der tiefgreifende Schutz, den E2 bietet, wird wahrscheinlich das Interesse von Medikamentenentwicklern neu entfachen, die es schon einmal versucht haben und gescheitert sind, nun aber vielleicht dieses Ziel erneut ins Visier nehmen wollen.-Pat McCaffrey
Nachrichten Zitate
- ApoE: Gemeinsamer mikroglialer Schuldiger bei Alterung, Alzheimer und Tauopathie? 11 Aug 2018
- ApoE4 macht alles Tau schlimmer, von Anfang bis Ende 20 Sep 2017
- Et Tu, ApoE2? Paper Claims Allel Boosts Risk for Dementia-in ALS 1 Mar 2016
Paper Citations
- Feussner G, Funke H, Weng W, Assmann G, Lackner KJ, Ziegler R.Severe type III hyperlipoproteinemia associated with unusual apolipoprotein E1 phenotype and epsilon 1/’null‘ genotype. Eur J Clin Invest. 1992 Sep;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST.A novel mutation in the apolipoprotein E gene (APOE*4 Pittsburgh) is associated with the risk of late-onset Alzheimer’s disease. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoprotein E2-Christchurch (136 Arg—-Ser). Neue Variante des menschlichen Apolipoproteins E bei einem Patienten mit Hyperlipoproteinämie Typ III. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.ApoE4 verschlimmert die Tau-vermittelte Neurodegeneration in einem Mausmodell der Tauopathie deutlich. Nature. 2017 Sep 28;549(7673):523-527. Epub 2017 Sep 20. PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Prävalenz der zerebralen Amyloid-Pathologie bei Personen ohne Demenz: eine Meta-Analyse. JAMA. 2015 May 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE investigators.Der Einfluss des APOE-Genotyps auf das Überleben: Ergebnisse von 38.537 Teilnehmern aus sechs bevölkerungsbasierten Kohorten (E2-CHARGE). PLoS One. 2019;14(7):e0219668. Epub 2019 Jul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .Hippocampal atrophy rates and CSF biomarkers in elderly APOE2 normal subjects. Neurology. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.Presence of ApoE ε4 allele associated with thinner frontal cortex in middle age. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN.Cortical morphology in children and adolescents with different apolipoprotein E gene polymorphisms: an observational study. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.The ALFA project: Eine Forschungsplattform zur Identifizierung früher pathophysiologischer Merkmale der Alzheimer-Krankheit. Alzheimers Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3. PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P.The metabolic brain signature of cognitive resilience in the 80+: beyond Alzheimer pathologies. Brain. 2019 Apr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ.Brain morphology, cognition, and β-amyloid in older adults with superior memory performance. Neurobiol Aging. 2018 Jul;67:162-170. Epub 2018 Mar 27. PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE.APOE2 enhances neuroprotection against Alzheimer’s disease through multiple molecular mechanisms. Mol Psychiatry. 2014 Feb 4; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium.Gene-based association studies report genetic links for clinical subtypes of frontotemporal dementia. Brain. 2017 Apr 5; PubMed.
- Wu L, Zhao L.ApoE2 and Alzheimer’s disease: time to take a closer look. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
Weitere Lektüre
Keine weitere Lektüre verfügbar