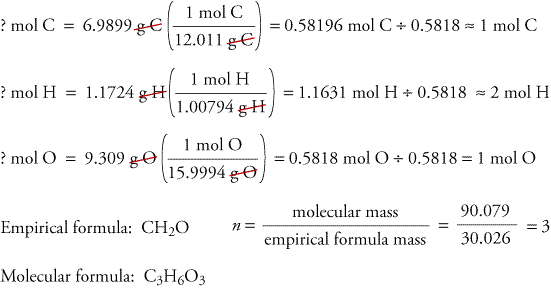Erstellen von empirischen und molekularen Formeln aus Verbrennungsdaten
Empirische und molekulare Formeln für Verbindungen, die nur Kohlenstoff und Wasserstoff (CaHb) oder Kohlenstoff, Wasserstoff und Sauerstoff (CaHbOc) enthalten, können mit einem Verfahren namens Verbrennungsanalyse bestimmt werden. Die Schritte für dieses Verfahren sind
Wiegen Sie eine Probe der zu analysierenden Verbindung ab und geben Sie sie in die in der Abbildung unten gezeigte Apparatur.
Verbrennt die Verbindung vollständig. Die einzigen Produkte der Verbrennung einer Verbindung, die nur Kohlenstoff und Wasserstoff (CaHb) oder Kohlenstoff, Wasserstoff und Sauerstoff (CaHbOc) enthält, sind Kohlendioxid und Wasser.
Das H2O und das CO2 werden durch zwei Röhren gezogen. Ein Rohr enthält einen Stoff, der Wasser absorbiert, das andere einen Stoff, der Kohlendioxid absorbiert. Wiegen Sie jedes dieser Rohre vor und nach der Verbrennung. Die Massenzunahme im ersten Rohr ist die Masse des H2O, das sich bei der Verbrennung gebildet hat, und die Massenzunahme im zweiten Rohr ist die Masse des gebildeten CO2.
Angenommen, der gesamte Kohlenstoff der Verbindung wurde in CO2 umgewandelt und im zweiten Rohr eingeschlossen. Berechnen Sie die Masse des Kohlenstoffs in der Verbindung aus der Masse des Kohlenstoffs in der gemessenen Masse des gebildeten CO2.
Angenommen, der gesamte Wasserstoff in der Verbindung wurde in H2O umgewandelt und in der ersten Röhre eingeschlossen. Berechne die Masse des Wasserstoffs in der Verbindung aus der Masse des Wasserstoffs in der gemessenen Masse des Wassers.
Wenn die Verbindung sowohl Sauerstoff als auch Kohlenstoff und Wasserstoff enthält, berechne die Masse des Sauerstoffs, indem du die Masse des Kohlenstoffs und des Wasserstoffs von der Gesamtmasse der ursprünglichen Probe der Verbindung abziehst.
Benutze diese Daten, um die empirischen und molekularen Formeln auf die übliche Weise zu bestimmen.
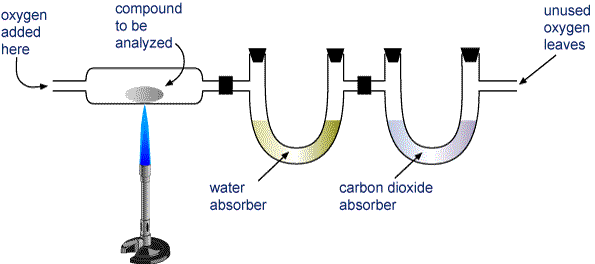
Gerät zur Verbrennungsanalyse Eine Verbindung, die Kohlenstoff und Wasserstoff (CaHb) oder Kohlenstoff, Wasserstoff und Sauerstoff (CaHbOc) enthält, wird vollständig verbrannt, wobei H2O und CO2 entstehen. Die Produkte werden durch zwei Rohre gezogen. Die erste Röhre absorbiert Wasser, die zweite Röhre absorbiert Kohlendioxid.
Um zu veranschaulichen, wie empirische und molekulare Formeln aus den Daten der Verbrennungsanalyse bestimmt werden können, betrachten wir eine Substanz namens Trioxan. Formaldehyd, CH2O, ist als reines Gas instabil und bildet leicht ein Gemisch aus einer Substanz namens Trioxan und einem Polymer namens Paraformaldehyd. Aus diesem Grund wird Formaldehyd in einem Lösungsmittel wie Wasser gelöst, bevor es verkauft und verwendet wird. Die Summenformel von Trioxan, das Kohlenstoff, Wasserstoff und Sauerstoff enthält, kann anhand der Daten aus zwei verschiedenen Experimenten bestimmt werden. Im ersten Versuch werden 17,471 g Trioxan in der oben gezeigten Apparatur verbrannt, wobei 10,477 g H2O und 25,612 gCO2 entstehen. Im zweiten Versuch wird die Molmasse von Trioxan mit 90,079 bestimmt.
Die Summenformel einer Verbindung erhält man aus ihrer Summenformel und ihrer Molmasse. (Um die empirische Formel zu erhalten, müssen wir die Masse in Gramm des Kohlenstoffs, des Wasserstoffs und des Sauerstoffs in 17,471 g Trioxan bestimmen. Daher müssen wir die folgenden allgemeinen Schritte durchführen.
Erst rechne aus den gegebenen Daten in Gramm Kohlenstoff, Wasserstoff und Sauerstoff um.
Zweitens bestimme die empirische Formel aus den Gramm Kohlenstoff, Wasserstoff und Sauerstoff.
Drittens bestimme die Summenformel aus der empirischen Formel und der gegebenen Molmasse.
Da wir davon ausgehen, dass der gesamte Kohlenstoff im Trioxan zu CO2 reagiert hat, können wir die Masse des Kohlenstoffs in 17,471 g Trioxan ermitteln, indem wir die Masse des Kohlenstoffs in 25,612 g CO2 berechnen.

Da wir davon ausgehen, dass der gesamte Wasserstoff im Trioxan zu H2O reagiert hat, können wir die Masse des Wasserstoffs in 17,471 g Trioxan ermitteln, indem wir die Masse des Wasserstoffs in 10.477 g H2O.

Da Trioxan nur Kohlenstoff, Wasserstoff und Sauerstoff enthält, können wir die Masse des Sauerstoffs berechnen, indem wir die Massen von Kohlenstoff und Wasserstoff von der Gesamtmasse des Trioxans abziehen.
? g O = 17,471 g Trioxan – 6,9899 g C – 1,1724 g H = 9.309 g O
Wir berechnen nun die Summenformel, die Masse der Summenformel und die Summenformel.
BeispielStudienblatt: Berechnung von Molekülformeln aus Verbrennungsdaten
Tipp: Sie wollen die Molekülformel einer Verbindung berechnen, die nur Kohlenstoff und Wasserstoff (CaHb) oder Kohlenstoff, Wasserstoff und Sauerstoff (CaHbOc) enthält, und Sie erhalten die Molekülmasse und die Massen von CO2 und H2O, die bei der Verbrennung einer bestimmten Masse der Verbindung gebildet werden.
AllgemeinesVorgehen
Berechnen Sie die Anzahl der Gramm Kohlenstoff in der Verbindung, indem Sie die Anzahl der Gramm Kohlenstoff in der gegebenen Menge CO2 berechnen.

Berechnen Sie die Anzahl der Gramm Wasserstoff in der Verbindung, indem Sie die Anzahl der Gramm Wasserstoff in der gegebenen Menge H2O berechnen.

Wenn die Verbindung Sauerstoff enthält, berechnen Sie die Anzahl der Gramm Sauerstoff in der Verbindung, indem Sie die Massen von Kohlenstoff und Wasserstoff von der gegebenen Gesamtmasse der Verbindung abziehen.
? g O = (gegeben) g gesamt – (berechnet) g C – (berechnet) g H
Berechnen Sie die Summenformel der Verbindung aus den Gramm Kohlenstoff, Wasserstoff und Sauerstoff.
Berechnen Sie die Formelmasse für die Summenformel und dividieren Sie die gegebene Molekülmasse durch die Summenformelmasse, um n zu erhalten.
Multiplizieren Sie jede der tiefgestellten Zahlen in der Summenformel mit n, um die Summenformel zu erhalten.
BEISPIEL – Ermitteln einer Summenformel aus Verbrennungsdaten:
Dianabol ist eines der anabolen Steroide, das von einigen Athleten verwendet wurde, um die Größe und Stärke ihrer Muskeln zu erhöhen. Es ist ähnlich wie das männliche Hormon Testosteron. Einige Studien deuten darauf hin, dass die erwünschten Wirkungen des Medikaments minimal sind, und die Nebenwirkungen, die Sterilität und ein erhöhtes Risiko für Leberkrebs und Herzerkrankungen einschließen, halten die meisten Menschen davon ab, es zu verwenden. Die Molekularformel von Dianabol, die aus Kohlenstoff, Wasserstoff und Sauerstoff besteht, kann anhand der Daten aus zwei verschiedenen Experimenten bestimmt werden. Im ersten Experiment werden 14,765 g Dianabol verbrannt, wobei 43,257 g CO2 und 12,395 g H2O entstehen. Im zweiten Experiment wird die Molekülmasse von Dianabol mit 300,44 angegeben. Wie lautet die Summenformel für Dianabol?
Lösung: