Angesichts der Fülle von Funktionen, die ein Bioreaktor erfüllen muss, fragen Sie sich vielleicht, wie er das alles schaffen kann. Welche Komponenten braucht er? Woher wissen Sie, welche Bedingungen im Bioreaktor herrschen und wie Sie sie korrigieren können? Und schließlich, nur für die Perspektive: Wie nimmt man die Daten, die während eines Batch-Bioprozesses erfasst werden, stellt sie sinnvoll dar, speichert sie und wertet sie aus, während man sie organisiert?
Die wichtigsten Prozessparameter und die Mechanismen zu ihrer Regulierung werden im Folgenden behandelt:
- Kulturmischung
- Temperaturregelung
- pH-Regelung
- Nährstoffzufuhr
- Begasung
- Druck Kontrolle
- Vermeidung von Schaumbildung
Kulturdurchmischung
Die Kultur in einem Bioreaktor muss immer gut durchmischt werden. Wenn die Nährstoffe im Bioreaktor nicht gut genug dispergiert werden, weichen die Bedingungen in bestimmten Teilen des Bioreaktors erheblich vom Ideal ab. Der pH-Wert könnte beispielsweise zu sauer sein, oder die Nährstoffzufuhr könnte unzureichend sein. Solche Abweichungen verringern nicht nur die Effizienz des geplanten Bioprozesses, sondern können auch genetische Veränderungen fördern. Ein weiteres Problem stellt die Temperaturverteilung dar. Ohne gleichmäßiges Umrühren werden die Mikroorganismen oder Zellkulturen am Rand des Gefäßes buchstäblich gekocht, während die in der Mitte kalte Füße bekommen. Wenn Sie schon einmal eine Suppe in der Mikrowelle erwärmt und dann mit großer Vorfreude gegessen haben, ohne sie umzurühren, wissen Sie, was wir meinen.
Die typische Rührgeschwindigkeit variiert unter anderem je nach Kulturorganismus:
| Organismus | Rührgeschwindigkeit | ||||
| Bakterien, Hefe, Pilze | 500 – 1500 min-1 | ||||
| Säugetier, Insekten- oder Pflanzenzellen | 30 – 300 min-1 | ||||
Die Anpassung der Rührgeschwindigkeiten für die Kultivierung von Mikroorganismen, Pflanzenzellen, tierischen Zellen oder Insektenzellen ist sehr wichtig, da diese unterschiedlich auf Scherstress reagieren, d. h.e., die mechanische Belastung durch das Rühren. Je nach Zelllinie können Zellkulturen sehr viel stärker auf zu starkes Rühren reagieren, d. h. sie sterben einfach ab, eine Tendenz, die Wissenschaftler genauer (und diplomatischer) als „scherstressempfindlich“ bezeichnen. Die Sauerstoffverfügbarkeit kann während des Bioprozesses durch Änderung der Rührgeschwindigkeit variiert werden, um ein optimales Zellwachstum zu gewährleisten.
Messung und Kontrolle der Temperatur
Mikroorganismen und Zellkulturen haben Enzyme, die am besten innerhalb bestimmter Temperatur- und pH-Bereiche arbeiten. Liegen die Bedingungen außerhalb dieser Bereiche, läuft der gewünschte Bioprozess wesentlich langsamer ab, denn Wachstum und Stoffwechselleistung sind in hohem Maße von diesen Enzymen, d.h. katalytisch aktiven Proteinen, abhängig. Im schlimmsten Fall können sie durch ungünstige Umweltbedingungen sogar zerstört werden. Säugetierzellkulturen fühlen sich in einem sehr engen Temperaturbereich am wohlsten, der aus ihrer Sicht nur dann gegeben ist, wenn die Temperatur im Kulturgefäß 37 °C beträgt.
Deshalb wird im Bioreaktor ein Platin-Widerstandssensor, ein so genannter Pt100-Sensor, zur Bestimmung der Temperatur eingesetzt. Er hat einen Widerstand von 100 Ω bei 0 °C und deckt bei entsprechender Kalibrierung den zu erwartenden biologisch relevanten Messbereich recht gut ab.
Der typische Temperaturbereich variiert unter anderem in Abhängigkeit vom kultivierten Organismus:
| Organismus | Temperaturbereich | ||||
| Bakterien, Hefen, Pilze | +20 °C bis +60 °C | ||||
| Säugetiere, Insekten- oder Pflanzenzellen | +25 °C bis +37 °C | ||||
Wenn Sie bei Temperaturen nahe oder unterhalb der Raumtemperatur arbeiten, benötigen Sie ein aktives Kühlsystem wie einen Rückkühler. Bei den meisten Bioprozessen sollte die Temperatur während der gesamten Kultivierung konstant bleiben. Bei einigen Produkten wie Penicillin oder rekombinanten Proteinen (d. h. biotechnologisch hergestellten Proteinen aus gentechnisch veränderten Organismen) aktiviert eine Temperaturänderung am Ende der Wachstumsphase wichtige Gene für die Produktbildung und ist daher von Vorteil. Bei Produktionsverfahren mit Zellkulturen wird manchmal auch die Temperatur am Ende des Bioprozesses gesenkt (eine Technik, die in der Biotechnologie als „Temperaturverschiebung“ bekannt ist), damit das fertige Produkt für eine spätere Verwendung stabil bleibt.
Es gibt verschiedene Möglichkeiten, einen Heiz- und/oder Kühlkreislauf zur Temperaturregulierung zu verwenden:
-
-
- Ein elektrischer Heizblock mit eingebauter Kühlspirale
- Ein Silikonheizkissen, das nach der Sterilisation um das Kultivierungsgefäß gewickelt wird
- Ein Doppelmantel, in dem Wasser zirkuliert. Die Temperatur wird über eine elektrische Heizung oder Dampf und ein Magnetventil für die Kühlwasserzufuhr eingestellt
-
Messung und Kontrolle des pH-Wertes
Die Messung und Kontrolle des pH-Wertes ist ein sehr wichtiger Aspekt von Bioprozessen, da Änderungen des pH-Wertes die Wachstumsbedingungen erheblich verändern können – in der Regel mit erheblichen Folgen. Kulturmedien enthalten in der Regel Puffer, d.h. Substanzen, die allzu plötzliche pH-Änderungen, die durch die Zugabe einer Säure oder Base verursacht werden, abmildern. Da eine Säure, die in das Kulturmedium tropft, viele Zelllinien schädigen kann, reichern Wissenschaftler das in der Zellkultur verwendete Gasgemisch oft sorgfältig mit CO2 an, anstatt eine flüssige Säure hinzuzufügen. Das Gas löst sich dann im Kulturmedium auf, so dass das Kohlendioxid in Kombination mit einem Puffer den pH-Wert beeinflussen kann.
Typische pH-Bereiche je nach kultiviertem Organismus:
| Organismus | pH | ||||
| Bakterien, Hefen, Pilze | 4.5 – 7.0 | ||||
| Säugetierzellen | 6.7 – 7.4 | ||||
| Insektenzellen | 6.2 – 6.9 | ||||
| Pflanzenzellen | 5.5 | ||||
Für die Messung des pH-Wertes während des Bioprozesses ist jeder Bioreaktor mit einem pH-Sensor, einer sogenannten pH-Einstabmesskette, ausgestattet. Der Bioreaktor kann Abweichungen des pH-Wertes korrigieren; zu diesem Zweck wird eine Säure und/oder eine Lauge bereitgestellt und über Schläuche und Pumpen mit dem Kulturgefäß verbunden. Damit dies funktioniert, muss die Konzentration der Säure und der Base geschickt gewählt werden – ist sie zu hoch, können die Tropfen der konzentrierten Säure oder Base die Mikroorganismen und Zellkulturen schädigen, bevor sie im Bioreaktor verteilt werden. Ist die Konzentration dagegen zu niedrig, müssen die Anwender mehr Säure oder Base zugeben, wodurch das Kulturmedium unnötig verdünnt wird.
Zugabe von Nährstoffen
Während eines Bioprozesses verbrauchen die Mikroorganismen in der Regel eine breite Palette von Nährstoffen. Die Grundzusammensetzung eines Nährmediums besteht in der Regel aus Wasser, einer für den Organismus verwertbaren Energiequelle (z.B. Glukose), sowie den von ihm benötigten Nährstoffen (Kohlenstoff, Stickstoff und Phosphor), Salzen und Spurenelementen. Je nach Organismus sind weitere Verbindungen notwendig, die nicht selbst synthetisiert werden können (Vitamine, essentielle Aminosäuren usw.).
Je nach Bioprozessstrategie werden diese Nährstoffe entweder alle zu Beginn eines Bioprozesses zur Verfügung gestellt (Batch-Bioprozess) oder im Laufe der Zeit zugeführt, wie z.B. bei einem Fed-Batch oder in einem kontinuierlichen Prozess.
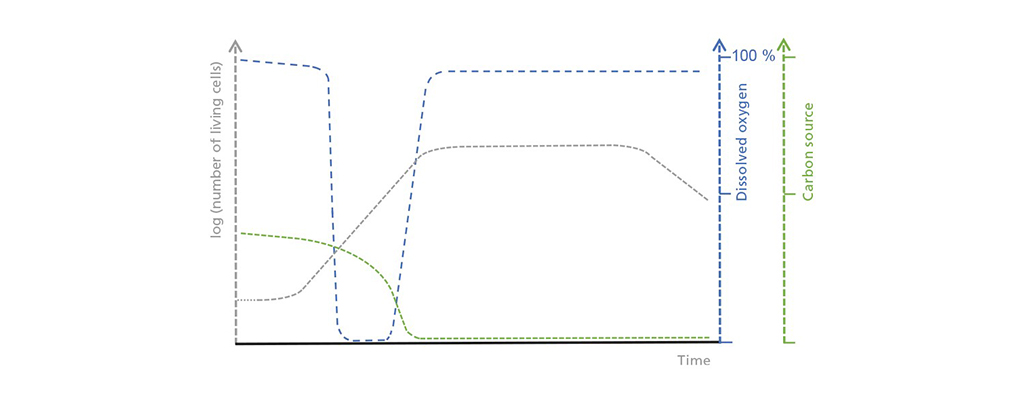
Schematische Darstellung der Zusammenhänge zwischen Lebendzellkonzentration, gelöstem Sauerstoff und der limitierenden Kohlenstoffquelle im Batch-Betrieb. In der anfänglichen Verzögerungsphase steigt die Lebendzellzahl nur langsam an, was zu einer mäßigen, aber stetigen Aufnahme der Kohlenstoffquelle führt. In der exponentiellen Wachstumsphase nimmt der Sauerstoffverbrauch zu, bis er die mögliche Sauerstoffzufuhr übersteigt. Sobald die Kohlenstoffquelle erschöpft ist, beginnt die stationäre Phase, auf die eine tote Phase folgt, in der die Zahl der lebenden Zellen drastisch abnimmt.
Wenn Sie mehr über die verschiedenen Fütterungsstrategien erfahren möchten, lesen Sie unseren Blog-Beitrag: Der Unterschied zwischen Batch-, Fed-Batch- und kontinuierlichen Prozessen.
Begasung
Während des Bioprozesses führt der Bioreaktor dem Nährmedium ein steriles Gasgemisch wie Luft zu. Durch ständiges Rühren werden nicht nur die Nährstoffe verteilt, sondern auch die im Kulturgefäß entstehenden Gasblasen verkleinert, wodurch effizient Sauerstoff in die Nährlösung abgegeben wird. Das ist wichtig, denn Mikroorganismen und Zellkulturen können nur den Sauerstoff aufnehmen, der in der Nährlösung gelöst ist.
Der Sauerstoffbedarf ist unterschiedlich: Aerobe Bakterien brauchen Sauerstoff, andere bevorzugen Gasgemische wie Synthesegas („Syngas“). Anaerobe Organismen kommen dagegen ganz ohne Begasung aus und ernähren sich nur von anorganischen und organischen Stoffen aus dem Nährmedium wie Nitrat oder Fumarat.
Im Gegensatz zu Mikroorganismen werden Zellkulturen nicht nur mit Luft begast – auch mit reinem Stickstoff und reinem Sauerstoff kann der Sauerstoffgehalt des Gasgemisches beeinflusst werden. Die genaue Zusammensetzung hängt von der jeweiligen Zellkulturanwendung ab. Um die Gasatmosphäre konstant zu halten, braucht der Bioreaktor präzise Regelsysteme.
Zu Beginn des Bioprozesses benötigt eine Kultur beispielsweise oft weniger Sauerstoff – und damit eine geringere Gaszufuhr – da das Wachstum noch langsam voranschreitet. Später jedoch erfordert ein schnelleres Wachstum deutlich mehr Sauerstoff. Der Bioreaktor sorgt nicht nur für eine konstante Zufuhr des gewünschten Gases oder Gasgemisches, sondern auch für die richtige Gasmenge zur richtigen Zeit. Zu diesem Zweck verfügt der Bioreaktor über Gasanschlüsse, die mit Druckluft aus dem Gebäude, einem Kompressor oder einer Gasflasche verbunden sind.
Die Begasungsrate wird normalerweise in Litern pro Minute gemessen. Um einen allgemeinen Parameter zu haben, der auf verschiedene Bioreaktoren anwendbar ist, wird die Rate häufig auch als spezifische Begasungsrate angegeben, die sich auf ein Vielfaches des Arbeitsvolumens (Gefäßvolumen pro Minute, vvm) bezieht und als min-1 ausgedrückt wird. Ein typischer Wert für mikrobielle Bioprozesse ist das 1 bis 1,5fache des Arbeitsvolumens pro Minute. Für einen Bioreaktor mit einem Arbeitsvolumen von 4 L würde die maximale Begasungsrate also 4 L * 2 L-1 min-1 = 8 L min-1 betragen. Bei Zellkulturen hingegen liegt die maximale Rate oft bei 10 bis 15 % des Arbeitsvolumens pro Minute, um die Gasblasen klein zu halten und so Schaumbildung und Zellschäden durch platzende Blasen zu vermeiden.
Die Änderung der Gasrate ist jedoch nicht die einzige Möglichkeit, die Effizienz zu steuern, mit der der Bioreaktor Sauerstoff und andere Gase an das Kulturmedium abgibt. Je größer die Oberfläche der Gesamtzahl aller Gasblasen im Bioreaktor ist, d.h. je feiner die Gasblasen selbst verteilt sind, desto effizienter wird der Sauerstoff von der Gas- in die Flüssigphase übertragen. Das bedeutet zum Beispiel, dass eine Erhöhung der Rührgeschwindigkeit die Sauerstoffversorgung der Mikroorganismen verbessern kann, da der Rührer die Gasblasen noch kleiner macht und damit die Gesamtoberfläche aller Gasblasen im Bioreaktor vergrößert.
Die genaue Regelung des pO2 – und damit die genaue Kontrolle der Begasungsrate und der Gaszusammensetzung – ist sehr wichtig, da der pO2 normalerweise nicht der wachstumshemmende Faktor für die Kultur sein sollte. Bei unzureichender Kontrolle wird der pO2 jedoch zum begrenzenden Faktor.
Da die Gaszufuhr zum Bioreaktor in der Regel trocken ist, kann sich während der Begasung Feuchtigkeit aus dem Bioreaktor im Ausgangsstrom sammeln. Bei einer hohen Begasungsrate würde nicht nur der Füllstand sinken, sondern die Feuchtigkeit würde auch den Abluftfilter verstopfen, so dass eine ordnungsgemäße Entlüftung nicht möglich ist und sich ein Druck aufbauen kann. Um diesen Effekt zu vermeiden, sind Bioreaktoren mit einem effizienten Abluftkühler ausgestattet, in dem die Feuchtigkeit in der Abluft kondensiert und in den Bioreaktor zurücktropfen kann, bevor sie den Abluftfilter erreicht.
Messung und Regelung des Drucks
Je höher der Druck im Gefäß, desto mehr Sauerstoff wird gelöst. Kulturgefäße aus Glas sind häufig nur für einen Druck von bis zu 0,5 bar zugelassen, das ist nicht einmal die Hälfte des Drucks eines mäßig gefüllten Fahrradreifens. Bei einem höheren Betriebsdruck können leicht beschädigte Kulturgefäße aus Glas platzen, was ein Sicherheitsrisiko darstellt. Deshalb sollten Sie immer für eine freie, drucklose Abluftleitung aus dem Bioreaktor sorgen, indem Sie den Abluftfilter trocken halten und regelmäßig austauschen – dabei achten Sie natürlich auch auf die Unversehrtheit des Kulturgefäßes. Im Gegensatz zu Kulturgefäßen aus Glas sind Bioreaktoren aus Edelstahl für höhere Drücke ausgelegt und eignen sich bereits in der Standardkonfiguration für Drücke bis zu 2 bar (ein gut gefüllter Fahrradreifen). Außerdem sind solche Systeme häufig mit einem Druckkontrollmechanismus ausgestattet, der auf einem Drucksensor im Bioreaktor und einem Proportionalventil in der Abluftleitung basiert. Diese können den Druck im Bioreaktor nicht nur messen, sondern auch aktiv steuern.

Schaumbildung verhindern
Außerhalb von Badewannen und Biergläsern ist Schaum eine eher ungeliebte Begleiterscheinung, insbesondere in Bioreaktoren. Schaum bildet sich an der Grenzfläche zwischen der flüssigen und der gasförmigen Phase im Kulturgefäß und kann schnell bis unter die Deckplatte gelangen. Im schlimmsten Fall verstopft er dann den Abluftfilter, der wiederum den Gasfluss blockiert. Die meisten Bioreaktoren sind daher mit einem System zur Bekämpfung der Schaumbildung ausgestattet. Mechanische Schaumbrecher im Kopfraum sind eher großen Bioreaktoren aus rostfreiem Stahl vorbehalten, während Anti-Schaum-Kontrollsysteme auf der Basis chemischer Mittel (wie PPG, Struktol oder Entschäumer auf Siliziumbasis) in kleineren Bioreaktoren zu finden sind.
Ein typisches Anti-Schaum-Kontrollsystem besteht aus einem Sensor, der in einer bestimmten Höhe im Kulturgefäß installiert ist. Erreicht die Schaumhöhe den Sensor, wird ein Antischaummittel aus einem Vorratsbehälter in das Kulturgefäß gepumpt. Diese Entschäumer sind an der Flüssigkeits-Gas-Grenzfläche aktiv und erhöhen die Tendenz der Schaumblasen zum Zusammenfallen. In besonders hartnäckigen Fällen, in denen sich der Schaum nicht sofort auflöst, ist der Vorgang nach einer vorgegebenen Zeit zu wiederholen (Strategie der „Schussverzögerung &“). Bei der Verwendung eines Entschäumers ist Vorsicht geboten – wenn man auch nur etwas mehr als nötig dosiert, kann er sich wie eine zweite Haut auf die Flüssigkeitsoberfläche legen, was den Gasaustausch behindert. Entschäumer wirken auch einem effizienten Sauerstofftransfer entgegen, da die Veränderung der Oberflächenspannung das Kollabieren von Gasblasen im Bioreaktor fördert und damit die für den Gasaustausch zur Verfügung stehende Oberfläche verringert. Die Auswahl des geeigneten Mittels hängt auch vom jeweiligen Bioprozess ab, denn Bakterien und Zellen reagieren unterschiedlich auf bestimmte Chemikalien.
Bonus: Die Vorteile einer SCADA-Software
Die in einem Bioreaktor anfallenden Ergebnisse sollten heutzutage möglichst zentral gesammelt und ausgewertet werden, denn nur so lassen sich moderne Big-Data-Algorithmen effektiv einsetzen, um mehr Informationen zu generieren und die Funktionsweise eines Prozesses besser zu verstehen. Das ist die Aufgabe der SCADA-Software. Im ersten Schritt können alle Daten aus dem Bioreaktor – ohne große Eingaben seitens des Anwenders – ausgelesen und zentral gespeichert werden, um sie einzeln auszuwerten oder mit anderen Chargendaten zu vergleichen. So entstehen schnell Ideen für neue Experimente und eventuell sogar komplexe Batch-Strategien. Mit einer professionellen SCADA-Software lassen sich diese einfach planen und anschließend der Bioreaktor steuern, der im Idealfall vollautomatisch läuft. Darüber hinaus integriert die SCADA-Software auch mehrere Komponenten in die Bioreaktorumgebung. Dazu gehören Werkzeuge zur Prozessoptimierung mit Hilfe der Design-of-Experiment (DoE)-Technik oder leistungsfähige Softwaresensoren, die gleichzeitig genutzt werden können, um direkt aus den Parametern des Batch-Prozesses zusätzliche Informationen zu berechnen und diese Parameter sogar zu regeln. So kann beispielsweise der Respirationsquotient (RQ) verwendet werden, um anhand des Verhältnisses von ausgeschiedenem Kohlendioxid zu aufgenommenem Sauerstoff eine Schätzung der Stoffwechselaktivität zu erhalten.
Die Möglichkeiten sind so vielfältig – insbesondere wenn Bioreaktor und SCADA-Software perfekt aufeinander abgestimmt sind -, dass wir sie unmöglich alle beschreiben können. Wenn Sie mehr darüber erfahren möchten, was eine moderne SCADA-Software alles zu bieten hat, schauen Sie sich die eve® bioprocess platform software

an.