Hier sind die Schritte, die ich beim Zeichnen einer Lewis-Struktur befolge.
1. Entscheide, welches das zentrale Atom in der Struktur ist. Das wird normalerweise das am wenigsten elektronegative Atom sein (#“C „#).
2. Zeichne eine Skelettstruktur, in der die anderen Atome einfach an das Zentralatom gebunden sind:
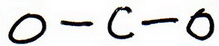
3. Zeichne eine Versuchsstruktur, indem du Elektronenpaare um jedes Atom legst, bis jedes ein Oktett erhält.
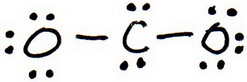
4. Zähle die Valenzelektronen in deiner Versuchsstruktur (20).
5. Zähle nun die Valenzelektronen, die du tatsächlich zur Verfügung hast. #1 „C“ + 2 „O“ = 1×4 + 2×6 = 16#.
Die Versuchsstruktur hat vier Elektronen zu viel.
Wir müssen entweder eine Dreifachbindung oder zwei Doppelbindungen einfügen.
6. Zeichne neue Versuchsstrukturen, wobei du diesmal die zusätzlichen Bindungen einfügst.
Es gibt drei Möglichkeiten:
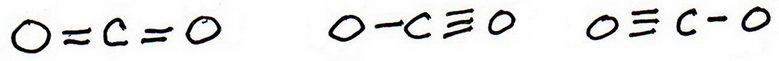
7. Füge wie zuvor Valenzelektronen hinzu, um jedem Atom ein Oktett zu geben:
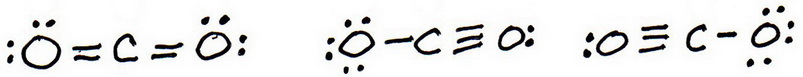
8. Berechne die formale Ladung für jedes Atom.
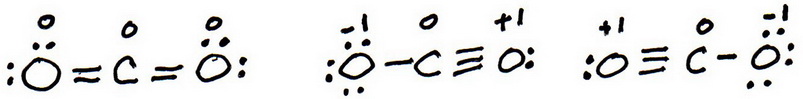
9. Die „beste“ Lewis-Struktur ist diejenige, die die wenigsten formalen Ladungen hat.
Die erste Struktur hat keine formalen Ladungen, also ist die beste Lewis-Struktur für #“CO“_2#
