DOI: 10.17235/reed.2016.4095/2016
ORIGINAL PAPERS
Assoziation zwischen der Lage von Dickdarmpolypen bei Studienbeginn und Überwachungskoloskopie – Eine retrospektive Studie
Ana Oliveira, Paulo Freire, Paulo Souto, Manuela Ferreira, Sofia Mendes, Clotilde Lérias, Pedro Amaro, Francisco Portela und Carlos Sofia
Abteilung für Gastroenterologie. Centro Hospitalar e Universitário de Coimbra. Coimbra, Portugal.
Korrespondenz
ABSTRACT
Einführung: Zur Stratifizierung der Wahrscheinlichkeit eines Polypenrezidivs werden mehrere Faktoren herangezogen. Es gibt jedoch keine Studien, die eine Korrelation zwischen dem Ort der ursprünglichen Polypen und den rezidivierenden Polypen herstellen. Ziel dieser Studie war es, zu überprüfen, ob die Lage der Polypen bei der Überwachungskoloskopie mit der Lage der zuvor entfernten Polypen bei der Basiskoloskopie korreliert.
Methoden: Retrospektive Studie an Patienten, bei denen eine Koloskopie durchgeführt wurde, bei der alle Polypen gefunden und entfernt wurden, gefolgt von einer Überwachungskoloskopie. Die Lage der Polypen wurde in proximal/distal der Milzflexur und des Rektums unterteilt. Außerdem wurden die Merkmale und Rezidivraten an der gleichen Stelle des Dickdarms bewertet.
Ergebnisse: Von den 346 Patienten, die sich einer wiederholten Koloskopie unterzogen, wurde bei 268 (77,4 %) mindestens ein Polyp entdeckt. Für alle Segmente bestand ein erhöhtes Risiko für wiederkehrende Polypen an derselben Stelle, und zwar etwa viermal so hoch in den proximalen (OR 3,5; KI 2,1-6,0) und distalen Kolonsegmenten (OR 3,8; KI 2,1-6,8), gefolgt von einem dreimal so hohen Risiko im Rektum (OR 2,6; KI 1,5-4,6). Unter Berücksichtigung der Polypenmorphologie, der Größe, der angewandten Polypektomietechnik und der histologischen Klassifizierung wurde kein Unterschied zwischen den Rezidivraten im selben Segment festgestellt.
Schlussfolgerung: Es scheint ein signifikanter Zusammenhang zwischen der Lage der Polypen bei Studienbeginn und der Überwachungskoloskopie zu bestehen.
Schlüsselwörter: Colon. Polyp. Lage. Rezidiv.
Einführung
Adenome des Kolons und Rektums sind häufige gutartige neoplastische Läsionen, die bei etwa 25 % der Patienten entdeckt werden, die sich einer Koloskopie unterziehen (1). Darmkrebs (CRC) ist die dritthäufigste Krebserkrankung und die vierthäufigste krebsbedingte Todesursache weltweit (2). Die Koloskopie und die endoskopische Erkennung und Resektion präkanzeröser Läsionen führen zu einer Verringerung der Inzidenz und der Sterblichkeit durch Darmkrebs (3). Diese Risikoreduktion scheint für den distalen Dickdarm stärker zu sein. Dennoch wurde mit der Koloskopie eine 77%ige Verringerung der Inzidenz und eine 29-37%ige Verringerung der CRC-bedingten Todesfälle beobachtet (4,5). Bei Patienten mit früheren adenomatösen Polypen wird wegen des Risikos metachroner, rezidivierender und neuer Läsionen eine Überwachungskoloskopie empfohlen (6). Das Risiko, bei der Überwachungskoloskopie Adenome zu finden, hängt von den Ergebnissen der Erstkoloskopie ab. Die Rate ist höher bei Patienten mit fortgeschrittenen Adenomen, mittelhoch bei nicht fortgeschrittenen Adenomen und niedriger bei Patienten ohne Adenome (7). Trotz der Bedeutung der Koloskopie werden Intervallkolonkarzinome nach einer vorherigen Koloskopie mit Polypektomie oder negativem Befund entdeckt (3,8). Dies kann auf verschiedene Faktoren zurückzuführen sein, z. B. auf übersehene Läsionen, das Wiederauftreten von unvollständig entfernten Polypen oder neue Läsionen, die sich seit der letzten Koloskopie entwickelt haben (9). Es gibt mehrere Faktoren, die zur Stratifizierung der Wahrscheinlichkeit eines Polypenrezidivs verwendet werden, darunter Histologie, Größe und Anzahl. In einigen Studien wird auch das proximale Kolon als Marker für ein zukünftiges Adenomrezidiv favorisiert (10), oder es besteht sogar ein gewisser Zusammenhang zwischen proximalem und distalem Rezidiv (7,11). Ziel dieser Studie war es daher zu überprüfen, ob die Lage der Polypen bei der Überwachungskoloskopie mit der Lage der zuvor entfernten Polypen bei der Ausgangskoloskopie assoziiert ist.
Material und Methoden
Wir führten eine retrospektive Studie bei Patienten durch, die sich zwei Koloskopien unterzogen: einer Indexkoloskopie mit Polypen und einer Überwachungskoloskopie mit oder ohne Polypen. Wir definierten eine positive Assoziation beim Wiederauftreten von Polypen an der gleichen Stelle, wenn mindestens ein metachroner Polyp bei der Überwachungskoloskopie im gleichen Dickdarmsegment war wie bei der Indexkoloskopie.
Die Patienten wurden von Januar 2004 bis Dezember 2014 von der Abteilung für Gastroenterologie aufgenommen. Zu den Einschlusskriterien gehörten Patienten im Alter von über 18 Jahren mit zwei qualitativ hochwertigen Koloskopien mit einem Abstand von mindestens einem Jahr dazwischen und einer Entfernung aller bei der Ausgangskoloskopie entdeckten Polypen. Die Kriterien für eine qualitativ hochwertige Koloskopie setzten voraus, dass sie von einem erfahrenen Koloskopiker durchgeführt wurde, der Grad der Darmreinigung anhand der Ottawa Bowel Preparation Scale (OBPS) als ausgezeichnet oder gut bewertet wurde und eine Intubation des Zökums erreicht wurde. Die Krankenakten der Patienten wurden ausgewertet. Wir erfassten die demografischen Daten der Patienten, einschließlich Geschlecht und Alter. Die Daten aus den Koloskopieberichten wurden erfasst, darunter die Anzahl der Polypen, ihre Größe, Morphologie und Lage sowie die Resektionstechnik. Die Läsionen wurden nach der Pariser Klassifikation (12) klassifiziert. Nicht-polypoide Läsionen vom Typ 0 und Polypen, die größer als 20 mm waren, wurden ausgeschlossen. Die Lage der Polypen wurde in proximal oder distal der Milzflexur und des Rektums eingeteilt. Bei der Resektionstechnik wurde unterschieden zwischen Resektion mit kalter Biopsiezange, Standard-Schlingenexzision und submuköser Injektion mit anschließender Resektion. Diese Daten wurden bei beiden Koloskopien erhoben. Der histologische Bericht wurde von allen entfernten und wiedergefundenen Polypen beider Koloskopien erstellt. Die histopathologische Diagnose wurde nach der revidierten Wiener Klassifikation (13) gestellt. Die Polypen wurden auch in Bezug auf ihre Drüsenarchitektur in röhrenförmig, röhrenförmig-ovillös, zottenförmig und zackenförmig eingeteilt. Anhand dieser Daten wurden die Adenome dann in fortgeschrittene und nicht fortgeschrittene Adenome eingeteilt. So galt ein Adenom als fortgeschritten, wenn es 1 cm oder größer war und eine zottenartige Histologie oder eine hochgradige Dysplasie aufwies (6). Die histologischen Analysen der Resektionsränder wurden wie folgt klassifiziert: vollständige Resektion (R0), Resektionsränder konnten nicht vollständig beurteilt werden (Rx) oder es lag eine Restläsion vor (R1). Zu den Ausschlusskriterien gehörten Patienten, die sich einer Dickdarmoperation unterzogen hatten oder bei denen vor der ersten Koloskopie ein kolorektales Karzinom aufgetreten war, sowie Patienten mit einer entzündlichen Darmerkrankung oder einem Polyposis-Syndrom.
Die Ethikkommission genehmigte die Studie. Alle Autoren hatten Zugang zu den Daten und haben das endgültige Manuskript geprüft und genehmigt.
Statistische Analysen
Unsere vorläufigen Daten deuten darauf hin, dass die bei der Überwachungskoloskopie entdeckten Polypen in mindestens 20 % der Fälle an der gleichen Stelle auftreten wie die bei der Erstuntersuchung beobachteten. Bei einem α-Wert von 0,05, einer Aussagekraft von 80 % und einem Verhältnis von Fall zu Kontrolle von 1:2 schätzten wir, dass 195 Patienten erforderlich wären.
Kategorische Variablen wurden als Häufigkeit und Prozentsatz angegeben. Kontinuierliche Variablen wurden als Mittelwert (Standardabweichung, SD) ausgedrückt. Zur Beurteilung der Normalität wurde der Kolmogorov-Smirnov-Test verwendet. Kategoriale Variablen wurden mit dem Chi-Quadrat-Test und kontinuierliche Variablen mit dem Student’s t-Test für normalverteilte Daten oder dem Mann-Whitney U-Test verglichen, wenn die Daten keine Normalverteilung aufwiesen. Um die Übereinstimmung zwischen den Ergebnissen der beiden Koloskopien zu ermitteln, wurde der Cohen’s Kappa-Test verwendet. Die Odds Ratio (OR) wurde mit einem 95%-Konfidenzintervall (CI) berechnet; ein CI, das nicht 1,0 einschließt, bedeutet, dass eine signifikante Beziehung zwischen den Variablen besteht. Unterschiede zwischen den Daten wurden als statistisch signifikant angesehen, wenn der zweiseitige p-Wert unter 0,05 lag.
Zunächst wurden die Ergebnisse der beiden Koloskopien analysiert. Dann wurde die Übereinstimmung der Rezidivraten für dieselbe Stelle bei der Basis- und der Überwachungskoloskopie berechnet. Darüber hinaus wurden mögliche Faktoren bewertet, die zum Wiederauftreten von Polypen an derselben Stelle beitragen könnten, wie z. B. Polypenmerkmale oder histologische Eigenschaften.
Die Datenanalyse wurde mit dem Statistical Package for Social Sciences-SPSS (SPSS Inc. USA), IBM®, Computersoftware für Mac OS X (Version 21).
Ergebnisse
Von den 346 Patienten, bei denen zwei qualitativ hochwertige Koloskopien mit Polypen bei der Indexkoloskopie durchgeführt wurden, hatten 78 bei der Überwachungskoloskopie keine Polypen. Daher wurden insgesamt 268 Patienten in die Studie aufgenommen (Abb. 1). Die Patienten hatten ein Durchschnittsalter von 64 (SD 10) Jahren, das von 29 bis 82 Jahren reichte, und waren überwiegend männlich (64,9 %).
Das mittlere Intervall zwischen beiden Koloskopien betrug 37 (SD 20) Monate.
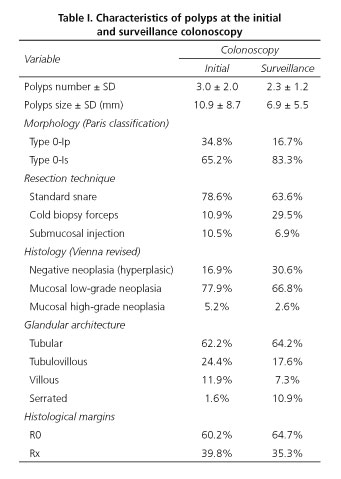
Die Merkmale der bei der Erst- und Überwachungskoloskopie gefundenen Polypen sind in Tabelle I beschrieben. Bei der Erstkoloskopie betrug die durchschnittliche Anzahl der entdeckten und resezierten Polypen 3,0 (SD 2,0), bei der Überwachungskoloskopie weniger als 2,3 (SD 1,2). Bei der ersten Koloskopie betrug die durchschnittliche Größe der Polypen 10,9 mm (SD 8,7), bei der zweiten Koloskopie waren die Polypen kleiner und hatten eine durchschnittliche Größe von 6,9 mm (SD 5,5). Bei der ersten Koloskopie war die Morphologie in 34,8 % vom Typ 0-Ip und in 65,2 % vom Typ 0-Is; bei der zweiten Koloskopie wurde weiterhin beobachtet, dass die sessile Morphologie vorherrschend war, allerdings in einem höheren Anteil, da der Prozentsatz der Polypen vom Typ 0-Is 83,3 % betrug. Die Drüsenarchitektur war in beiden Fällen ähnlich, mit Ausnahme der höheren Inzidenz von gezackten Polypen bei der Überwachungskoloskopie (1,6 % vs. 10,9 %).
Bei der ersten Koloskopie hatten 42,5 % der Patienten Polypen im proximalen Kolon, 75,0 % im distalen Kolon und 30,2 % im Rektum. Bei der Überwachungskoloskopie war die Verteilung ähnlich: 52,6 % im proximalen Kolon, 60,1 % im distalen Kolon und 25,0 % im Rektum. Die Gesamtübereinstimmungsrate der Polypenlokalisation zwischen den Koloskopien betrug 44 %. Tabelle II zeigt die Wahrscheinlichkeit eines Wiederauftretens im selben Kolonsegment. Für alle Dickdarmsegmente besteht ein erhöhtes Risiko für ein Wiederauftreten von Polypen an der gleichen Stelle. Dieses Risiko ist sowohl für proximale (OR 3,5; KI 2,1-6,0) als auch für distale Kolonsegmente (OR 3,8; KI 2,1-6,8) ähnlich, gefolgt vom Rektum (OR 2,6; KI 1,5-4,6), p < 0,001. Die Kappa-Werte betrugen 0,29 (95% CI; 0,19-0,41) und 0,27 (0,16-0,38) für das proximale bzw. distale Kolon, was eine gute Übereinstimmung bedeutet, und 0,20 (CI 0,08-0,33) für das Rektum, was eine schlechte Übereinstimmung bedeutet, p < 0.001 (Tabelle III).


Die Analyse der verschiedenen Faktoren, die zum Wiederauftreten von Polypen an derselben Stelle beitragen könnten, zeigt keine statistisch signifikanten Unterschiede (Tabelle IV). Es zeigte sich jedoch eine leichte Prävalenz für ein höheres Rezidiv am selben Segment, wenn die Resektion mit submuköser Injektion (70,4 %) im Vergleich zu Biopsiezangen (68,3 %) und Schlinge (61,4 %) durchgeführt wurde, und für hyperplastische Polypen (75,7 %) im Vergleich zu Polypen mit niedriggradiger (66,7 %) oder hochgradiger Dysplasie (66,7 %). Bei den histologischen Rändern gab es keine Unterschiede, und obwohl die Rx (68,1 %) häufiger war als die vollständige Resektion (53,3 %), hatte dies keine statistische Bedeutung (p = 0,511). Auch bei der Wahrscheinlichkeit eines Rezidivs an der gleichen Stelle gab es nach der Stratifizierung keinen Unterschied zwischen fortgeschrittenen Adenomen (70,8 %), nicht fortgeschrittenen Adenomen (61,9 %) und hyperplastischen Adenomen (75,7 %), p = 0,216. Die Zeit zwischen den Koloskopien war nicht mit dem Wiederauftreten von Polypen an derselben Stelle assoziiert (36 vs. 38 Monate).

Diskussion
In unserer Studie fanden wir einen signifikanten Zusammenhang zwischen der ursprünglichen Lage der Polypen und dem Wiederauftreten. Für alle Dickdarmsegmente gilt, dass das Vorhandensein von Polypen bei der Ausgangskoloskopie ein signifikantes Risiko für ein Wiederauftreten an derselben Stelle bei der Überwachungskoloskopie darstellt. Dieses Risiko ist im distalen Kolon etwa viermal so hoch, dicht gefolgt vom proximalen Kolon. Es gibt mehrere mögliche Erklärungen für diese hohe Rate an Lokalisierungsübereinstimmungen. Erstens kann der Koloskopiker bei Patienten, bei denen in der Vergangenheit eine Polypenresektion durchgeführt wurde, die Aufmerksamkeit auf die Stellen erhöhen, an denen zuvor Polypen entdeckt wurden. Ein weiterer Grund ist das Wiederauftreten von Polypen aufgrund einer unvollständigen Entfernung. Mit dem Ziel, die unvollständige Resektion als Rezidivfaktor zu reduzieren, haben wir flache und größere Läsionen ausgeschlossen. Auch die histologischen Ränder der Resektion (vollständige oder verbleibende Läsion) spielten in dieser Studie keine Rolle für die Rezidivrate. Die Rate der fehlenden Polypen liegt bei etwa 20 % und steigt mit abnehmender Größe der Läsionen (14). Fehlende Adenome können ebenfalls eine Erklärung für die rezidivierenden Polypen sein, obwohl wir versucht haben, diesen Faktor zu verringern, indem wir nur qualitativ hochwertige Koloskopien ausgewählt haben. Eine weitere Möglichkeit für diese hohe Rate an Lokalisierungsübereinstimmungen hängt mit der Entwicklung neuer Läsionen zusammen. Diese neuen Läsionen können auf das Fehlen einer hemmenden Wirkung nach der Polypenentfernung (7) oder auf lokale Effekte zurückzuführen sein, die die Karzinogenese begünstigen, wie z. B. wiederholte/anhaltende Entzündungen oder Verletzungen (9). Außerdem können diese neuen Läsionen mit einem anderen und schnelleren Weg der Karzinogenese verbunden sein. Es wurde nachgewiesen, dass Intervallkarzinome nach einer Polypektomie häufiger auftreten als im Segment der vorherigen Polypektomie erwartet (9). Diese Studie untermauert diese früheren Ergebnisse, indem sie zeigt, dass Polypen auch dazu neigen, an derselben Stelle wieder aufzutreten. Bei Intervallkarzinomen zeigen Studien, dass 70-80 % überwiegend auf fehlende Läsionen und nicht auf neue Läsionen zurückzuführen sind (15,16).
Es ist bekannt, dass die Rezidivrate von Adenomen 3 bis 4 Jahre nach der ersten Koloskopie auf etwa 30-40 % geschätzt wird (8,17). Das Risiko eines Adenomrezidivs bei der Überwachungskoloskopie hängt von den Befunden bei der vorherigen Koloskopie ab. Das Risiko ist bei fortgeschrittenen und/oder multiplen Adenomen höher (7,10,18). Unter dieser Annahme analysierten wir die Polypenmerkmale (Größe, Morphologie und Histologie), die Resektionsränder (Vorhandensein von hyperplasischem oder adenomatösem Gewebe) und die für die Polypektomie verwendete Technik. Wir fanden keine statistisch signifikanten Faktoren, die zu einem Wiederauftreten an der gleichen Stelle beitragen könnten. Auch nach Stratifizierung des Adenoms in fortgeschrittene Adenome gab es keinen Rezidivfaktor.
Es scheint keinen Zusammenhang zwischen der Wahrscheinlichkeit der Entdeckung von Adenomen bei der Überwachungskoloskopie nach einer Koloskopie mit nur hyperplasischen Polypen zu geben (19). In unserer Studie stellten wir fest, dass bei der zweiten Koloskopie eine erhöhte Anzahl hyperplasischer Polypen auftrat, obwohl der histologische Typ nicht zum Wiederauftreten an der gleichen Stelle beitrug. Dies kann als lokale Reaktion, die eine Hyperproliferation der Schleimhaut hervorruft, gerechtfertigt sein, da hyperplastische Polypen aus normalen zellulären Bestandteilen bestehen. Hyperplastische Läsionen können Mutationen aufweisen, insbesondere K-ras, aber auch BRAF-Mutationen, die das Potenzial haben, diese Läsionen in Krebs zu verwandeln (20-22). Nicht nur hyperplastische Polypen, sondern auch gezackte Polypen haben ein CRC-Potenzial (23). Gezackte Polypen wurden bei der zweiten Koloskopie häufiger festgestellt (obwohl sie nicht als Rezidivfaktor beitrugen). Dies lässt sich möglicherweise durch Unterschiede zum Zeitpunkt der Analyse durch die Pathologen erklären. Gezackte Polypen, die üblicherweise als hyperplastisch eingestuft wurden, werden jetzt in dieselbe Gruppe wie gezackte Tumore eingeordnet. Sessile gezackte Polypen oder gezackte Adenome sind in der Regel klein oder flach, sie können schneller wachsen und einen anderen Weg der Karzinogenese nehmen. Sie sind auch mit einer höheren Rate an unvollständiger Entfernung verbunden (24,25).
Es gibt Einschränkungen in unserer Studie. Die Studienpopulation umfasst eine kleine, retrospektiv erfasste Stichprobe, und sie wurde an einem Universitätskrankenhaus durchgeführt, so dass die Ergebnisse möglicherweise nicht repräsentativ für die allgemeine Bevölkerung sind. In unserer Studie wurden weder potenzielle Risikofaktoren, die mit der Entstehung von Krebs/Polypen in Verbindung gebracht werden, wie Zigarettenrauchen (26), Verzehr von rotem Fleisch und hoher Body-Mass-Index (27), noch Schutzfaktoren wie Acetylsalicylsäure oder nichtsteroidale entzündungshemmende Medikamente (28) und die Einnahme von Obst (29) berücksichtigt. Obwohl alle Koloskopien von gut ausgebildeten Koloskopikern durchgeführt wurden, gehörten dem Team mehrere Ärzte an, die von der Basislinien- zur Überwachungskoloskopie wechselten. Außerdem muss, wie bereits erwähnt, die Möglichkeit fehlender Adenome immer in Betracht gezogen werden.
Zusammenfassend lässt sich sagen, dass es offenbar einen signifikanten Zusammenhang zwischen der Lage der Polypen bei der Erstuntersuchung und der Überwachungskoloskopie gibt. Dies könnte in Zukunft Auswirkungen auf die technische Durchführung und die Genauigkeit der Koloskopien haben, einschließlich der Warnung vor einer vorsichtigen Inspektion der Segmente, in denen zuvor Polypen entfernt wurden. Außerdem wäre es interessant, die Rolle eines Feldeffekts zu untersuchen, indem die histologischen und molekularen Merkmale der Schleimhaut in der Nähe der entfernten Polypen mit denen der übrigen Schleimhaut verglichen werden. Diese Ergebnisse bedürfen weiterer Forschung, idealerweise durch eine prospektive und multizentrische Studie mit einer größeren Studienpopulation.
1. Giacosa A, Frascio F, Munizzi F. Epidemiologie der kolorektalen Polypen. Tech Coloproctol 2004;2:s243-7. DOI: 10.1007/s10151-004-0169-y.
2. Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, Methods and major patterns in GLOBOCAN 2012. Int J Cancer 2014;136(5):E359-86. DOI: 10.1002/ijc.29210.
3. Zauber AG, Winawer SJ, O’Brien MJ, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med 2012;366:687-696. DOI: 10.1056/NEJMoa1100370.
4. Brenner H, Chang-Claude J, Seiler CM, et al. Protection from colorectal cancer after colonoscopy: A population-based, case-control study. Ann Intern Med 2011;154:22-30. DOI: 10.7326/0003-4819-154-1-201101040-00004.
5. Baxter N, Goldwasser M, Paszat L, et al. Association of colonoscopy and death from colorectal cancer. Annals of Internal Medicine 2009;150:1-8. DOI: 10.7326/0003-4819-150-1-200901060-00306.
6. Lieberman DA, Rex DK, Sidney JW, et al. Guidelines for colonoscopy surveillance after cancer resection: A consensus update by the American Cancer Society and the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2012;143:844-57. DOI: 10.1053/j.gastro.2012.06.001.
7. Pinsky P, Schoen R, Weissfeld J, et al. The yield of surveillance colonoscopy by adenoma history and time to examination. Clin Gastroenterol Hepatol 2009;7:86-92. DOI: 10.1016/j.cgh.2008.07.014.
8. Lieberman DA, Weiss DG, Harford WV, et al. Five year colon surveillance after screening colonoscopy. Gastroenterology 2007;133:1077-85. DOI: 10.1053/j.gastro.2007.07.006.
9. Brenner H, Chang-Claude J, Jansen L, et al. Kolorektale Karzinome nach Koloskopie mit Polypendetektion: Sites of polyps and sites of cancers. Int J Cancer 2013;133:1672-9. DOI: 10.1002/ijc.28166.
10. Martínez ME, Samplier R, Marshall JR, et all. Adenomcharakteristika als Risikofaktoren für das Wiederauftreten von fortgeschrittenen Adenomen. Gastroenterology 2001;120:1077-83. DOI: 10.1053/gast.2001.23247.
11. Avidan B, Sonnenberg A, Schnell TG, et al. Neuauftreten und Wiederauftreten von Neoplasmen innerhalb von 5 Jahren nach einer Screening-Koloskopie. Am J Gastroenterol 2002;97:1524-9. DOI: 10.1111/j.1572-0241.2002.05801.x.
12. Teilnehmer des Pariser Workshops. Die Pariser endoskopische Klassifikation von oberflächlichen neoplastischen Läsionen: Ösophagus, Magen und Kolon: November 30 to December 1, 2002. Gastrointest Endosc 2003;58:S3-S43.
13. Schlemper RJ, Riddell RH, Kato Y, et al. The Vienna classification of gastrointestinal epithelial neoplasia. Gut 2000;47:251-5. DOI: 10.1136/gut.47.2.251.
14. Heresbach D, Barrioz T, Lapalus MG, et al. Miss-Rate für kolorektale neoplastische Polypen: eine prospektive multizentrische Studie von Back-to-Back-Videokoloskopien. Endoskopie 2008;40:284-90. DOI: 10.1055/s-2007-995618.
15. Pohl H, Robertson D. Colorectal cancers detected after colonoscopy frequently result from missed lesions. Clin Gastroenterol Hepatol. 2010;8:858-64. DOI: 10.1016/j.cgh.2010.06.028.
16. Singh H, Nugent Z, Demers AA, et al. Rate und Prädiktoren von frühen/verpassten kolorektalen Karzinomen nach Koloskopie in Manitoba: eine bevölkerungsbasierte Studie. Am J Gastroenterol 2010;105:2588-96. DOI: 10.1038/ajg.2010.390.
17. Schoen RE. Surveillance nach positiver und negativer Koloskopieuntersuchung: Probleme, Erträge und Nutzen. Am J Gastroenterol 2003; 98:1237-46.
18. Huang Y, Gong W, Su B, et al. Rezidiv und Überwachung von kolorektalen Adenomen nach Polypektomie in einer südchinesischen Bevölkerung. J Gastroenterol 2010;45:838-45. DOI: 10.1007/s00535-010-0227-3.
19. Laiyemo AO, Murphy G, Sansbury L, et al. Hyperplastic polyps and the risk of adenoma recurrence in the Polyp Prevention Trial. Clin Gastroenterol Hepatol 2009;7:192-7. DOI: 10.1016/j.cgh.2008.08.031.
20. Chan TL, Zhao W, Leung SY, et al. BRAF- und KRAS-Mutationen in kolorektalen hyperplastischen Polypen und serrierten Adenomen. Cancer Res 2003;63:4878-81.
21. Spring KJ, Zhao ZZ, Karamatic R, et al. Hohe Prävalenz von sessilen serrierten Adenomen mit BRAF-Mutationen: Eine prospektive Studie an Patienten, die sich einer Koloskopie unterziehen. Gastroenterology 2006;131:1400-7. DOI: 10.1053/j.gastro.2006.08.038.
22. Morimoto LM, Newcomb PA, Ulrich CM, et al. Risk factors for hyperplastic and adenomatous polyps: Evidence for malignant potential? Cancer Epidemiol Biomarkers Prev 2002;11:1012-8.
23. Snover DC. Update über den serrierten Weg zum kolorektalen Karzinom. Hum Pathol 2011;42:1-10. DOI: 10.1016/j.humpath.2010.06.002.
24. Pohl H, Srivastava A, Bensen SP, et al. Unvollständige Polypenresektion bei der Koloskopie – Ergebnisse der Complete Adenoma Resection (CARE) Studie. Gastroenterology 2013;144:74-80. DOI: 10.1053/j.gastro.2012.09.043.
25. Lazarus R1, Junttila OE, Karttunen TJ, et al. The risk of metachronous neoplasia in patients with serrated adenoma. Am J Clin Pathol 2005;123:349-59. DOI: 10.1309/VBAGV3BR96N2EQTR.
26. Botteri E, Iodice S, Bagnardi V, et al. Smoking and colorectal cancer: A meta-analysis. JAMA 2008;300:2765-78. DOI: 10.1001/jama.2008.839.
27. Song X, Pukkala E, Dyba T, et al. Body Mass Index and Cancer Incidence: The FINRISK study. Eur J Epidemiol 2014;29:477-87. DOI: 10.1007/s10654-014-9934-z.
28. Din FV, Theodoratou E, Farrington SM, et al. Effect of aspirin and NSAIDs on risk and survival from colorectal cancer. Gut 2010; 59:1670-9. DOI: 10.1136/gut.2009.203000.
29. Koushik A, Hunter DJ, Spiegelman D, et al. Fruits, vegetables, and colon cancer risk in a pooled analysis of 14 cohort studies. J Natl Cancer Inst 2007;99:1471-83. DOI: 10.1093/jnci/djm155.