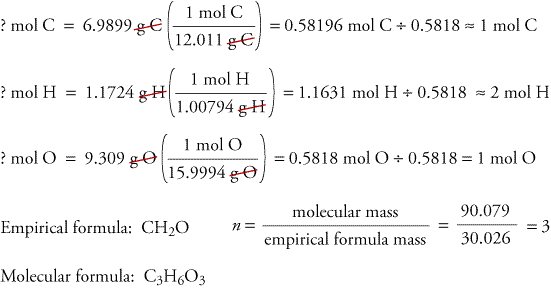Obtención de fórmulas empíricas y moleculares a partir de datos de combustión
Las fórmulas empíricas y moleculares de los compuestos que sólo contienen carbono e hidrógeno (CaHb) o carbono, hidrógeno y oxígeno (CaHbOc) pueden determinarse con un proceso llamado análisis de combustión. Los pasos para este procedimiento son
Pesar una muestra del compuesto a analizar y colocarla en el aparato que se muestra en la imagen inferior.
Quemar el compuesto completamente. Los únicos productos de la combustión de un compuesto que sólo contiene carbono e hidrógeno (CaHb) o carbono, hidrógeno y oxígeno (CaHbOc) son el dióxido de carbono y el agua.
El H2O y el CO2 se hacen pasar por dos tubos. Un tubo contiene una sustancia que absorbe el agua y el otro contiene una sustancia que absorbe el dióxido de carbono. Pesa cada uno de estos tubos antes y después de la combustión. El aumento de masa en el primer tubo es la masa de H2O que se formó en la combustión, y el aumento de masa para el segundo tubo es la masa de CO2 formada.
Suponga que todo el carbono del compuesto se ha convertido en CO2 y ha quedado atrapado en el segundo tubo. Calcule la masa de carbono en el compuesto a partir de la masa de carbono en la masa medida de CO2 formada.
Suponga que todo el hidrógeno del compuesto se ha convertido en H2O y ha quedado atrapado en el primer tubo. Calcule la masa de hidrógeno en el compuesto a partir de la masa de hidrógeno en la masa de agua medida.
Si el compuesto contiene oxígeno además de carbono e hidrógeno, calcule la masa del oxígeno restando la masa de carbono e hidrógeno de la masa total de la muestra original del compuesto.
Use estos datos para determinar las fórmulas empíricas y moleculares de la manera habitual.
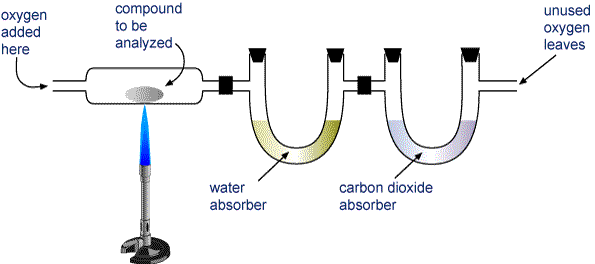
Aparato para el análisis de combustión Un compuesto que contiene carbono e hidrógeno (CaHb) o carbono, hidrógeno y oxígeno (CaHbOc) se quema completamente para formar H2O y CO2. Los productos se hacen pasar por dos tubos. El primer tubo absorbe agua y el segundo absorbe dióxido de carbono.
Para ilustrar cómo se pueden determinar las fórmulas empíricas y moleculares a partir de los datos derivados del análisis de la combustión, consideremos una sustancia llamada trioxano. El formaldehído, CH2O, es inestable como gas puro, formando fácilmente una mezcla de una sustancia llamada trioxano y un polímero llamado paraformaldehído. Por ello, el formaldehído se disuelve en un disolvente, como el agua, antes de ser vendido y utilizado. La fórmula molecular del trioxano, que contiene carbono, hidrógeno y oxígeno, puede determinarse utilizando los datos de dos experimentos diferentes. En el primer experimento, se queman 17,471 g de trioxano en el aparato mostrado arriba, y se forman 10,477 g de H2O y 25,612 g de CO2. En el segundo experimento, se comprueba que la masa molecular del trioxano es de 90,079.
Podemos obtener la fórmula molecular de un compuesto a partir de su fórmula empírica y su masa molecular. (Para obtener la fórmula empírica, necesitamos determinar la masa en gramos del carbono, el hidrógeno y el oxígeno en 17,471 g de trioxano. Por lo tanto, necesitamos realizar estos pasos generales.
Primero, convertir los datos dados a gramos de carbono, hidrógeno y oxígeno.
Segundo, determinar la fórmula empírica a partir de los gramos de carbono, hidrógeno y oxígeno.
Tercero, determinar la fórmula molecular a partir de la fórmula empírica y la masa molecular dada.
Debido a que suponemos que todo el carbono del trioxano ha reaccionado para formarse en CO2, podemos encontrar la masa de carbono en 17,471 g de trioxano calculando la masa de carbono en 25,612 g de CO2.

Como suponemos que todo el hidrógeno del trioxano ha reaccionado para formar H2O, podemos encontrar la masa de hidrógeno en 17,471 g de trioxano calculando la masa de hidrógeno en 10.477 g de H2O.

Debido a que el trioxano contiene sólo carbono, hidrógeno y oxígeno, podemos calcular la masa de oxígeno restando las masas de carbono e hidrógeno de la masa total del trioxano.
? g de O = 17,471 g de trioxano – 6,9899 g de C – 1,1724 g de H = 9.309 g de O
Calculamos ahora la fórmula empírica, la masa de la fórmula empírica y la fórmula molecular.
MuestraHoja de Estudio: Cálculo de fórmulas moleculares a partir de datos de combustión
Tip-off- Se quiere calcular la fórmula molecular de un compuesto que contiene sólo carbono e hidrógeno (CaHb) o carbono, hidrógeno y oxígeno (CaHbOc), y se da su masa molecular y las masas de CO2 y H2O formadas en la combustión de una masa dada del compuesto.
Procedimiento general
Calcular el número de gramos de carbono en el compuesto calculando el número de gramos de carbono en la cantidad dada de CO2.

Calcule el número de gramos de hidrógeno en el compuesto calculando el número de gramos de hidrógeno en la cantidad dada de H2O.

Si el compuesto contiene oxígeno, calcula el número de gramos de oxígeno en él restando las masas de carbono e hidrógeno de la masa total dada del compuesto.
? g O = (dado) g total – (calculado) g C – (calculado) g H
Calcule la fórmula empírica del compuesto a partir de los gramos de carbono, hidrógeno y oxígeno.
Calcule la masa de la fórmula empírica y divida la masa molecular dada por la masa de la fórmula empírica para obtener n.
Multiplica cada uno de los subíndices de la fórmula empírica por n para obtener la fórmula molecular.
Ejemplo – Obtención de una fórmula molecular a partir de datos de combustión:
Dianabol es uno de los esteroides anabólicos que ha sido utilizado por algunosatletas para aumentar el tamaño y la fuerza de sus músculos. Es similar a la hormona masculina testosterona. Algunos estudios indican que los efectos deseados de la droga son mínimos, y los efectos secundarios, que incluyen la esterilidad y el aumento del riesgo de cáncer de hígado y enfermedades del corazón, hacen que la mayoría de la gente no lo utilice. La fórmula molecular del Dianabol, que consiste en carbono, hidrógeno y oxígeno, puede determinarse utilizando los datos de dos experimentos diferentes. En el primer experimento, se queman 14,765 g de Dianabol y se forman 43,257 g de CO2 y 12,395 g de H2O. En el segundo experimento, la masa molecular del Dianabol es de 300,44. ¿Cuál es la fórmula molecular del Dianabol?
Solución: