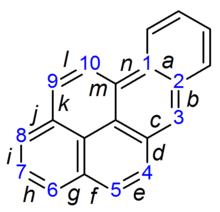
Sistema nerviosoEditar
Se sabe que la exposición prenatal de BaP en ratas afecta al aprendizaje y la memoria en modelos de roedores. Se ha demostrado que las ratas embarazadas que ingieren BaP afectan negativamente a la función cerebral en la última etapa de la vida de sus crías. En un momento en el que las sinapsis se forman por primera vez y se ajustan en fuerza por la actividad, el BaP disminuyó la actividad de las células nerviosas dependientes del receptor NMDA, medida como expresión de ARNm de la subunidad del receptor NMDA NR2B.
Sistema inmunitarioEditar
El BaP tiene un efecto sobre el número de glóbulos blancos, inhibiendo que algunos de ellos se diferencien en macrófagos, la primera línea de defensa del organismo para combatir las infecciones. En 2016, se descubrió que el mecanismo molecular es el daño a la integridad de la balsa lipídica de la membrana de los macrófagos al disminuir el colesterol de la membrana en un 25%. Esto significa que menos inmunorreceptores CD32 (un miembro de la familia Fc de inmunorreceptores) podrían unirse a la IgG y convertir el glóbulo blanco en un macrófago. Por lo tanto, las membranas de los macrófagos se vuelven susceptibles a las infecciones bacterianas.
Sistema reproductorEditar
En experimentos con ratas macho, se ha demostrado que la exposición subcrónica al BaP inhalado reduce en general la función de los testículos y el epidídimo con una menor producción de esteroides sexuales/testosterona y de esperma.
CarcinogenicidadEditar
Los metabolitos del BaP son mutagénicos y altamente cancerígenos, y está catalogado como carcinógeno del Grupo 1 por la IARC. Chemical agents and related occupations, Volume 10, A review of Human Carcinogens, IARC Monographs, Lyon France 2009
En junio de 2016, el BaP se añadió como benzoquisteno a la lista de sustancias candidatas a ser autorizadas por REACH.
Numerosos estudios realizados desde la década de 1970 han documentado vínculos entre el BaP y los cánceres. Ha sido más difícil relacionar los cánceres con fuentes específicas de BaP, especialmente en humanos, y difícil cuantificar los riesgos que suponen los distintos métodos de exposición (inhalación o ingestión). En 2005 se describió una relación entre la deficiencia de vitamina A y el enfisema en los fumadores que se debía al BaP, que induce la deficiencia de vitamina A en las ratas.
Un estudio de 1996 aportó pruebas moleculares que relacionaban los componentes del humo del tabaco con el cáncer de pulmón. Se demostró que el BaP causaba daños genéticos en las células pulmonares idénticos a los observados en el ADN de la mayoría de los tumores malignos de pulmón.
El consumo regular de carnes cocinadas se ha asociado epidemiológicamente con un aumento de los niveles de cáncer de colon (aunque esto en sí mismo no demuestra su carcinogenicidad),Un estudio del NCI de 2005 descubrió que el aumento del riesgo de adenomas colorrectales se asociaba con la ingesta de BaP, y más fuertemente con la ingesta de BaP de todos los alimentos. Sin embargo, los alimentos en sí no son necesariamente cancerígenos, aunque contengan trazas de carcinógenos, ya que el tracto gastrointestinal se protege a sí mismo contra los carcinomas desprendiéndose continuamente de su capa exterior. Además, las enzimas de desintoxicación, como los citocromos P450, tienen una mayor actividad en el intestino para protegerse de las toxinas transmitidas por los alimentos. Así, en la mayoría de los casos, pequeñas cantidades de BaP se metabolizan antes de pasar a la sangre. Los pulmones no están protegidos de ninguna de estas maneras.
Las enzimas de desintoxicación citocromo P450 1A1 (CYP1A1) y citocromo P450 1B1 (CYP1B1) son protectoras y necesarias para la toxicidad del benzopireno. Los experimentos con cepas de ratones diseñadas para eliminar (knockout) el CYP1A1 y el CYP1B1 revelan que el CYP1A1 actúa principalmente para proteger a los mamíferos de dosis bajas de BaP, y que al eliminar esta protección se acumulan grandes concentraciones de BaP. A menos que también se elimine el CYP1B1, la toxicidad resulta de la bioactivación del BaP a benzopireno -7,8-dihidrodiol-9,10-epóxido, el compuesto tóxico definitivo,.
Interacción con el ADNEdit

Hablando con propiedad, el BaP es un procarcinógeno, lo que significa que su mecanismo de carcinogénesis depende de su metabolismo enzimático a epóxido de diol de BaP. Se intercala en el ADN, y el epóxido electrófilo es atacado por las bases de guanina nucleófilas, formando un aducto de guanina voluminoso.

Los estudios cristalográficos de rayos X y de estructura de resonancia magnética nuclear han demostrado cómo esta unión distorsiona el ADN confundiendo la estructura de ADN de doble hélice. Esto interrumpe el proceso normal de copia del ADN y provoca mutaciones, lo que explica la aparición de cáncer tras la exposición. Este mecanismo de acción es similar al de la aflatoxina, que se une a la posición N7 de la guanina.
Hay indicios de que el epóxido de diol de benzopireno se dirige específicamente al gen protector p53. Este gen es un factor de transcripción que regula el ciclo celular y, por tanto, funciona como supresor de tumores. Al inducir las transiciones de G (guanina) a T (timidina) en los puntos calientes de transiciones dentro de p53, existe la probabilidad de que el epóxido de diol de benzopireno inactive la capacidad de supresión de tumores en determinadas células, provocando cáncer.
El bencopireno-7,8-dihidrodiol-9,10-epóxido es el producto carcinogénico de tres reacciones enzimáticas:
- El bencopireno es oxidado primero por el citocromo P450 1A1 para formar una variedad de productos, incluyendo el (+)bencopireno-7,8-epóxido.
- Este producto es metabolizado por la epóxido hidrolasa, abriendo el anillo de epóxido para dar lugar al (-)benzopireno-7,8-dihidrodiol.
- El carcinógeno definitivo se forma tras otra reacción con el citocromo P450 1A1 para dar lugar al (+)benzopireno-7,8-dihidrodiol-9,10-epóxido. Es este epóxido de diol el que se une covalentemente al ADN.
El BaP induce el citocromo P4501A1 (CYP1A1) al unirse al AHR (receptor de hidrocarburos de arilo) en el citosol. Tras la unión, el receptor transformado se transloca al núcleo, donde se dimeriza con el ARNT (translocador nuclear del receptor de aril hidrocarburos) y, a continuación, se une a los elementos de respuesta a los xenobióticos (XREs) en el ADN situados en la parte superior de ciertos genes. Este proceso aumenta la transcripción de ciertos genes, especialmente el CYP1A1, seguido de un aumento de la producción de la proteína CYP1A1. Este proceso es similar a la inducción del CYP1A1 por ciertos bifenilos policlorados y dioxinas. Al parecer, la actividad del CYP1A1 en la mucosa intestinal impide que cantidades importantes de benzopireno ingerido entren en la sangre portal y en la circulación sistémica. La expresión intestinal, pero no hepática, de CYP1A1 depende del receptor 2 similar a TOLL (TLR2), que es un receptor eucariótico para estructuras de superficie bacterianas como el ácido lipoteico.
Además, se ha descubierto que el BaP activa un transposón, LINE1, en los seres humanos.