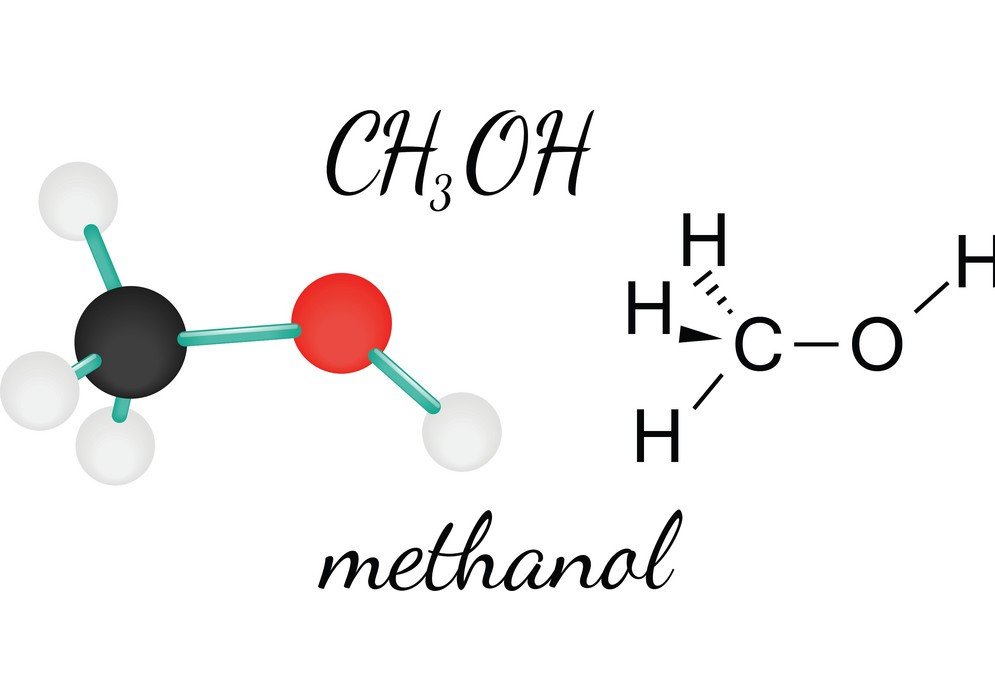
CH3OH o Metanol es un líquido inflamable, incoloro y volátil que tiene un olor alcohólico característico. Estudiando su Metanol, se puede llegar a conocer la forma molecular, el ángulo de enlace y la polaridad de la molécula. La polaridad del CH3OH es una de las características vitales, ya que ayuda a conocer las demás propiedades del compuesto, como su solubilidad, cargas eléctricas y mucho más. Para entender la polaridad del metanol, veamos primero los ángulos de enlace y la disposición de los átomos en la molécula de CH3OH.

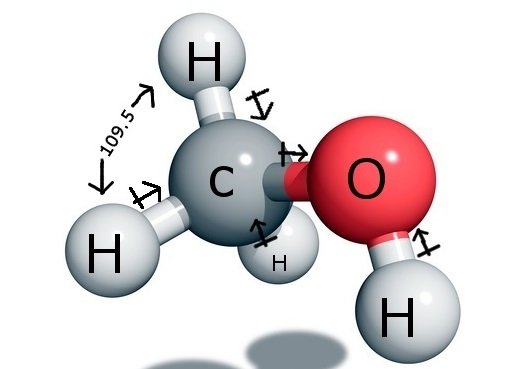
Ángulos de enlace del CH3OH
El átomo de carbono central forma cuatro enlaces en el compuesto, tres con el átomo de hidrógeno y uno con el grupo hidroxilo ( OH). Y como este átomo de Carbono tiene una hibridación sp3 y forma un tetraedro, tiene los ángulos de enlace de 109,5 grados con sus átomos de enlace.
En cambio, el Oxígeno forma un enlace sigma pero tiene dos pares solitarios, por lo que hay una curvatura en su ángulo de enlace debido a las fuerzas de repulsión entre pares de enlace. Esto disminuye el ángulo de enlace a 104,5 grados.
Así el Carbono tiene un ángulo de enlace de 109,5 grados con los tres átomos de Hidrógeno y un ángulo de enlace de 104,5 grados con el grupo hidroxilo.
¿Es polar el CH3OH?
La polaridad de cualquier compuesto depende del momento dipolar neto del compuesto. Este momento dipolar neto puede conocerse observando las cargas eléctricas de los átomos de la molécula. En este caso, los átomos de carbono y oxígeno (que se consideran los centros geométricos de este compuesto) en el metanol son átomos electronegativos. Pero el Oxígeno es más electronegativo que el Carbono o el hidrógeno en el compuesto.
CH3OH no puede ser no polar porque hay una diferencia de cargas eléctricas entre los átomos de la molécula de metanol. El oxígeno tiene más densidad de electrones debido a sus dos pares de electrones solitarios. Esto provoca un dipolo neto que apunta hacia el átomo de oxígeno, haciendo que el CH3OH sea polar.
Además de las cargas eléctricas, la molécula de CH3OH es asimétrica, lo que anula la posibilidad de no polaridad. Una molécula no polar tiene una estructura simétrica, ya que el momento dipolo-dipolo se anula. Pero como hay una curvatura en la forma del Metanol, esto lleva a la formación de una estructura asimétrica que resulta en el extremo negativo del momento dipolar eléctrico neto hacia el átomo de Oxígeno. Así, el CH3OH es una molécula polar.
Ahora que conocemos la polaridad de la molécula de CH3OH, repasemos algunas de sus propiedades físicas:
- El punto de ebullición del Metanol ( CH3OH) es de 64,7 °C.
- El punto de fusión del Metanol es de -97,6 °C.
- El peso molecular del metanol es de 32,04 g/mol.
- Es un disolvente polar y también se conoce como alcohol de madera porque antiguamente se producía mediante la destilación de la madera.
- El olor de este compuesto es más dulce que el del etanol.
Usos del CH3OH
- El metanol también se utiliza para producir hidrocarburos y para la síntesis de otros productos químicos como el formaldehído.
- Se utiliza como anticongelante en las tuberías.
- El CH3OH también se utiliza como aditivo de la gasolina en varios países debido a su bajo punto de fusión.
- El compuesto también se utiliza como combustible en la combustión de motores internos.
- Muchas empresas farmacéuticas utilizan metanol puro para la síntesis de otros compuestos.
Espero que este artículo te ayude a entender la polaridad de la molécula y sus propiedades físicas y usos. El CH3OH es una molécula polar ya que el momento dipolo-dipolo no se cancela debido a su forma asimétrica.