
Antes, la ciencia detrás de la vida basada en el silicio fue determinada como ciencia ficción. Los compuestos de silicio están limitados a arreglos cristalinos invariables, mientras que los compuestos de carbono, es decir, los orgánicos, pueden formar una gran variedad de moléculas de tal manera que cualquier arreglo molecular estable podría formarse espontáneamente y que la selección natural favorecería a aquellas moléculas que sustentan la vida. En la competición prebiótica entre las bases de silicio y carbono para la vida, lo más probable es que dominara el carbono. Pero consideremos la alternativa en la que el agua fuera sustituida por una sustancia química muy familiar, aunque poco probable. ¿Podría existir la vida en un mundo dominado por océanos, lagos y ríos de amoníaco?
La descomposición
El amoníaco es una sustancia tóxica para los seres humanos, los insectos e incluso las bacterias. Es el principal ingrediente de algunos disolventes industriales y soluciones de limpieza y es peligroso para el medio ambiente. El amoníaco es incluso una parte esencial de una receta utilizada para fabricar explosivos de alto rendimiento. ¿Cómo es posible que algo tan letal como el amoníaco permita la aparición y evolución de organismos vivos? Lo creas o no, el amoníaco tiene muchas de las mismas propiedades moleculares que otro compuesto conocido y esencial para la vida: el agua. Algunos astrobiólogos proponen que la vida podría evolucionar en un medio amoniacado del mismo modo que la vida en la Tierra creció en uno hidratado. Imagínese: la misma sustancia que se sabe que disuelve los metales, que quema la piel, que contamina el medio ambiente y que explota si se mezcla de forma inadecuada puede muy bien ser el «Agua de la Vida» en algunos mundos extraterrestres (y no estoy hablando de Dune).
Consideremos primero por qué el amoníaco es un candidato potencial. El amoníaco y el agua son moléculas polares. Las electronegatividades de los átomos de oxígeno y nitrógeno son mayores que las de sus homólogos de hidrógeno. La diferencia de electronegatividad entre el átomo central (ya sea nitrógeno u oxígeno) y los átomos de hidrógeno hace que las moléculas se vuelvan polares. El átomo central adopta una carga ligeramente negativa y los hidrógenos se vuelven ligeramente positivos. Esto hace que el amoníaco y el agua sean potentes disolventes, ya que pueden disolver sales y pequeñas moléculas polares.
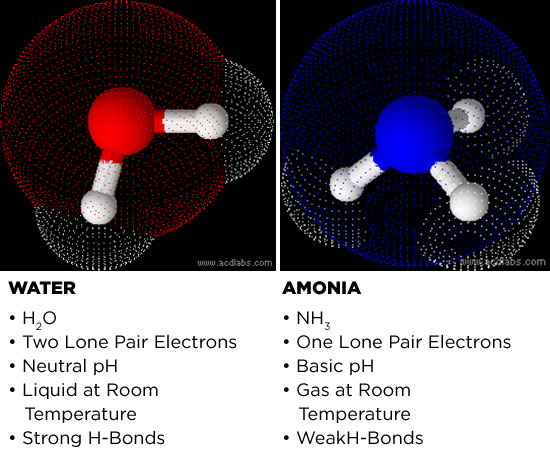
Varias de las propiedades físicas del agua también las comparte el amoníaco. Ambos medios pueden conducir la electricidad, aunque débilmente, y la coordinación de los hidrógenos cargados positivamente con las partes cargadas negativamente de las moléculas cercanas forma una de las fuerzas intermoleculares más fuertes conocidas en química: el enlace de hidrógeno. Esto es análogo a tomar un objeto con carga positiva en un extremo y unirlo electrostáticamente a una carga negativa en otro objeto. En términos sencillos, los enlaces de hidrógeno permiten que las moléculas polares se adhieran entre sí muy bien, de ahí que el agua tenga una tensión superficial y un punto de ebullición tan elevados.
En este sentido, el agua es un disolvente versátil: puede disolver casi «cualquier cosa», y la solubilidad es esencial en condiciones prebióticas. Puede disolver muchas sales y moléculas orgánicas pequeñas y polares como los azúcares y los aminoácidos. La solubilidad de los compuestos orgánicos y las sales es muy importante para la vida porque amortigua las mezclas de reacción para resistir los cambios de pH, salinidad e incluso los estados de oxidación. Un entorno que soporta mejor la vida es uno con concentraciones estables de biomoléculas esenciales.
Otra característica muy importante de las propiedades físicas del agua es el efecto hidrofóbico de los compuestos grandes y no polares. Las sustancias no polares y polares no se mezclan muy bien en solución, por lo que las moléculas no polares tienden a conglomerarse en una solución de moléculas polares. En otras palabras: las moléculas no polares se adhieren entre sí con mucha más fuerza cuando están rodeadas de moléculas polares.
El efecto hidrofóbico es crucial en el proceso de abiogénesis porque impulsa la formación de micelas y proteínas. Sin el efecto hidrofóbico, los lípidos no podrían recocer para formar membranas celulares, y los polímeros de aminoácidos no podrían plegarse para formar proteínas y enzimas funcionales.
Si bien el amoníaco puede tener la capacidad de formar enlaces de hidrógeno, su polaridad palidece en comparación con la del agua. El amoníaco es menos capaz de formar enlaces de hidrógeno y, por consiguiente, el efecto hidrofóbico y la solubilidad de las moléculas orgánicas son también más débiles.
Esto presenta problemas para la abiogénesis. Las pequeñas moléculas bioorgánicas no se disolverían muy bien en el amoníaco. Las proteínas y las membranas pueden ser inestables en una solución de amoníaco porque pueden no plegarse correctamente. Las membranas y los lípidos se convierten en un problema aún mayor; si las membranas celulares no se empaquetan lo suficiente, las células podrían romperse incluso con cambios ambientales leves. La vida sería menos adaptable en un entorno de amoníaco que en un entorno de agua.
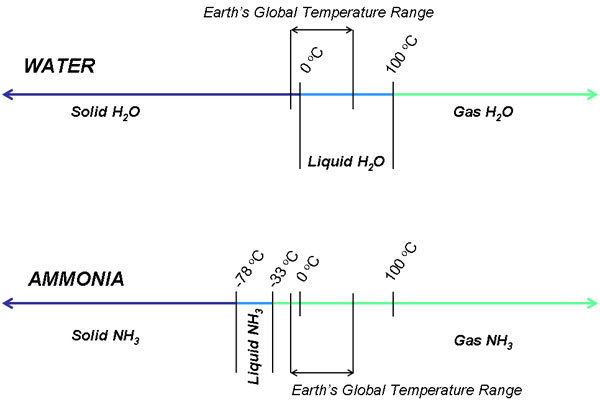
La propia estabilidad del amoníaco líquido es motivo de preocupación. Teóricamente, la vida sólo puede mantenerse en un líquido, no en un gas o en un sólido. Si se evapora con demasiada rapidez o facilidad, los organismos pueden tener más dificultades para adaptarse al entorno. El amoníaco existe como gas a temperatura ambiente, mientras que el agua es estable como líquido desde un rango de temperatura de 0 a 100 grados Celsius. Esto se debe a la fuerza de los enlaces de hidrógeno: cuanto más fuertes sean los enlaces de hidrógeno, más probable será que las moléculas se mantengan unidas el tiempo suficiente para condensarse en un líquido. El amoníaco tiene enlaces de hidrógeno débiles, por lo que la temperatura debe bajar drásticamente bajo la presión atmosférica normal para estabilizar el amoníaco en estado líquido; estamos hablando de un mundo que debe pasar por una Edad de Hielo de 4.000 millones de años. Un planeta frío y muerto no es un candidato ideal para albergar vida.

Superficie de Andoria.
El punto de ebullición del amoníaco es de -33 grados Celsius bajo 14,7 psi de presión, lo que significa que el amoníaco líquido sólo es estable por debajo de esta temperatura a la presión atmosférica de la Tierra. Suponiendo por un momento que el plegado, la conglomeración y la solubilidad de las moléculas orgánicas fueran termodinámicamente probables, habría que mantener una temperatura global de -78 grados Celsius y -33 grados a 14,7 psi. Se trata de una franja demasiado estrecha para que los organismos prosperen; cualquier fluctuación climática leve podría, de hecho, amenazar la supervivencia de la vida basada en el amoníaco. El metabolismo de los nutrientes y la replicación de los organismos se verían interrumpidos por periodos de bajas y altas extremas.
La única solución para este problema es la condensación de un gas utilizando una presión atmosférica más alta en lugar de una temperatura más baja. El gas puede condensarse en un líquido bajo presiones extremas, y la temperatura puede mantenerse muy por encima de su punto de ebullición normal (lo cual es una buena noticia para un clima amoniacal en el que la vida requiere calor para prosperar). El amoníaco se condensa a un líquido bajo una presión equivalente a 12,1 mil atmósferas terrestres a unos 37 grados Celsius. Desgraciadamente, aún no hemos descubierto ni hipotetizado la forma en que un planeta podría albergar una atmósfera tan densa. Venus, un planeta terrestre con la atmósfera más densa que se conoce en la actualidad, tiene un valor de presión de 93 bares en la superficie; esto apenas cumple con la demanda atmosférica de 12.000 bares. Júpiter, la siguiente mejor opción, sólo tiene una presión máxima de unos 1.000 bares en el centro del planeta; de nuevo, difícilmente ideal para nuestros propósitos. Es poco probable que planetas similares tengan presiones atmosféricas lo suficientemente altas como para condensar el amoníaco en un líquido, aunque eso no significa que la vida basada en el amoníaco no pueda surgir por algún otro medio.
El veredicto final
La vida basada en el amoníaco no es un tema importante de Star Trek, y siempre me he preguntado por qué nunca se incluyó en las series. Por desgracia, es poco probable que sea un hecho científico. Es importante señalar que muchas cosas que inicialmente se consideraban imposibles en la ciencia acabaron siendo demostradas por ésta, o al menos en cierta medida. Como siempre recalco en mis artículos: sólo porque algo parezca altamente improbable, no significa que no pueda suceder. Todavía tenemos que descubrir vida basada en el amoníaco, o cualquier otra vida en otros lugares, para que alguien, incluso yo, pueda decir que los extraterrestres amoníacos pueden o no existir. A falta de pruebas absolutas, la especulación es lo mejor que podemos esperar.
En ese sentido, me gustaría concluir con este impresionante extracto editado del Cosmos de Carl Sagan, en el que plantea la hipótesis de un escenario probable en el que la vida podría evolucionar en un mundo como Júpiter.
Sólo porque algo parece improbable que ocurra, siempre nos sorprende en la ciencia descubrir que a veces, por improbable que sea, lo contrario es cierto. Aunque los organismos basados en el amoníaco no puedan existir según nuestros estándares terrestres, ello no implica en absoluto que no pueda ocurrir de otra manera.
Tom Caldwell es licenciado en bioquímica por la UCLA. Actualmente está trabajando para obtener un doctorado en biología molecular.