Introducción
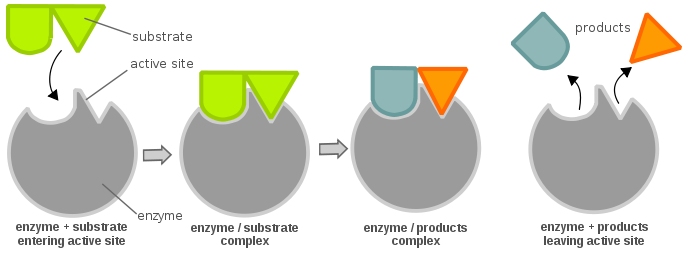
Los sitios activos de una enzima suelen estar compuestos por residuos de aminoácidos; dependiendo de qué residuos de aminoácidos estén presentes, la especificidad del sustrato puede variar mucho. Dependiendo del nivel de pH, las propiedades físicas (principalmente la carga eléctrica) de una enzima pueden cambiar. Un cambio en la carga eléctrica puede alterar la interacción entre los residuos de aminoácidos del sitio activo y el sustrato entrante. Dicho esto, el sustrato puede unirse al sitio activo mediante enlaces de hidrógeno o fuerzas de Van der Waals. Una vez que el sustrato se une al sitio activo, forma un complejo enzima-sustrato que luego participa en otras reacciones químicas.
Para que una enzima esté activa y sea energéticamente favorable para permitir que una reacción química avance, un sustrato debe unirse al «sitio activo» de una enzima. Un sitio activo puede considerarse como una cerradura y el sustrato como una llave; esto se conoce como el modelo de la cerradura y la llave. Hay que introducir una llave (sustrato) y girarla (reacción química), entonces la cerradura (enzima) se abre (producción de productos). Nótese que una enzima puede tener más de un sitio activo. Otra teoría sobre la relación entre el sitio activo y el sustrato es la teoría del ajuste inducido, que es bastante opuesta a la teoría de la cerradura y la llave (donde el sitio activo es aparentemente inflexible). En la teoría del ajuste inducido, el sitio activo de la enzima es muy flexible y sólo cambia su conformación cuando el sustrato se une a él.
Las enzimas funcionan como un catalizador al disminuir la energía libre de Gibbs de activación del complejo enzima-sustrato. A continuación se presentan dos figuras que muestran una reacción enzimática básica con y sin catalizador:
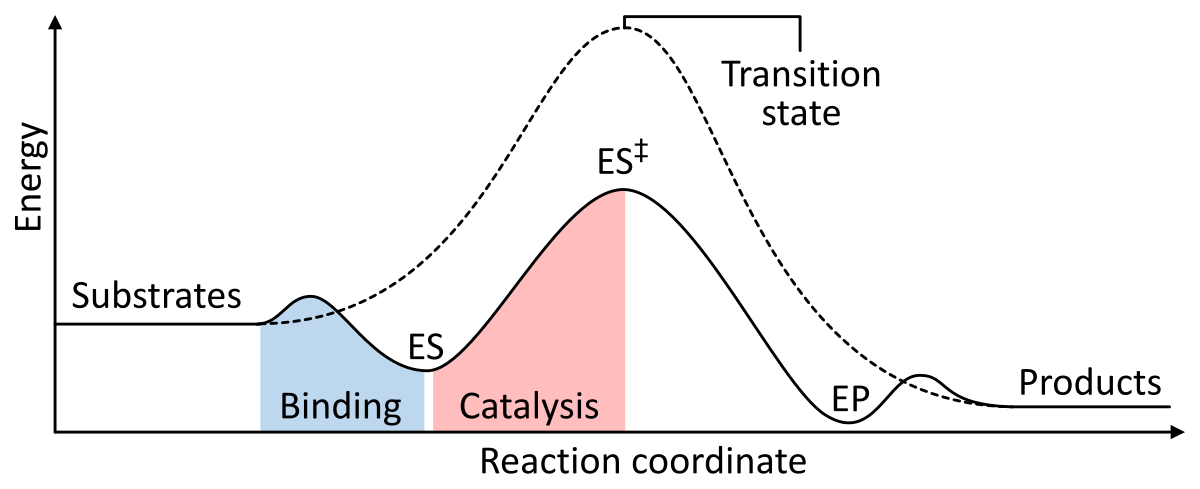
Figura 1: Las energías de las etapas de una reacción química. Sin catalizar (línea discontinua), los sustratos necesitan mucha energía de activación para alcanzar un estado de transición, que luego decae en productos de menor energía. Cuando está catalizada por una enzima (línea sólida), la enzima une los sustratos (ES), luego estabiliza el estado de transición (ES‡) para reducir la energía de activación necesaria para producir productos (EP) que finalmente se liberan. de Wikipedia.
La eficiencia de la enzima se puede determinar de la siguiente manera: considerar una reacción enzimática simple:
El bioquímico alemán Leonor Michaelis y la bioquímica canadiense Maud Menten derivaron una ecuación que describe este sistema, conocida posteriormente como la «Ecuación de Michaelis-Menten», que se muestra a continuación:
{K_M + } \tag{1}]
Esta ecuación da la velocidad de la reacción a una concentración de sustrato dada, suponiendo una Vmax conocida, que es la velocidad máxima a la que puede proceder la reacción, y KM, la constante de Michaelis. Sin embargo, en una aplicación práctica de la Michaelis-Menten, a menudo se mide V0, y Vmax se observa como una saturación o meseta en un gráfico de datos. Dado que se conoce la concentración de sustrato, KM suele ser el valor calculado de interés.
Para \(K_M\), suponga \(V_0= \dfrac{V_{max}{2}):
{K_M + } \tag{2}]
) \dfrac{V_{max}{2} = V_{max} \tag{3}]
= \dfrac{V_{max}} {{dfrac{V_{max}} {2} \tag{4} \La constante de Michaelis puede considerarse como la velocidad a la que el sustrato se separa de la enzima, lo que puede ocurrir en los casos en que el complejo sustrato-enzima se convierte en el producto, o el sustrato se separa de la enzima. El KM puede mostrarse como una ecuación.
Donde k-1 es la constante de velocidad a la que el sustrato se desliga de la enzima, dando lugar a la disociación del complejo enzima-sustrato, k2 es la constante de velocidad en la que el complejo sustrato-enzima desaparece y se convierte en producto, y K1 es la constante de velocidad para la formación del complejo sustrato-enzima. Por lo tanto, el KM puede considerarse como la tasa de desaparición del complejo sustrato-enzima dividida por la tasa de formación del complejo sustrato-enzima, que es el nivel en el que la mitad del sustrato se une a la enzima. El KM es un indicador útil de la presencia de un inhibidor porque podemos buscar cambios en el KM y compararlo con nuestro control (sistemas biológicos que sabemos que no tienen presencia de inhibidores). El KM es una variable dependiente, y su valor puede cambiar debido a muchas razones, incluyendo el nivel de pH del sistema, la temperatura o cualquier otra condición que pueda afectar a una reacción química. Un KM pequeño indica que el sustrato tiene una alta afinidad por la enzima.
La ecuación de Michaelis-Menten es más útil para medir la eficiencia de la enzima si se traza v0 contra , de la siguiente manera:
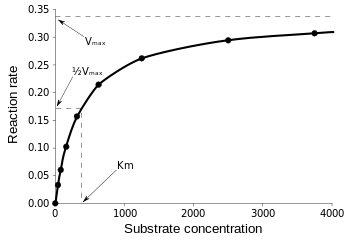
Figura 3: Diagrama de la velocidad de reacción y la constante de Michaelis-Menten. de Wikipedia.
Vmax es la velocidad máxima a la que puede funcionar la reacción, independientemente de , lo que significa que aunque se añada más sustrato, la reacción no puede ir más rápido. Esto se debe a que en Vmax todos los sitios activos de la enzima están ocupados. Después de todas las explicaciones sobre las diversas formas de ecuaciones cinéticas de las enzimas, llegamos a nuestra conclusión sobre la eficiencia catalítica. Volviendo a la Fig. 3, tenemos:
{{o}{dfrac{k_{-1} + k_2}{k_1} + }\right) \tag{8}\]
Nótese que \(k_2\) describe una reacción irreversible en contraposición a una expresión de equilibrio, cuando se compara con k-1 y k1. k2 aquí también se conoce como kcat, la eficiencia catalítica de la enzima. De la discusión anterior, v0 es la velocidad de reacción medida, que es la formación de producto en el tiempo, por lo que se puede concluir que una ecuación se vería como la siguiente:
{dt} = k_2_0 \tag{9}\]
Donde 0 es la concentración total de enzima.
También se sabe que la VMax se observa cuando todo el complejo enzima-sustrato desaparece y se convierte en productos, por lo que podemos hacer la siguiente suposición:
\_0 \tag{10} |]
y tras el reordenamiento, tenemos esta ecuación:
\_0} \tag{11}\]
Esta es la ecuación para calcular la eficiencia catalítica, que se utilizará después de obtener los datos de los experimentos y después de utilizar la ecuación de Michaelis-Menten. Con un kcat mayor, la enzima es eficiente porque se necesita menos enzima.