El tetracloruro de carbono se puede expresar como CCl4, y está compuesto por una molécula de carbono y cuatro de cloruro. El tetracloruro de carbono es apolar. ¿Por qué el tetracloruro de carbono es apolar? Es apolar porque los momentos dipolares de la molécula están uniformemente espaciados alrededor del átomo de carbono central. Esto significa que sus efectos individuales se anulan, y la molécula es neutra.
Los cuatro átomos de cloro están colocados simétricamente en las cuatro esquinas de un tetraedro, y un solo enlace une cada uno de ellos al átomo de carbono en el centro de la molécula. Como resultado, el CCl4 no tiene un momento dipolar neto positivo o negativo. Si un átomo distinto del cloro se hubiera colocado en cualquier otro lugar de la molécula, ésta tendría un momento dipolar y el CCl4 sería, en consecuencia, polar.
«Definimos la química orgánica como la química de los compuestos de carbono». – August Kekule
Esa es la respuesta rápida respecto a la polaridad del tetracloruro de carbono. Sin embargo, sería beneficioso hablar de la polaridad de las moléculas en general y examinar el tetracloruro de carbono y sus propiedades para entender por qué es no polar en la naturaleza.
¿Qué significa que una molécula tenga polaridad?
Cuando escuchas el término polar, probablemente piensas en los polos norte y sur de la tierra. Estos polos norte y sur están situados en los extremos opuestos de la tierra, de forma similar a como una batería puede tener un polo positivo y otro negativo. Las moléculas y los enlaces entre átomos también pueden tener polaridad. Una molécula se define como polar cuando los átomos que constituyen la molécula están dispuestos de manera que un extremo de la molécula tiene carga positiva y el otro extremo de la molécula tiene carga negativa.
Una molécula polar se crea cuando un átomo que tiene un nivel de electronegatividad alto se combina o se une con un átomo que tiene un nivel de electronegatividad más débil. La molécula resultante tiene una región con alta electronegatividad y otra con menor electronegatividad o polos eléctricos. Uno de los ejemplos más famosos de molécula polar es el agua, y es gracias a la naturaleza polar del agua que sirve de base para la vida en la tierra.
En cambio, las moléculas no polares carecen de polos eléctricos, y los electrones dentro de ellas se distribuyen de forma más equitativa. Las moléculas no polares carecen de una carga notable en cada extremo de la molécula. La mayoría de los líquidos hidrocarburos son de naturaleza no polar.
En resumen, una molécula que tiene dipolos que no se anulan entre sí es polar, mientras que las moléculas no polares son aquellas en las que las cargas de los átomos se anulan entre sí y no hay carga en uno u otro extremo de la molécula.
Ejemplos de moléculas polares
Como se ha mencionado anteriormente, el agua es una molécula polar. Los enlaces que existen entre los átomos de oxígeno y los átomos de hidrógeno están distribuidos de tal manera que ambos lados del átomo, tanto del oxígeno-hidrógeno como de los enlaces, están uniformemente espaciados. El resultado es que el lado del oxígeno, o la parte superior de la molécula, tiene una carga ligeramente negativa mientras que los átomos de hidrógeno, o la parte inferior de la molécula, tiene una carga ligeramente positiva.
El etanol es una molécula polar porque los átomos de oxígeno que están dentro de la molécula tienen más electronegatividad que los otros átomos. Los átomos de oxígeno atraen más electrones debido a su mayor potencial de electronegatividad, y los grupos de enlace -OH de la molécula tienen cargas negativas en general, aunque la carga negativa sea muy leve.
«La vida existe en el universo sólo porque el átomo de carbono posee ciertas propiedades excepcionales». – James Jeans
ADVERTENCIA
Otros ejemplos de moléculas polares son el dióxido de azufre (SO2), el sulfuro de hidrógeno (H2S) y el amoníaco (NH3).
Adviértase que una molécula puede estar compuesta por enlaces polares y, sin embargo, ser no polar. Un ejemplo es el dióxido de carbono, que tiene cuatro enlaces y, sin embargo, los momentos dipolares de la molécula acaban neutralizándose entre sí, por lo que la molécula es no polar.
Ejemplos de moléculas no polares

Ejemplos de moléculas no polares son el nitrógeno, el metano, el ozono y el oxígeno. Se trata de moléculas homonucleares o compuestas por átomos de un solo elemento. Las moléculas no polares que no son homonucleares incluyen el dióxido de carbono, mencionado anteriormente y el metano. El tolueno y la gasolina también son ejemplos de sustancias no polares. Como regla general, los compuestos de carbono son no polares, aunque hay algunas excepciones como el monóxido de carbono. El monóxido de carbono es de naturaleza lineal, lo que normalmente convertiría a una molécula en no polar, pero la diferencia de electronegatividad entre la molécula de oxígeno y la de carbono es lo suficientemente sustancial como para que la molécula sea polar. Los alquinos no se disuelven en agua y se consideran moléculas no polares. Los gases inertes o nobles también se clasifican como moléculas no polares porque los gases son sólo átomos de sus respectivos elementos, como el neón, el helio, el argón y el criptón.
Predecir la polaridad de una molécula
Examinar los valores de electronegatividad de los átomos de una molécula le ayudará a determinar si es probable que la molécula sea polar o no. Las diferencias significativas entre los valores de electronegatividad implican que los electrones se reparten por igual entre los átomos de la molécula. Como los electrones estarán más cerca de un átomo que de otro, esa región de la molécula será polar, aunque para determinar la polaridad de toda la molécula hay que tener en cuenta todos los enlaces.
El factor decisivo en la polaridad o no polaridad de una molécula es su geometría. Si un extremo de la molécula tiene una carga negativa mientras que el otro extremo de la molécula tiene una carga positiva, la molécula será polar. Sin embargo, si las cargas están distribuidas uniformemente y orbitan alrededor de un átomo central, la molécula es probablemente no polar. Puedes usar esto para predecir si una molécula será polar o no polar. No todas las moléculas tienen un momento dipolar, y esto puede hacer que predecir la polaridad de una molécula sea un poco más difícil. Por ejemplo, las moléculas que pueden voltearse y reflejarse en un plano geométrico no tienen momentos dipolares porque los momentos dipolares no pueden comprender más que un solo punto.
Datos sobre el tetracloruro de carbono
El tetracloruro de carbono fue descubierto por primera vez por el químico francés Henri Victor Regnault a mediados del siglo XIX. El producto químico se descubrió mediante una combinación de cloro y cloroformo. Sin embargo, hoy en día el tetracloruro de carbono se obtiene principalmente del metano. La producción de tetracloruro de carbono suele realizarse utilizando los subproductos de las reacciones de cloración para obtener el compuesto. Esto incluye los subproductos de la creación de cloroformo y diclorometano. El tetracloruro de carbono es bastante volátil por naturaleza y desprende un olor similar al de los productos químicos de limpieza en seco. El tetracloruro de carbono también es disolvente y, por lo tanto, es útil para disolver sustancias no polares como aceites y grasas.
El tetracloruro de carbono tiene muchas aplicaciones diferentes y se ha utilizado como agente de limpieza, como refrigerante y en extintores. El tetracloruro de carbono se utiliza a menudo en la creación de lámparas de lava, haciendo la cera más pesada.
«… ¿Está la molécula de carbono revestida de pensamiento?» – Saul Bellow
Debido al impacto medioambiental del tetracloruro de carbono, su producción ha disminuido considerablemente desde la década de 1980. El protocolo de Montreal limitó la producción de clorofluorocarbonos y, dado que el tetracloruro de carbono es un ingrediente clave en la creación de los CFC, su producción ha disminuido considerablemente. Los efectos nocivos para la salud del tetracloruro de carbono también han provocado una disminución de su producción, y aunque en su día se utilizó ampliamente como disolvente, en la actualidad apenas se utiliza para tales fines.
El tetracloruro de carbono es extremadamente tóxico para el hígado, y a menudo se comparan otras sustancias que dañan el hígado con la toxicidad del tetracloruro de carbono. Las altas concentraciones de tetracloruro de carbono no sólo pueden dañar el hígado, sino que también pueden dañar los riñones. La exposición prolongada al tetracloruro de carbono puede causar un coma o la muerte. La exposición al producto químico también podría aumentar las posibilidades de desarrollar cáncer.
¿Por qué el tetracloruro de carbono es polar?
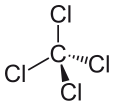
Después de ver lo que hace que una molécula sea polar, y de ver algunos ejemplos de moléculas polares, ahora podemos entender mejor por qué el tetracloruro de carbono es una molécula no polar. Lo primero que hay que hacer cuando se intenta determinar si una molécula es polar y no polar es calcular los valores de electronegatividad de los átomos dentro de la molécula. Hay que averiguar la polaridad del enlace entre dos átomos, y hay que tener en cuenta todos los enlaces cuando se intenta determinar la polaridad de la molécula. Sin embargo, la diferencia de valores de electronegatividad entre el cloruro y el carbono, en el caso del tetracloruro de carbono, no es el único factor que debe considerarse. También hay que tener en cuenta la forma de la molécula. Aunque hay dipolos presentes en la molécula, la forma lineal del tetracloruro de carbono significa que los efectos de los diferentes momentos dipolares en la molécula se cancelan entre sí, y la molécula es neutral o no polar como resultado.