La estructura de Lewis del ion oxalato se dibuja en este tutorial paso a paso. Se utiliza el concepto de electrones de valencia total para dibujar la estructura de lewis del C2O42-. Después de terminar la estructura de lewis del C2O42-, debe haber una carga de -2 y una estabilidad. Aprenderás sobre estas cosas en este tutorial.
El ion oxalato | C2O42-
El ion carbonato tiene una carga -2. Hay dos átomos de carbono en el ion oxalato.
C2O42- Estructura de Lewis
Dos átomos de carbono están unidos a un átomo de carbono. Al igual que los otros dos átomos de oxígeno están unidos al otro carbono. En la estructura de lewis del ion C2O42-, el ion es simétrico alrededor del enlace C-C.
Pasos para dibujar la estructura de lewis del C2O42-
Se requieren los siguientes pasos para dibujar la estructura de lewis del C2O42- y se explican en detalle en este tutorial.
- Encuentra el número total de electrones de las capas de valencia de los átomos de carbono y oxígeno. Esto se utiliza para determinar el número de enlaces, pares solitarios alrededor de los átomos.
- Total de pares de electrones alrededor de los átomos
- Selección del átomo central de acuerdo con la valencia máxima
- Colocar pares solitarios en los átomos
- Comprobar la estabilidad y minimizar las cargas en los átomos para construir la estructura más estable mediante la conversión de pares solitarios en enlaces.
Al igual que estos pasos, los siguientes hechos son importantes para dibujar la estructura de Lewis.
El oxígeno debe tener cargas negativas en la estructura de Lewis porque al oxígeno le gusta mantener los electrones que el átomo de carbono.
La electronegatividad del oxígeno es mayor que la del carbono.
Dibujar correctamente la estructura de lewis es importante para dibujar correctamente las estructuras de resonancia del CO32-.
Número total de electrones de las capas de valencia del C2O42-
El carbono se encuentra en el grupo 4 de la tabla periódica. Por lo tanto, el carbono tiene cuatro electrones en su capa de valencia. El oxígeno se encuentra en el grupo 6. Tiene seis electrones en la capa de valencia.
- Total de electrones de valencia dado por el átomo de carbono = 4 * 2 = 8
Hay cuatro átomos de oxígeno en el ion C2O42-, Por lo tanto
- Total de electrones de valencia dado por los átomos de oxígeno = 6 *4 = 24
Hay -2 carga en el ion C2O42-. Por lo tanto, hay dos electrones más que contribuyen a los electrones de valencia.
- Total de electrones de valencia = 8 + 24 + 2 = 34
Total de pares de electrones de valencia
Total de pares de electrones de valencia = σ enlaces + π enlaces + pares solitarios en las cáscaras de valencia
Total de pares de electrones se determina dividiendo el número total de electrones de valencia por dos. Para, el ion C2O42-, el total de pares de electrones es 17.
Átomo central del ion C2O42-
Para ser el átomo central, la habilidad de tener una valencia más alta es importante. El carbono tiene más posibilidades de ser el átomo central (ver la figura) porque el carbono puede mostrar una valencia de 4. La valencia más alta del oxígeno es 2. Por lo tanto, ahora podemos construir un esquema del ion C2O42-.
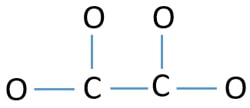
Pares solitarios en los átomos
- Hay cuatro enlaces C-O y un enlace C-C en el esquema anterior, lo que hace cinco enlaces. Por lo tanto, sólo quedan doce (17-5 = 12) pares de electrones de valencia.
- Primero, marca esos doce pares de electrones de valencia como pares solitarios en átomos exteriores (en átomos de oxígeno). Un átomo de oxígeno tomará tres pares solitarios siguiendo la regla octal (el átomo de oxígeno no puede mantener más de ocho electrones en su capa de valencia).
- Para cuatro átomos de oxígeno, se gastan doce pares de electrones. Ahora, no hay más pares solitarios para marcar en los átomos de carbono después de marcar los pares solitarios en los átomos de oxígeno (fuera de los átomos).
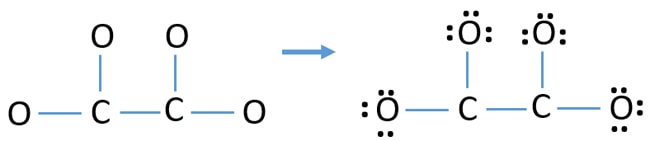
Cargas en los átomos
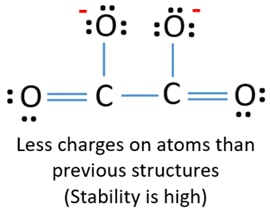
Después, de marcar los pares de electrones en los átomos (en este caso, sólo en los átomos de oxígeno), debemos marcar las cargas de cada átomo si hay una carga. El marcado de las cargas es importante porque se utiliza para determinar la mejor estructura de Lewis del ion. Después de marcar las cargas, verás que cada átomo de oxígeno tendrá una carga -1 y ambos átomos de carbono tendrán una carga +1.
Esta estructura es muy inestable porque hay cargas por todas partes en el ion.
Comprueba la estabilidad y minimiza las cargas de los átomos convirtiendo los pares solitarios en enlaces
- Los átomos de oxígeno deben mantener cargas negativas porque la electronegatividad del átomo de oxígeno es mayor que la del átomo de carbono. De lo contrario, podemos decir que la capacidad de mantener cargas negativas es mayor en los átomos de oxígeno que en los de carbono.
- La estructura dibujada no es estable porque todos los átomos tienen una carga (la estructura de Lewis debería ser estable con menos cargas).
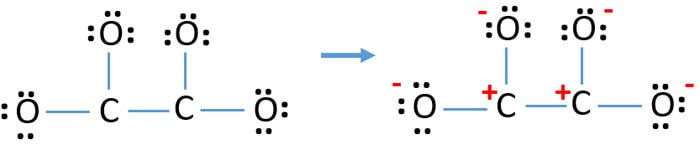
- Ahora, deberíamos intentar minimizar las cargas convirtiendo los pares solitarios en enlaces. Así que convertir un par solitario de un átomo de oxígeno para hacer un enlace C-O.
- Ahora hay un doble enlace entre un átomo de carbono y uno de oxígeno (un enlace C=O). Ahora, hay tres enlaces simples entre el átomo de carbono y otros tres átomos de oxígeno (dos enlaces C-O).
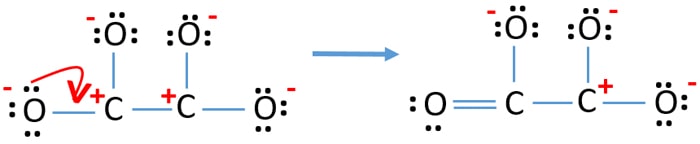
En la nueva estructura, las cargas de los átomos se reducen que la estructura anterior. Ahora no hay carga en un átomo de oxígeno y un átomo de carbono. Pero, todavía hay cargas en tres átomos de oxígeno (tienen -1 cargas negativas) y otro átomo de carbono. Ahora usted entiende esta estructura de C2O42- es más estable que la estructura anterior. Pero, tratamos de reducir los cargos tanto como si es posible.
Reducir los cargos más
Usted puede convertir el par solitario de otro átomo de oxígeno a un enlace C-O como abajo.
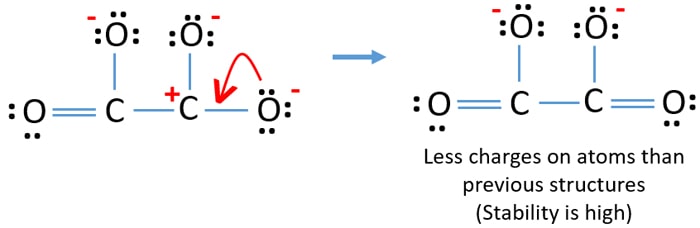
Estructura de lewis del ion C2O42- (carbonato)
Preguntas
Pregunta tus dudas de química y encuentra las respuestas
Tutoriales relacionados