Apoptosis

La apoptosis, o muerte celular programada, es una forma altamente regulada para que un organismo elimine selectivamente las células. Este proceso desempeña un papel importante en la embriogénesis, el mantenimiento del tamaño de un organismo y la eliminación de células dañadas o aberrantes. La importancia de la apoptosis en la salud humana se ve subrayada por las numerosas enfermedades derivadas de una apoptosis aberrante. La desregulación de la apoptosis se ha relacionado con varios tipos de cáncer, trastornos neurológicos y cardiovasculares, y enfermedades autoinmunes.
Con frecuencia distinguimos entre dos tipos diferentes de apoptosis: la vía intrínseca, mediada por las mitocondrias en respuesta a estímulos internos como el daño al ADN, y la vía extrínseca, mediada por receptores de muerte extracelulares (por ejemplo, la unión de FasL al receptor FasLG) (Figura 1). Ambas vías dependen de unas proteasas denominadas caspasas iniciadoras que activan una cascada de caspasas efectoras, lo que conduce a la apoptosis. La diafonía entre las vías intrínseca y extrínseca está mediada por el agonista de la muerte del dominio de interacción BH-3 (Bid).
La vía intrínseca (Figura 1) se inicia por las proteínas de homología Bcl-2. En la vía clásica de la apoptosis, las proteínas Bcl-2 Bax y Bak se activan en respuesta a estímulos internos como el daño al ADN o el estrés oxidativo. Estas dos proteínas interactúan posteriormente con Bid y se insertan en la membrana mitocondrial externa. Esto da lugar a lo que se considera el punto de no retorno en la apoptosis: la permeabilización de la membrana externa mitocondrial (MOMP). La MOMP conduce a la liberación de factores pro-apoptóticos como el citocromo c en el citoplasma. El citocromo c en el citoplasma se une a APAF-1 y dATP para reclutar a la pro-caspasa- 9, formando el apoptosoma. La formación del apoptosoma desencadena la escisión de la pro-caspasa-9 en su forma de proteasa activa, la caspasa-9. La caspasa-9 es una caspasa iniciadora que luego activa las caspasas efectoras posteriores, como la caspasa-3 y -7, a través de la proteólisis, desencadenando la cascada de caspasas que conduce a la apoptosis.
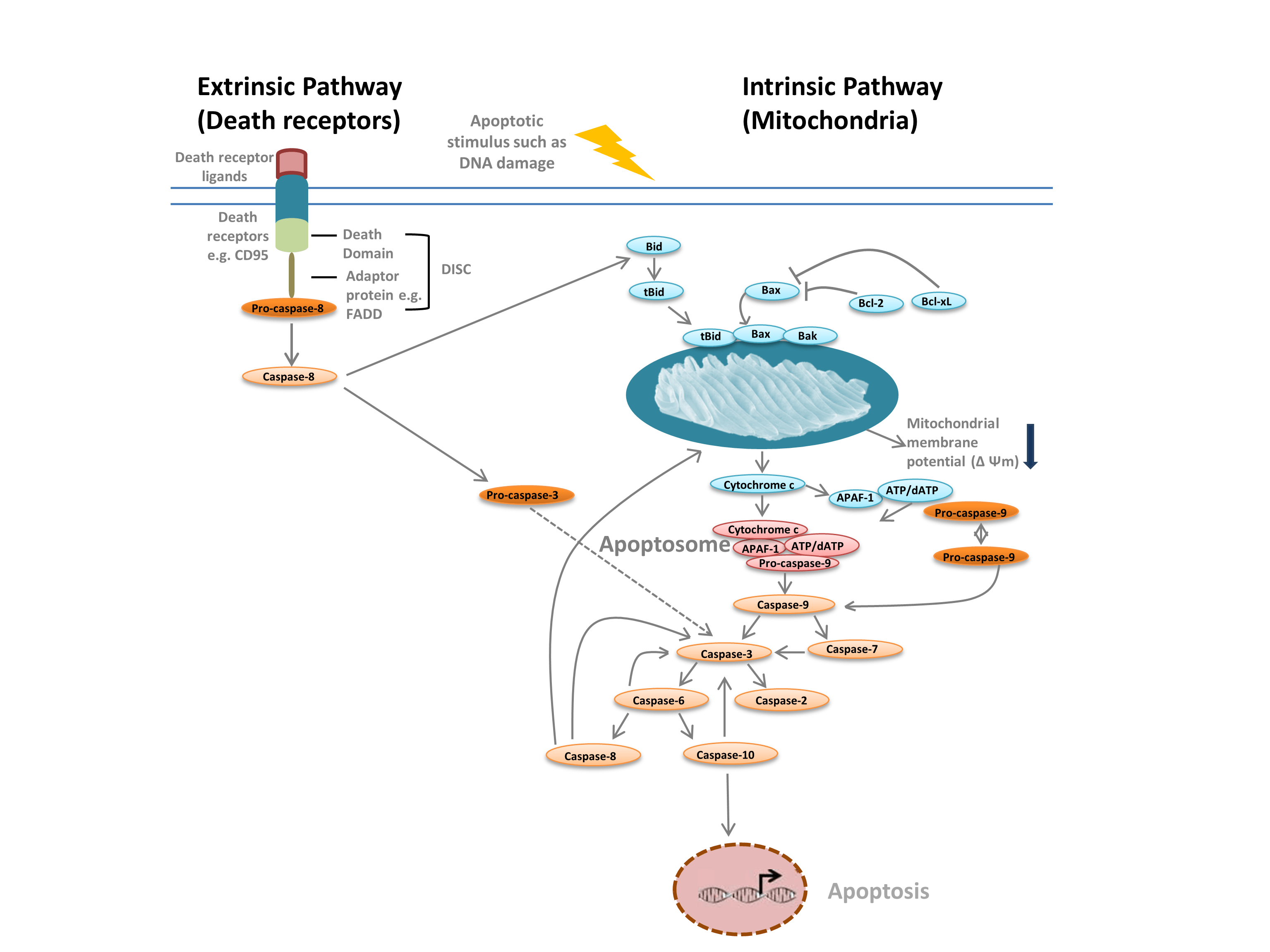
Fig. 1. Vías de la apoptosis.
La vía extrínseca se desencadena por la unión de ligandos a los receptores de muerte. Tras la unión del ligando, los receptores de muerte se oligomerizan y reclutan proteínas adaptadoras como FADD. Esto permite el reclutamiento de la pro-caspasa-8, la forma inactiva de la caspasa-8 iniciadora, y la formación del complejo de señalización inductor de la muerte (DISC). La pro-caspasa-8 se oligomera y se escinde en su forma activa, la caspasa-8, que a su vez escinde y activa la caspasa-3 efectora. La caspasa-3, a su vez, activa proteolíticamente otras caspasas, lo que conduce a la apoptosis. En algunos casos, la activación de la vía extrínseca también puede conducir a la activación de la vía intrínseca, mediada por Bid.
La apoptosis es distinta de la muerte celular no programada/necrosis. La necrosis es un proceso no regulado iniciado por un daño externo y se diferencia de la apoptosis en varios aspectos clave (Tabla 1). Sin embargo, a medida que hemos ido aprendiendo más sobre la apoptosis y la necrosis y hemos identificado nuevos mecanismos de muerte celular, como la necroptosis, los límites entre la apoptosis y la necrosis se han vuelto más difusos. Sin embargo, los rasgos distintivos que se indican en la Tabla 1 siguen siendo pautas útiles.
Tabla 1. Características de la apoptosis y la necrosis.
| Apoptosis | Necrosis |
| Las células se encogen | Se hinchan |
| Los fagocitos/macrófagos engullen las células | Los restos celulares se liberan restos celulares |
| El proceso es no inflamatorio | El proceso es inflamatorio |
Es útil dividir este proceso en etapas al analizar la apoptosis:
- Se inicia la apoptosis y se activan las cascadas de señalización
- Las células se encogen y redondean, mediada por las caspasas
- Los orgánulos cambian de forma y las membranas comienzan a sangrar
- Comienza la condensación nuclear
- Se observa la fragmentación del ADN
- Se forman cuerpos apoptóticos
- Los cuerpos apoptóticos son fagocitados
Estas etapas apoptóticas, junto con los mediadores conocidos de la apoptosis, pueden utilizarse como identificadores de la apoptosis. A la hora de elegir un ensayo de apoptosis, piense en la pregunta que desea formular: los ensayos de actividad de caspasas son excelentes indicadores de la iniciación de la apoptosis, mientras que los ensayos de fragmentación del ADN pueden utilizarse para identificar las células en las últimas etapas de la apoptosis, cuando están irreversiblemente comprometidas con la muerte celular programada.
Cuando se realizan ensayos de apoptosis siempre es conveniente incluir colorantes de viabilidad como el yoduro de propidio (PI) para diferenciar las células apoptóticas de las necróticas e inspeccionar visualmente las células o los tejidos al microscopio en busca de indicadores morfológicos clave de apoptosis.
Evaluación de la apoptosis
1. Cambios morfológicos
Las imágenes de lapso de tiempo de las células vivas pueden utilizarse para seguir la apoptosis en tiempo real y son particularmente útiles para identificar el sangrado de la membrana. En el caso de los tejidos, la microscopía electrónica de transmisión puede utilizarse para identificar muchos de los cambios estructurales que acompañan a las etapas de la apoptosis. Los tejidos también pueden teñirse con hematoxilina y eosina para visualizar los macrófagos que han engullido células apoptóticas. El naranja de acridina (AO) es otro colorante comúnmente utilizado para visualizar las células apoptóticas. Este popular colorante de viabilidad y proliferación puede utilizarse para evaluar la apoptosis porque su espectro de emisión cambia a naranja cuando se encuentra en el entorno ácido del lisosoma; esto hace que el colorante sea útil para identificar las células apoptóticas engullidas. Los colorantes que se unen al ADN, como DAPI, Hoechst, yoduro de propidio (PI) y 7-AAD, se pueden utilizar para visualizar la decoloración nuclear, mientras que el encogimiento celular se puede detectar en un citómetro de flujo como una reducción de la dispersión frontal (FSC) o visualmente mediante microscopía de luz.
2. Cambios en el potencial de la membrana mitocondrial
Los cambios en el potencial de la membrana indican que una célula ha superado el punto de no retorno y ahora está comprometida con la apoptosis. El colapso del potencial de la membrana mitocondrial puede detectarse mediante citometría de flujo o inmunofluorescencia utilizando colorantes potenciométricos.
El éster etílico de la tetrametilrhodamina (TMRE), el éster metílico de la tetrametilrhodamina (TMRM) y el JC-1 son colorantes potenciométricos comúnmente utilizados. El TMRE y el TMRM se agregan en las mitocondrias de las células no apoptóticas y presentan una fluorescencia naranja o roja brillante. En las células apoptóticas con un potencial de membrana mitocondrial reducido, estos colorantes se encuentran en todo el citoplasma en su forma monomérica y muestran una fluorescencia roja reducida. Los colorantes pueden utilizarse en combinación con ensayos de inhibidores de caspasas marcados con fluoróforos (FLICA) (véase la siguiente sección) para identificar las células apoptóticas basándose en dos características: la reducción del potencial de la membrana mitocondrial y la activación de las caspasas (Figura 2).
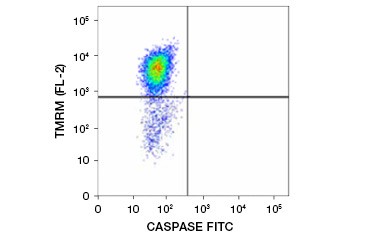
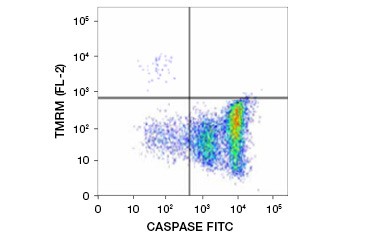
Fig. 2. Detección de la reducción del potencial de membrana mitocondrial y de la activación de caspasas mediante citometría de flujo. La pérdida simultánea de la fluorescencia naranja de la TMRM y el aumento de la fluorescencia verde, que muestra la activación de las caspasas medida por el kit FAM-FLICA Polycaspase, muestra las células apoptóticas (cuadrante inferior derecho).
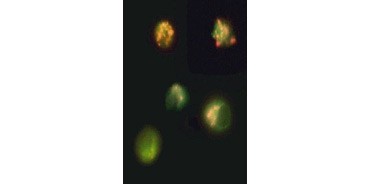
Fig. 3. Descomposición del potencial de la membrana mitocondrial visualizada con JC-1. Las células Jurkat se tiñeron con MitoPT JC-1. Las células no apoptóticas (arriba) muestran mitocondrias teñidas de rojo, mientras que las células en varias etapas de apoptosis muestran fluorescencia citoplasmática verde.
JC-1 también se agrega en las mitocondrias de las células no apoptóticas y se encuentra difundido por toda la célula en las células apoptóticas. A diferencia del TMRE y el TMRM , que muestran una fluorescencia reducida, el JC-1 cambia de color, de rojo a verde. Esto permite distinguir fácilmente las células fluorescentes rojas no apoptóticas y las células fluorescentes verdes apoptóticas (Figura 3). Estos ensayos pueden leerse utilizando un microscopio de fluorescencia, un citómetro de flujo o un lector de microplacas adecuadamente equipado.
3. Activación de caspasas
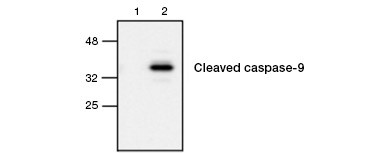
Fig. 4. La caspasa-9 activa se detecta mediante western blot. Análisis de Western blot de células no tratadas (carril 1) y tratadas con etopósido (carril 2) sondeadas con el anticuerpo conejo anti-caspasa-9 (activa). La caspasa-9 activa se detecta sólo cuando se induce la apoptosis con etopósido.
La activación de la caspasa es una característica que define la apoptosis. Las caspasas apoptóticas clave comúnmente analizadas son las caspasas iniciadoras 3, 6 y 7 y las caspasas efectoras 2, 8, 9 y 10. La activación de las caspasas puede identificarse por la reducción del tamaño de las pro-caspasas a medida que se escinden o por el uso de anticuerpos que interactúan sólo con la forma escindida y activada (Figura 4). Ambos enfoques pueden leerse mediante western blotting, mientras que el último enfoque también puede adaptarse a ensayos de fluorescencia e inmunohistoquímica eligiendo anticuerpos conjugados con fluoróforos o biotina. Estos ensayos son compatibles tanto con células fijadas como sin fijar.
Una cosa que debe tenerse en cuenta es que las caspasas iniciadoras están muy arriba en la vía de señalización de la apoptosis y que su activación no siempre resulta en apoptosis. Por lo tanto, es prudente emparejar los ensayos para las caspasas iniciadoras con los de las caspasas efectoras o, mejor aún, con sondas para eventos aguas abajo del punto de no retorno, como la MOMP.
Otra clase de ensayos de activación de caspasas son los sustratos de caspasas marcados con fluoróforos, como los ensayos FLICA. Los ensayos FLICA se unen de forma covalente e irreversible a las caspasas activadas; cualquier inhibidor no unido se difunde fuera de las células y/o puede eliminarse con lavados. Estos inhibidores están disponibles fusionados con colorantes rojos o verdes. La intensidad de la fluorescencia puede utilizarse como medida cuantitativa de la actividad de las caspasas: las células apoptóticas con alta actividad de caspasas mostrarán más fluorescencia que las que tienen baja actividad de caspasas. Los ensayos FLICA son compatibles con células vivas, secciones de tejido y secciones delgadas congeladas, pero no con células fijadas o tejidos embebidos en parafina, y pueden leerse cuantificando la intensidad de la fluorescencia mediante microscopía de fluorescencia, citometría de flujo (Figura 2) o un lector de microplacas.
Para sacar conclusiones sólidas de los ensayos de actividad de caspasas siempre es conveniente elegir más de un objetivo.
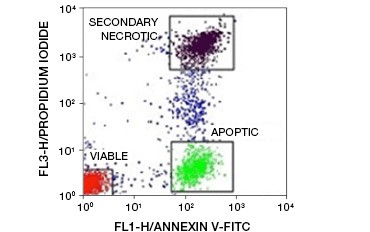
Fig. 5. Los conjugados de Annexin-V pueden utilizarse para distinguir las células apoptóticas de las necróticas y viables. Diagrama de puntos que muestra las células de Ramos teñidas con anexina V:FITC frente al yoduro de propidio. Se observan tres poblaciones distintas.
4. Externalización de fosfatidilserina
Una característica clave de la apoptosis que es detectable incluso en etapas tempranas es la externalización de fosfatidilserina (PS), un fosfolípido que se encuentra exclusivamente en la membrana interna de las células sanas. La anexina-V se une a la fosfatidilserina y, por tanto, los conjugados de anexina-V pueden utilizarse para evaluar la apoptosis. Estos ensayos se realizan habitualmente por citometría de flujo utilizando anexina-V marcada con fluoróforos. Combinando este colorante con cualquier colorante de viabilidad, como el PI, se pueden distinguir las células apoptóticas de las necróticas. En estos experimentos de citometría de flujo de dos colores se pueden distinguir fácilmente tres poblaciones: células viables doblemente negativas a la anexina-V/PI, células apoptóticas positivas a la anexina-V/PI y células necróticas secundarias doblemente positivas a la anexina-V/PI
(Figura 5).
La externalización de la fosfatidilserina es un proceso dinámico y reversible hasta que una célula queda comprometida con la apoptosis tras la MOMP. Utilizando conjugados de anexina-V es imposible distinguir las etapas tempranas y reversibles de la apoptosis de las etapas posteriores de la apoptosis cuando una célula está comprometida con la muerte. Las sondas de indicador de viabilidad y apoptosis sensibles a la polaridad (pSIVA) son biosensores que se unen de forma reversible a la PS y, por tanto, se activan y desactivan a medida que la PS pasa de la membrana externa a la interna (Figura 6). Otra ventaja del ensayo pSIVA es que, a diferencia de los conjugados de anexina-V, las sondas pSIVA pueden añadirse directamente a las células sin necesidad de realizar pasos de lavado. Este ensayo puede leerse mediante inmunocitoquímica y microscopía de inmunofluorescencia, incluyendo imágenes de células vivas, lo que permite comparar fácilmente las diferencias en las tasas de apoptosis en respuesta a diferentes tratamientos experimentales en tiempo real. Dado que la apoptosis se monitoriza en tiempo real, este ensayo no es compatible con células fijadas.
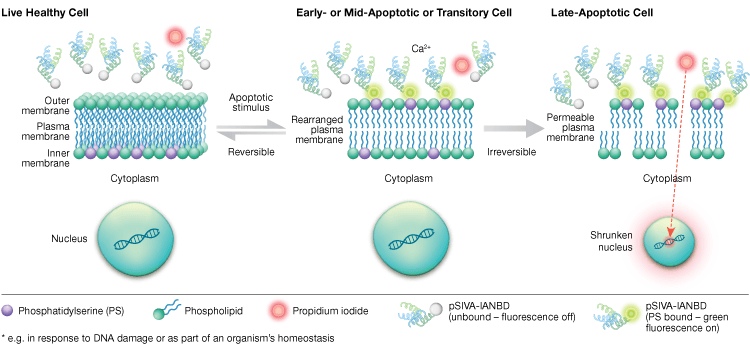
Fig. 6. El ensayo pSIVA puede distinguir células vivas, apoptóticas tempranas y apoptóticas tardías mediante la monitorización de la externalización e internalización de la fosfatidilserina en tiempo real.
5. Fragmentación del ADN
La fragmentación del ADN es una de las últimas etapas de la apoptosis y suele analizarse mediante la detección del escalamiento del ADN utilizando la electroforesis basada en la agarosa o el método de etiquetado de extremos níquel de la desoxinucleotidil transferasa terminal (TUNEL).
Una característica definitoria de la apoptosis es la fragmentación del ADN en fragmentos de ~180 pb por las endonucleasas activadas por la caspasa. El ADN genómico extraído en un gel de agarosa mostrará, por tanto, un escalamiento característico del ADN que no se observa en las células que mueren por otros mecanismos, como la necrosis.
El método TUNEL es otra forma de detectar la creación de oligonucleosomas por la endonucleasa activada por la caspasa. La escisión del ADN da lugar a grupos hidroxilos 3′ (grupos 3′-OH). El ensayo TUNEL utiliza la enzima desoxinucleotidil transferasa terminal (TdT) para añadir BrdU a estos grupos 3′-OH. El BrdU incorporado puede detectarse entonces utilizando anticuerpos anti-BrdU marcados con biotina o un fluoróforo. Este ensayo es compatible con la citometría de flujo, así como con la inmunohistoquímica y la inmunofluorescencia, y puede convertirse en una lectura radiomarcada utilizando -TdR en lugar de BrdU. Las células deben fijarse después de la incorporación de BrdU antes de la tinción.
La fragmentación del ADN también puede medirse por citometría de flujo utilizando el ensayo sub-G1. Los pequeños fragmentos de ADN, de ~180 pb, generados durante la apoptosis se escapan de las células, disminuyendo el contenido total de ADN de las células apoptóticas. Al teñir el ADN con PI, las células apoptóticas hipodiploides pueden contarse en el pico sub-G1 del histograma de PI.
6. Paneles de marcadores de apoptosis múltiplex
Por último, muchos proveedores venden paneles para el análisis de inmunoensayo múltiplex de poblaciones celulares. Estos paneles pueden analizar múltiples marcadores de apoptosis a la vez.
Independientemente del método utilizado para detectar la apoptosis, deben incluirse controles adecuados, ya que las condiciones experimentales y el tipo de célula pueden alterar el rendimiento de algunos ensayos. Incluya siempre controles positivos y negativos. Incluya controles tratados con vehículo para tener en cuenta los efectos de los disolventes, controles específicos de la aplicación para controlar factores como la autofluorescencia en los experimentos de inmunofluorescencia y controles de carga para la técnica de Western blot.
Tabla 2. Resumen de los ensayos para la detección de los signos distintivos de la apoptosis.
| Etapa de apoptosis | Reactivos para permitir la detección | Aplicación |
| Conjugados de anexina-V, sondas pSIVA | Citometría de flujo, microscopía | |
| Cascadas de señalización iniciadas | FLICA, anticuerpos contra caspasas | Citometría de flujo, microscopía, western blot |
| MOMP | TMRM, TMRE, JC-1 | Citometría de flujo, microscopía, lector de microplacas |
| Contracción celular | Citometría de flujo, microscopía | |
| Sangrado de la membrana | hematoxilina + eosina | Microscopía |
| Condensación nuclear | DAPI, Hoechst, PI, 7-AAD | Microscopía |
| Fragmentación del ADN | TUNEL, Ensayo Sub-G1, DNA laddering | Gel de agarosa, citometría de flujo, microscopía |
| Fagocitosis de cuerpos apoptóticos | Naranja de acridina, hematoxilina + eosina | Citometría de flujo, microscopía óptica y electrónica |
.