Introducción
Los antioxidantes naturales constituyen una parte importante de las defensas del huésped contra la exposición ambiental a agentes nocivos (Davies, 1995). Los estados pro-oxidantes surgen cuando las especies reactivas de oxígeno (ROS) formadas durante el metabolismo superan la capacidad antioxidante celular (Davies, 1995). Aunque las ERO actúan como mediadoras de la regulación y la señalización homeostática celular (Forman et al., 2010), la producción excesiva de ERO puede contribuir a la patogénesis de enfermedades humanas, como el cáncer y las enfermedades cardiovasculares (ECV; Dröge, 2002; Valko et al., 2006; Sugamura y Keaney, 2011). Las células contienen sustancias químicas solubles en agua y lípidos y enzimas antioxidantes que funcionan para limitar las reacciones oxidativas perjudiciales y preservar la homeostasis de los tejidos (Halliwell y Gutteridge, 1999; Davies, 2000). Además, muchas sustancias alimentarias pueden absorberse y servir como antioxidantes sistémicos (Kaliora et al., 2006; García-Lafuente et al., 2009). Por lo tanto, muchas investigaciones se han dirigido a la explotación de compuestos antioxidantes de origen natural como terapéuticos en la prevención o el tratamiento de enfermedades humanas (Kaliora et al., 2006; García-Lafuente et al., 2009; Sugamura y Keaney, 2011).
Los pigmentos biliares biliverdina (BV) y bilirrubina (BR) se originan como productos de la degradación del hemo (Roy-Chowdhury et al., 2008; Figura 1). Estos pigmentos han sido considerados por la comunidad médica como productos de desecho del metabolismo (Vitek y Ostrow, 2009). Sin embargo, los BV/BR presentan propiedades antioxidantes en sistemas modelo (Stocker et al., 1987a). La RB circulante actúa como un potente antioxidante sérico y sirve como factor antiaterogénico natural (Stocker et al., 1987b). Los estudios clínicos retrospectivos y prospectivos indican que los niveles ligeramente elevados de BR (hiperbilirrubinemia leve) se asocian a un menor riesgo de ECV (Franchini et al., 2010). Se han descrito efectos beneficiosos de la RB/BV farmacológica en modelos preclínicos de lesión tisular y enfermedad, incluyendo el trasplante de órganos, la enfermedad pulmonar y la ECV (Ollinger et al., 2007; Ryter et al., 2007). Estos efectos implican mecanismos antioxidantes, antiinflamatorios, antiapoptóticos y antiproliferativos (Ollinger et al., 2007; Ryter et al., 2007). En esta revisión se analiza la aplicación terapéutica de la RB/BV en la enfermedad, así como los datos clínicos sobre el papel de la RB endógena como factor de riesgo inverso de ECV.
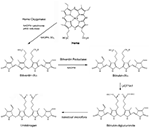
Figura 1. Secuencia de formación y degradación del pigmento biliar. La hemo oxigenasa (HO) degrada el hemo a biliverdina-IXα (BV), en una reacción que genera monóxido de carbono (CO) y hierro ferroso, a expensas de NADPH y oxígeno molecular. La BV se reduce a bilirrubina-IXα (BR) mediante la biliverdina reductasa (BVR) NAD(P)H. La BR es conjugada con ácido glucurónico en sus cadenas laterales de propionilo por la UDP-glucuroniltransferasa-1A1 (UGT1A1) hepática, para formar mono- y di-glucurónidos de BR. La microflora intestinal puede metabolizar el BR en urobilinógeno.
Origen y destino metabólico de la bilirrubina
La bilirrubina que se forma in vivo procede del recambio de la hemoglobina (∼80%) durante la degradación de los eritrocitos por los macrófagos reticuloendoteliales. El resto de la formación de BR resulta del recambio de hemoproteínas en los tejidos sistémicos. La biliverdina-IXα (BV-IXα), precursora de la BR, es un pigmento hidrosoluble que se origina durante la degradación del hemo catalizada por la actividad hemo oxigenasa (HO; C.E. 1:14:99:3), representada por isozimas constitutivas (HO-2) e inducibles (HO-1) (Tenhunen et al., 1969; Maines, 1997).
La actividad de la hemo oxigenasa, el paso que limita la tasa de degradación del hemo, requiere tres moles de O2 por hemo oxidado, y electrones de la citocromo-p450 reductasa NADPH (Yoshida y Kikuchi, 1974; Noguchi et al., 1979; Yoshida et al., 1980). Cada mol de BV-IXα formado produce un mol de monóxido de carbono (CO), derivado del carbono α-metano del hemo, y de hierro ferroso (Tenhunen et al., 1969). La BV-IXα se reduce a bilirrubina-IXα (BR-IXα), un pigmento soluble en lípidos, mediante la biliverdina reductasa dependiente de NADH/NADPH (BVR; C.E. 1.3.1.24; Tenhunen et al., 1970).
La bilirrubina sigue una secuencia de pasos biológicos de transformación y eliminación (Figura 2). La BR formada in situ pasa al suero donde circula en un complejo con la albúmina sérica (Roy-Chowdhury et al., 2008; Vitek y Ostrow, 2009). Una fracción del BR no conjugado en suero circula libremente (∼0,01%; Vitek y Ostrow, 2009). El BR no conjugado es captado por el hígado mediante difusión facilitada, en la que participan transportadores de iones orgánicos (por ejemplo, SLCO1B1; Kamisako et al., 2000; Cui et al., 2001). El transporte intracelular de BR en los hepatocitos está asistido por la ligandina, un complejo de subunidades de glutatión-S-transferasa (GST), y por la proteína-Z (Litwack et al., 1971). La BR es conjugada en los hepatocitos por la uridina difosfato (UDP) glucuroniltransferasa (UGT1A1; EC: 2.4.1.17; Chowdhury et al., 1979). La BR conjugada (mono y di-glucurónidos) es bombeada desde los hepatocitos a través de la membrana canalicular por la proteína 2 de resistencia a los fármacos y se excreta a través de la bilis hacia el intestino (Chowdhury y Chowdhury, 1983; Wang et al., 2006a).
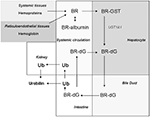
Figura 2. Biodistribución de la BR. El BR se genera en los tejidos sistémicos como producto de la degradación de las hemoproteínas (es decir, la hemoglobina). El BR formado en los tejidos pasa libremente a la circulación, donde existe principalmente en un complejo con la albúmina sérica. El BR es captado por los hepatocitos por difusión facilitada. En el hepatocito, el BR es transportado por la glutatión-S-transferasa (GST), y luego conjugado por la UDP-glucuroniltransferasa-1A1 (UGT1A1) para formar el di-glucurónido de bilirrubina (BR-dG). El BR conjugado (BR-dG) es entonces bombeado al conducto biliar y llega al intestino. La BR conjugada puede reabsorberse en el intestino y volver a entrar en la circulación (Roy-Chowdhury et al., 2008; Vitek y Ostrow, 2009). El metabolismo del BR en el intestino por acción bacteriana genera urobilinógeno (UB) y su producto de oxidación urobilina, este último eliminado en las heces. El urobilinógeno intestinal puede ser reabsorbido por el intestino y eliminado en la orina como urobilina (Chowdhury y Chowdhury, 1983; Wang et al., 2006a).
Efectos antioxidantes de los pigmentos biliares
El potencial para el uso de los pigmentos biliares como terapéuticos se originó con el descubrimiento de que estas sustancias actúan como antioxidantes naturales. Stocker et al. demostraron que la BV, la BR y la BR conjugada inhiben la peroxidación de los lípidos en preparaciones liposomales sometidas a la acción de sustancias químicas iniciadoras de radicales libres (Stocker y Ames, 1987; Stocker et al., 1987a; Stocker y Peterhans, 1989a). En estos sistemas modelo, el BR y el BV ejercieron una actividad de ruptura de cadenas y de captura de radicales peroxilo (Stocker y Ames, 1987; Stocker et al., 1987a). La BV y la BR conjugada actuaron como co-antioxidantes con el α-tocoferol, e inhibieron el consumo de α-tocoferol (Stocker y Peterhans, 1989a). El BR también previno el daño oxidativo de las proteínas, como la albúmina sérica expuesta a sistemas generadores de ROS (Stocker et al., 1987b; Neuzil y Stocker, 1993). El BR libre y unido a la albúmina inhibió la oxidación de los lípidos unidos a las LDL, al actuar como co-antioxidantes con el α-tocoferol unido a las LDL (Neuzil y Stocker, 1994).
La bilirrubina puede reaccionar con el radical anión superóxido, el ácido hipocloroso y el oxígeno molecular singlete, inhibir la foto-oxidación de las proteínas e inhibir la quimioluminiscencia en los macrófagos activados (Stevens y Small, 1976; Pedersen et al., 1977; Stocker y Peterhans, 1989b). El BR también puede reaccionar con el NO o las especies reactivas de nitrógeno (RNS; Kaur et al., 2003; Mancuso et al., 2003). Por último, la BR conjugada forma un complejo cúprico que promueve la descomposición de los hidroperóxidos, lo que representa una actividad prooxidante en la bilis (Stocker y Ames, 1987).
La bilirrubina sirve como antioxidante circulante en el plasma humano. El tratamiento del plasma con agentes oxidantes provocó el agotamiento de los antioxidantes endógenos en el orden ubiquinol-10, ascorbato y bilirrubina. La adición de BR al plasma humano tras el agotamiento de los antioxidantes naturales dio como resultado la inhibición de la peroxidación lipídica y la reducción del consumo de α-tocoferol (Neuzil y Stocker, 1994). Las muestras de suero de pacientes hiperbilirrubinémicos con síndrome de Gilbert eran resistentes a la oxidación y mostraban una mayor capacidad antioxidante total que el suero de sujetos en el rango normal de concentración de BR (Bulmer et al., 2008).
La BR exógena cuando se aplica farmacológicamente a las células cultivadas puede proporcionar una citoprotección dependiente de la dosis contra el estrés oxidativo (Clark et al., 2000a). Por ejemplo, la BR (1-5 μM) protegió a las células musculares lisas vasculares cultivadas contra la citotoxicidad del H2O2 generado por las enzimas (Clark et al., 2000a). El BR aplicado a concentraciones nanomolares protegió a las neuronas primarias contra la citotoxicidad causada por el H2O2 exógeno (Doré et al., 1999).
A pesar de las pruebas que sugieren que el BR extracelular puede actuar como citoprotector, el papel del BR como antioxidante celular sigue sin estar claro. El BR producido in situ se secreta a la circulación, se conjuga en el hígado y se excreta (Roy-Chowdhury, 1996). Sin embargo, se desconoce la fracción de BR que se retiene en las células para cumplir una función antioxidante de membrana. Un argumento común en contra de la función antioxidante celular de la BR es que el medio celular contiene compuestos antioxidantes endógenos eficientes y abundantes, incluyendo cantidades milimolares de glutatión reducido (GSH; Meister y Anderson, 1983), ascorbato, β-caroteno y α-tocoferol (Halliwell y Gutteridge, 1999). Dado que el BR se exporta y se elimina, la contribución relativa del BR a la capacidad antioxidante celular en presencia de otros antioxidantes endógenos sigue sin estar clara.
Las pruebas actuales del papel del BR como antioxidante celular se basan en pruebas que utilizan estudios de siRNA dirigidos al BVR, la enzima responsable de la formación del BR. La supresión de BVR sensibilizó a las células a altas concentraciones de H2O2 (Baranano et al., 2002) y a la apoptosis mediada por arsenito (Miralem et al., 2005). En este último caso, no se consiguieron efectos similares con el knockdown de HO-1, lo que sugiere efectos de la BVR independientes de la generación de BR (Miralem et al., 2005).
Snyder et al. observaron que la BV se forma durante la oxidación de BR (Baranano et al., 2002). Los autores propusieron que el BV formado por la oxidación del BR actuaría como sustrato para el BVR, para regenerar el BR, y así representar un sistema antioxidante que se autoperpetúa, «el ciclo antioxidante del BVR». Las pruebas a favor y en contra de esta vía se han debatido en otros lugares (Maghzal et al., 2009; Sedlak y Snyder, 2009; Stocker y Maghzal, 2009). Sigue sin estar claro si la BV regenerada durante la oxidación de la BR no superaría sino una fracción menor, y si esto contribuiría significativamente a la capacidad antioxidante celular como se ha propuesto.
Toxicidad de la bilirrubina
La acumulación de bilirrubina puede ser perjudicial, especialmente en los bebés con hiperbilirrubinemia neonatal. La toxicidad selectiva de la BR para el neonato se debe al establecimiento incompleto de la barrera hematoencefálica. La hiperbilirrubinemia neonatal no conjugada se asocia a efectos secundarios neurológicos graves, que incluyen encefalopatía neurológica y kernicterus (Vitek y Ostrow, 2009). Para evitar el riesgo de neurotoxicidad, se aplica la fototerapia para reducir los niveles de BR no conjugados en los recién nacidos ictéricos (Blanckaert y Fevery, 1990). Los mecanismos de toxicidad de los BR en el cerebro se han revisado en otros lugares (Brito et al., 2008; Ghersi-Egea et al., 2009; Tell y Gustincich, 2009; Vitek y Ostrow, 2009).
Efectos protectores de los pigmentos biliares en modelos animales de lesión tisular
Excluyendo la toxicidad neonatal, la hiperbilirrubinemia leve, debido a la elevada capacidad antioxidante del suero, puede conferir beneficios al huésped. En un modelo de hiperbilirrubinemia en ratones, las ratas Gunn con ictericia mostraron menores índices de estrés oxidativo en el suero que los ratones de tipo salvaje cuando se les sometió a hiperoxia (Dennery et al., 1995).
La aplicación terapéutica de la RB preservó la función miocárdica durante la lesión por isquemia/reperfusión cardíaca (I/R) (Clark et al., 2000b). En un modelo de corazón perfundido aislado, el precondicionamiento con hemo protegió contra el infarto de miocardio tras una lesión por I/R, lo que se asoció a un aumento de la expresión de HO-1 y de la formación de BR. La administración de BR en concentraciones nanomolares mejoró el rendimiento cardíaco y redujo el tamaño del infarto y la disfunción mitocondrial tras la lesión por I/R (Clark et al., 2000b)
La inyección de BV disminuyó la producción de citoquinas proinflamatorias (es decir, IL-6), aumentó los niveles de IL-10 y redujo la lesión pulmonar inflamatoria en ratas desafiadas con lipopolisacárido (LPS). Así, la BV protegió contra la inflamación sistémica y la lesión pulmonar tras la exposición letal al LPS. Los efectos protectores de la BV contra la lesión inducida por el LPS se observaron en cultivos de células endoteliales pulmonares y macrófagos (Sarady-Andrews et al., 2005). Se han notificado otros efectos antiinflamatorios de la RB en cultivos celulares. Por ejemplo, la BR inhibió la expresión dependiente del TNF-α de las moléculas de adhesión (es decir, E-selectina, VCAM-1, ICAM-1) en las células endoteliales (Mazzone et al., 2009). Recientemente, el aumento de la translocación nuclear de BVR se ha implicado en los efectos antiinflamatorios de BV (Wegiel et al., 2011).
La bilirrubina puede actuar como un inhibidor de la proliferación de células musculares lisas (Nakao et al., 2005; Ollinger et al., 2005). La administración exógena de BV inhibió la hiperplasia neointimal asociada a la lesión vascular en ratas (Nakao et al., 2005; Ollinger et al., 2005). Estos efectos se atribuyeron a la regulación a la baja de JNK y a la inhibición de la apoptosis de las células endoteliales (Nakao et al., 2005). Del mismo modo, los animales hiperbilirrubinémicos eran resistentes a la lesión vascular (Ollinger et al., 2005). Los efectos antiproliferativos de la BV y la BR se demostraron en cultivos de células musculares lisas vasculares. La BV/BR exógena detuvo las células en la fase G1 tras la estimulación con suero, lo que se asoció a la inhibición de la fosforilación de la proteína p38 MAPK y del retinoblastoma (Ollinger et al., 2005).
La hiperbilirrubinemia experimental (3-10 mg/dl) inducida por infusión protegió contra la fibrosis pulmonar inducida por bleomicina en ratas (Wang et al., 2002). Las ratas infundidas con BR mostraron una menor lesión pulmonar en respuesta a la provocación con bleomicina, incluyendo un menor contenido de hidroxiprolina pulmonar, una reducción de los recuentos de linfocitos polimorfonucleares y leucocitos, y una reducción de los niveles del factor de crecimiento transformante-β en el lavado broncoalveolar (Wang et al., 2002). Así pues, los efectos antifibróticos de la RB pueden estar relacionados con los efectos tanto antioxidantes como antiproliferativos de este pigmento.
Estudios recientes también han implicado un efecto protector de la VB/RB en la diabetes. La aplicación de BV a ratas diabéticas inducidas por estreptozotocina redujo los isoprostanos urinarios y protegió contra la descamación de las células endoteliales (Rodella et al., 2006). La RB mejoró la nefropatía diabética, a través de la reducción de la generación de ROS citosólica y los efectos antiinflamatorios (Fujii et al., 2010). Los ratones diabéticos hiperbilirrubinémicos o tratados con BV mostraron una reducción de la albuminuria y de los marcadores urinarios de estrés oxidativo en relación con los controles de tipo salvaje o no tratados, respectivamente. La aplicación de BV o BR inhibió la producción de ROS en las células endoteliales y mesangiales inducida por la exposición a la glucosa alta o a la angiotensina-II (Fujii et al., 2010).
Efectos protectores de los pigmentos biliares en el trasplante de órganos
Se han descrito efectos terapéuticos de los pigmentos biliares aplicados exógenamente en modelos animales de trasplante de órganos y de rechazo agudo del injerto, incluyendo el trasplante de hígado (Fondevila et al., 2004), riñón (Adin et al., 2005) y corazón (Yamashita et al., 2004). En el riñón aislado perfundido, la perfusión con RB protegió contra la lesión tisular inducida por la I/R caliente y preservó la función renal (Adin et al., 2005). La BV proporcionó protección tisular en un modelo ex vivo de lesión por I/R hepática en frío. Además, la inclusión de BV en el perfusato aumentó la supervivencia en ratas sometidas a un trasplante de hígado ortotópico al preservar la función hepática (Fondevila et al., 2004). Esta protección conferida por la BV se asoció con la disminución de la expresión de índices proinflamatorios, incluyendo la afluencia de neutrófilos, la expresión de citoquinas proinflamatorias y la activación de la iNOS (Fondevila et al., 2004). El tratamiento con BV mejoró la supervivencia de los aloinjertos cardíacos de rata, al reducir la infiltración de leucocitos e inhibir la proliferación de células T (Yamashita et al., 2004). En la lesión I/R por frío asociada al trasplante de injertos de corazón y riñón, la aplicación de BV simultáneamente con CO proporcionó una protección tisular sinérgica, mientras que se observaron efectos menores con cualquiera de los dos agentes de prueba por separado (Nakao et al., 2000). La BV también evitó el rechazo de injertos de pulmón de donantes con muerte cerebral, que son más propensos al rechazo (Zhou et al., 2011). En el trasplante alogénico de islotes, el tratamiento del donante o del injerto del donante ex vivo con BR mejoró la supervivencia del injerto de islotes. El tratamiento del receptor con BR también mejoró la supervivencia de los injertos de islotes (Wang et al., 2006b; Zhu et al., 2010). La RB confiere tolerancia al trasplante de injertos de islotes mediante la regulación al alza de las células T reguladoras (Lee et al., 2007). Los efectos antiapoptóticos y antiinflamatorios de la BV/BR observados en los modelos de lesión I/R pueden contribuir a la protección durante la lesión I/R asociada al trasplante. Estos experimentos también sugieren que la RB farmacológica puede tener funciones inmunomoduladoras que contribuyen a los efectos terapéuticos en el entorno del rechazo del injerto (Ollinger et al., 2007).
La bilirrubina en las enfermedades cardiovasculares y pulmonares
Estudios clínicos recientes han informado de asociaciones inversas entre los niveles de RB en suero y los factores de riesgo asociados a la ECV. Estos estudios sugieren colectivamente que las elevaciones naturales de la BR sérica confieren protección contra la ECV, incluyendo la aterosclerosis, la enfermedad arterial coronaria (EAC)/la cardiopatía isquémica (CI), la diabetes y el accidente cerebrovascular (Novotný y Vítek, 2003; Franchini et al, 2010).
En uno de los primeros estudios que informaron de las asociaciones entre la RB y la ECV, un estudio de 619 varones ajustado por factores de riesgo dependientes de la edad, el nivel de RB en suero se describió como un factor de riesgo inverso para la EC (Schwertner et al., 1994). La BR fue débilmente predictiva de la EAC en relación con los marcadores de lipoproteínas (Levinson, 1997). Sin embargo, se informó de una fuerte correlación entre los niveles de BR y los niveles de apolipoproteína B, un factor de riesgo de aterosclerosis (Levinson, 1997). Los niveles de BR en suero representaron un factor de riesgo inverso para la EAC en sujetos con EAC familiar temprana (Hopkins et al., 1996).
En un estudio prospectivo a gran escala (7.685 hombres), los sujetos en el rango medio de concentración de BR en suero mostraron un riesgo reducido de EIC, en relación con los sujetos en el quintil más bajo de la distribución de BR en suero (Breimer et al., 1995). Los individuos en el quintil más bajo de BR mostraron un colesterol de lipoproteínas de alta densidad (HDL) reducido y una función pulmonar reducida. Aunque el BR sérico de nivel medio se asoció con un menor riesgo de ECV, los individuos hiperbilirrubinémicos (quintil más alto) mostraron un riesgo similar de ECD que los individuos del quintil más bajo de BR sérico (Breimer et al., 1995).
Los niveles de BR sérico se han indicado como un factor de riesgo independiente e inverso para la enfermedad vascular periférica (Breimer et al., 1994). En estudios transversales a gran escala, los niveles de BR en suero dentro del rango normal se asociaron inversamente con el riesgo de enfermedad vascular periférica (Perlstein et al., 2008a) y de accidente cerebrovascular (Perlstein et al., 2008b). Un aumento de 1,71 μM en el nivel de BR se asoció con una reducción del 6% en las probabilidades de enfermedad vascular periférica (7.075 participantes; Perlstein et al., 2008a), y con una reducción del 9% en las probabilidades de accidente cerebrovascular (13.214 participantes; Perlstein et al., 2008b).
En 72 sujetos sanos, los niveles de BR en suero se correlacionaron de forma inversa con los indicadores de aterosclerosis (Erdogan et al., 2005). Los niveles bajos de BR en suero se asociaron a un mayor grosor de la íntima-medial de la arteria carótida y a un deterioro de la vasodilatación mediada por el flujo, lo que indica una disfunción endotelial (Erdogan et al., 2005). Además, los niveles de BR se correlacionaron de forma inversa con la formación de placas carotídeas en 1.774 sujetos, con una odds ratio comunicada de 0,37 para un aumento de 17,1 μM de BR (Ishizaka et al., 2001).
En un estudio transversal de 2.307 coreanos, los niveles totales y directos de BR se correlacionaron de forma inversa con los niveles plasmáticos de proteína C reactiva (PCR), un indicador de inflamación vascular (Hwang et al., 2011). Se informó de asociaciones inversas similares entre la BR y los niveles de PCR de alta sensibilidad (hs) (Gullu et al., 2005; Yoshino et al., 2011). La BR se correlacionó de forma inversa con la ECV en pacientes con hipercolesterolemia, y se elevó en pacientes que recibían estatinas (Nolting et al., 2011).
Un estudio prospectivo (Framingham offspring study, 5.124 participantes) concluyó que una mayor concentración de BR sérica total se asoció con un menor riesgo de ECV en los hombres, con una asociación poco clara para las mujeres (Djousse et al., 2001). Este estudio reveló un mayor riesgo de infarto de miocardio, tanto en hombres como en mujeres, asociado a una baja concentración de BR en suero y a una baja concentración de albúmina en suero (Djoussé et al., 2003).
Los niveles de bilirrubina se han examinado como un factor predictivo independiente de la mortalidad por ECV. No se encontró ninguna asociación entre la BR sérica y la mortalidad por todas las causas por ECV en un estudio de 10 años de la población belga, aunque el aumento de la BR se asoció con una reducción de la mortalidad por cáncer en los hombres (Temme et al., 2001). Sin embargo, en un estudio publicado recientemente con 1.279 hombres, los niveles de BR y el nivel de aptitud física cardiopulmonar se correlacionaron de forma independiente y negativa con la mortalidad por todas las causas y por ECV (Ajja et al., 2011).
Estudios adicionales han analizado las posibles asociaciones entre los niveles de BR y las enfermedades relacionadas con la ECV, como la diabetes (Ko et al., 1996; Fukui et al., 2008, 2011; Cheriyath et al., 2010) y el síndrome metabólico (Jo et al., 2011; Kwon et al., 2011). Un gran estudio transversal (15.876 sujetos) informó de una asociación inversa entre la BR total y el riesgo de diabetes (Cheriyath et al., 2010). Los pacientes con diabetes de tipo II en hemodiálisis mostraron un mayor riesgo de ECV asociado a un BR sérico bajo, en relación con los pacientes diabéticos que no estaban en hemodiálisis (Fukui et al., 2011). La BR sérica estaba inversamente correlacionada con la albuminuria en pacientes diabéticos de tipo II (Fukui et al., 2008). En una cohorte china (1.508 sujetos), el BR sérico bajo se asoció con aberraciones en la tolerancia a la glucosa y con aumentos en los factores de riesgo de ECV, incluidos los triglicéridos, las lipoproteínas de muy baja densidad y la hemoglobina glucosilada (Ko et al., 1996).
Estudios adicionales han examinado las asociaciones del BR con la ECV en la hiperbilirrubinemia originada por trastornos metabólicos del metabolismo del BR. Un polimorfismo de repetición TA del promotor del gen UTG1A1 (designado UGT1A1*28, o TA7) da lugar a una reducción de la transcripción de UTG1A y a un déficit en la conjugación y eliminación del BR hepático (Schwertner y Vítek, 2008). Los individuos homocigotos para UGT1A1*28 (TA7/TA7) presentan una hiperbilirrubinemia, denominada síndrome de Gilbert, en relación con los sujetos de tipo salvaje (TA6/TA6) o los heterocigotos. En un estudio de 50 pacientes con síndrome de Gilbert se observó un riesgo seis veces menor de padecer CI y un nivel elevado de colesterol HDL en comparación con la población general (Vítek et al., 2002). En los pacientes de Gilbert, el BR no conjugado se correlacionó negativamente con el colesterol de lipoproteínas de baja densidad pequeño sd-LDL-C, el LDL oxidado y el hs-CRP (Tapan et al., 2011).
En el estudio Framingham Heart los portadores homocigotos del alelo UGT1A1*28 con concentraciones séricas elevadas de BR mostraron una fuerte asociación con un menor riesgo de ECV (Lin et al., 2006). Estas observaciones fueron validadas además por estudios de vinculación condicional y de asociación de todo el genoma. Estos estudios concluyeron que el UTG1A es un gen importante vinculado a la ECV, y que el polimorfismo de repetición TA está fuertemente asociado con un menor riesgo de ECV (Lin et al., 2009). En un estudio sobre la enfermedad arterial periférica, no se observó ninguna asociación de los polimorfismos UGT1A1, a pesar de la correlación inversa del riesgo de ECV con los niveles de BR (Rantner et al., 2008). Estudios post-mortem recientes también informaron de que los polimorfismos UGT1A1 no estaban correlacionados con la gravedad de la EAC (Papez et al., 2009).
Por último, la BR se asoció de forma inversa con el riesgo de enfermedad pulmonar. En un estudio de cohortes (504.206 sujetos), cada aumento de 0,1 mg/dl de BR en los hombres se asoció con una disminución del 9% y del 6% en el riesgo de cáncer de pulmón y de enfermedad pulmonar obstructiva crónica, respectivamente (Horsfall et al., 2011).
Conclusión
La biliverdina y el BR son sustancias naturales derivadas del catabolismo del hemo que poseen propiedades antioxidantes. Además, los BR circulantes pueden contribuir a la capacidad antioxidante del suero. En estudios preclínicos, la aplicación farmacológica de la BR confiere protección contra la lesión I/R, la lesión pulmonar aguda, la fibrosis pulmonar, la lesión renal y el rechazo de injertos. Hay que tener en cuenta varias limitaciones de las aplicaciones terapéuticas de los pigmentos biliares. Aunque la VB es soluble en medios acuosos, la RB es lipofílica y sólo soluble en disolventes orgánicos, lo que plantea problemas para su administración terapéutica.
La bilirrubina es el subproducto de la vía de degradación del hemo y, por tanto, puede mediar las propiedades citoprotectoras de la HO-1 (Foresti et al., 2004). Se están desarrollando enfoques farmacológicos o de terapia génica que implican la expresión dirigida de la HO-1 (Abraham et al., 2007). Sin embargo, estos enfoques no son específicos para la generación de BV/BR, ya que la modulación de HO-1 tiene efectos pleiotrópicos que afectan al metabolismo sistémico del hierro y a la generación de CO. Del mismo modo, la expresión dirigida de la BVR puede afectar a las vías de señalización celular independientemente de su papel en la generación de pigmentos biliares (Kapitulnik y Maines, 2009). Los estudios clínicos han sugerido asociaciones inversas entre la RB sérica y el riesgo de ECV. La hiperbilirrubinemia leve puede reducir el riesgo de ECV, pero esto espera una mayor validación. Hasta la fecha, no existen metodologías prácticas para inducir la hiperbilirrubinemia con fines clínicos. A pesar del beneficio terapéutico en modelos de lesión tisular en animales, el potencial terapéutico de la RB sigue sin probarse en seres humanos.
Declaración de conflicto de intereses
El autor declara que la investigación se ha llevado a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Agradecimientos
El Dr. Ryter desea expresar su agradecimiento a los colegas actuales y anteriores que han contribuido a algunos de los trabajos referenciados aquí descritos. En la actualidad, el Dr. Ryter es profesor en el Brigham and Women’s Hospital (BWH), Boston, y es científico adjunto del Lovelace Respiratory Research Institute (LRRI), Albuquerque, Nuevo México. En calidad de tal, el Dr. Ryter recibió apoyo salarial del consorcio LRRI/BWH para la investigación pulmonar.
Abraham, N. G., Asija, A., Drummond, G., y Peterson, S. (2007). Heme oxygenase-1 gene therapy: recent advances and therapeutic applications. Curr. Gene Ther. 7, 89-108.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Adin, C. A., Croker, B. P., and Agarwal, A. (2005). Efectos protectores de la bilirrubina exógena en la lesión por isquemia-reperfusión en el riñón de rata aislado y perfundido. Am. J. Physiol. Renal Physiol. 288, F778-F784.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ajja, R., Lee, D. C., Sui, X., Church, T. S., and Steven, N. B. (2011). Utilidad de la bilirrubina sérica y la aptitud cardiorrespiratoria como predictores de mortalidad en los hombres. Am. J. Cardiol. 108, 1438-1442.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Baranano, D. E., Rao, M., Ferris, C. D., y Snyder, S. H. (2002). Biliverdin reductase: a major physiologic cytoprotectant. Proc. Natl. Acad. Sci. U.S.A. 99, 16093-16098.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Blanckaert, N., y Fevery, J. (1990). «Fisiología y fisiopatología del metabolismo de la bilirrubina», en Hepatology. A Textbook of Liver Disease, 2nd Edn, Vol. 1, eds D. Zakim and T. D. Boyer (Philadelphia: W. D. Saunders), 254-302.
Breimer, L. H., Spyropolous, K. A., Winder, A. F., Mikhailidis, D. P., and Hamilton, G. (1994). Is bilirubin protective against coronary artery disease. Clin. Chem. 40, 1987-1988.
Pubmed Abstract | Pubmed Full Text
Breimer, L. H., Wannamethee, G., Ebrahim, S., y Shaper, A. G. (1995). Serum bilirubin and risk of ischemic heart disease in middle-aged British men. Clin. Chem. 41, 1504-1508.
Pubmed Abstract | Pubmed Full Text
Brito, M. A., Lima, S., Fernandes, A., Falcão, A. S., Silva, R. F., Butterfield, D. A., and Brites, D. (2008). Bilirubin injury to neurons: contribution of oxidative stress and rescue by glycoursodeoxycholic acid. Neurotoxicology 29, 259-269.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bulmer, A. C., Blanchfield, J. T., Toth, I., Fassett, R. G., and Coombes, J. S. (2008). Improved resistance to serum oxidation in Gilbert’s syndrome: a mechanism for cardiovascular protection. Atherosclerosis 199, 390-396.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cheriyath, P., Gorrepati, V. S., Peters, I., Nookala, V., Murphy, M. E., Srouji, N., and Fischman, D. (2010). High total bilirubin as a protective factor for diabetes mellitus: an analysis of NHANES data from 1999-2006. J. Clin. Med. Res. 2, 201-216.
Pubmed Abstract | Pubmed Full Text
Chowdhury, J. R., y Chowdhury, N. R. (1983). Conjugación y excreción de la bilirrubina. Semin. Liver Dis. 3, 11-23.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chowdhury, J. R., Chowdhury, N. R., Bhargava, M. M., y Arias, I. M. (1979). Purificación y caracterización parcial de la bilirrubina glucuronosida glucuronosiltransferasa de hígado de rata. J. Biol. Chem. 254, 8336-8339.
Pubmed Abstract | Pubmed Full Text
Clark, J. E., Foresti, R., Green, C. J., and Motterlini, R. (2000a). Dynamics of haem oxygenase-1expression and bilirubin production in cellular protection against oxidative stress. Biochem. J. 348, 615-619.
CrossRef Full Text
Clark, J. E., Foresti, R., Sarathchandra, P., Kaur, H., Green, C. J., and Motterlini, R. (2000b). Heme oxygenase-1-derived bilirubin ameliorates postischemic myocardial dysfunction. Am. J. Physiol. 278, H643-H651.
Cui, Y., König, J., Leier, I., Buchholz, U., y Keppler, D. (2001). Hepatic uptake of bilirubin and its conjugates by the human organic anion transporter SLC21A6. J. Biol. Chem. 276, 9626-9630.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pubmed Abstract | Pubmed Full Text
Davies, K. J. (2000). El estrés oxidativo, las defensas antioxidantes y los sistemas de eliminación, reparación y sustitución de daños. IUBMB Life 50, 279-289.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dennery, P. A., McDonagh, A. F., Spitz, D. R., Rodgers, P. A., y Stevenson, D. K. (1995). La hiperbilirrubinemia da lugar a una menor lesión oxidativa en ratas Gunn neonatales expuestas a la hiperoxia. Free Radic. Biol. Med. 19, 395-404.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Djousse, L., Levy, D., Cupples, L. A., Evans, J. C., D’Agostino, R. B., y Ellison, R. C. (2001). Total serum bilirubin and risk of cardiovascular disease in the Framingham Offspring Study. Am. J. Cardiol. 87, 1196-1200.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Djoussé, L., Rothman, K. J., Cupples, L. A., Levy, D., and Ellison, R. C. (2003). Effect of serum albumin and bilirubin on the risk of myocardial infarction (the Framingham Offspring Study). Am. J. Cardiol. 91, 485-488.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Doré, S., Takahashi, M., Ferris, C. D., Zakhary, R., Hester, L. D., Guastella, D., y Snyder, S. H. (1999). La bilirrubina, formada por la activación de la hemo oxigenasa-2, protege a las neuronas contra la lesión por estrés oxidativo. Proc. Natl. Acad. Sci. U.S.A. 96, 2445-2450.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dröge, W. (2002). Los radicales libres en el control fisiológico de la función celular. Physiol. Rev. 82, 47-95.
Pubmed Abstract | Pubmed Full Text
Erdogan, D., Gullu, H., Yildirim, E., Tok, D., Kirabas, I., Ciftci, O., Baycan, S. T., and Muderrisoglu, H. (2005). Low serum bilirubin levels are independently and inversely related to impaired flow-mediated vasodilation and increased carotid intima-media thickness in both men and women. Atherosclerosis 184, 431-437.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fondevila, C., Shen, X. D., Tsuchiyashi, S., Yamashita, K., Csizmadia, E., Lassman, C., Busuttil, R. W., Kupiec-Weglinski, J. W., y Bach, F. H. (2004). Biliverdin therapy protects rat livers from ischemia and reperfusion injury. Hepatology 40, 1333-1341.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Foresti, R., Green, C. J., and Motterlini, R. (2004). Generación de pigmentos biliares por la hemoxigenasa: una estrategia celular refinada en respuesta a insultos estresantes. Biochem. Soc. Symp. 71, 177-192.
Pubmed Abstract | Pubmed Full Text
Forman, H. J., Maiorino, M., and Ursini, F. (2010). Funciones de señalización de las especies reactivas del oxígeno. Biochemistry 49, 835-842.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franchini, M., Targher, G., and Lippi, G. (2010). Niveles de bilirrubina sérica y riesgo de enfermedad cardiovascular: ¿un Janus Bifrons? Adv. Clin. Chem. 50, 47-63.
Pubmed Abstract | Pubmed Full Text | Crossword Full Text
Fujii, M., Inoguchi, T., Sasaki, S., Maeda, Y., Zheng, J., Kobayashi, K., y Takayanagi, R. (2010). Bilirubin and biliverdin protect rodents against diabetic nephropathy by downregulating NAD(P)H oxidase. Kidney Int. 78, 905-919.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fukui, M., Tanaka, M., Shiraishi, E., Harusato, I., Hosoda, H., Asano, M., Hasegawa, G., y Nakamura, N. (2008). Relationship between serum bilirubin and albuminuria in patients with type 2 diabetes. Kidney Int. 74, 1197-1201.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fukui, M., Tanaka, M., Yamazaki, M., Hasegawa, G., Nishimura, M., Iwamoto, N., Ono, T., Imai, S., and Nakamura, N. (2011). Baja concentración de bilirrubina sérica en pacientes en hemodiálisis con diabetes tipo 2. Diabet. Med. 28, 96-99.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
García-Lafuente, A., Guillamón, E., Villares, A., Rostagno, M. A., and Martínez, J. A. (2009). Los flavonoides como agentes antiinflamatorios: implicaciones en cáncer y enfermedades cardiovasculares. Inflamm. Res. 58, 537-552.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ghersi-Egea, J. F., Gazzin, S., and Strazielle, N. (2009). Blood-brain interfaces and bilirubin-induced neurological diseases. Curr. Pharm. Des. 15, 2893-2907.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gullu, H., Erdogan, D., Tok, D., Topcu, S., Caliskan, M., Ulus, T., and Muderrisoglu, H. (2005). High serum bilirubin concentrations preserve coronary flow reserve and coronary microvascular functions. Arterioscler. Thromb. Vasc. Biol. 25, 2289-2294.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Halliwell, B., y Gutteridge, J. M. C. (1999). Free Radicals in Biology and Medicine. New York, NY: Oxford University Press.
Hopkins, P. N., Wu, L. L., Hunt, S. C., James, B. C., Vincent, G. M., y Williams, R. R. (1996). Higher serum bilirubin is associated with decreased risk for early familial coronary artery disease. Arterioscler. Thromb. Vasc. Biol. 16, 250-255.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Horsfall, L. J., Rait, G., Walters, K., Swallow, D. M., Pereira, S. P., Nazareth, I., and Petersen, I. (2011). La bilirrubina sérica y el riesgo de enfermedad respiratoria y muerte. JAMA 305, 691-697.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hwang, H. J., Lee, S. W., y Kim, S. H. (2011). Relación entre la bilirrubina y la proteína C reactiva. Clin. Chem. Lab. Med. 49, 1823-1828.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ishizaka, N., Ishizaka, Y., Takahashi, E., Yamakado, M., and Hashimoto, H. (2001). High serum bilirubin level is inversely associated with the presence of carotid plaque. Stroke 32, 580-583.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jo, J., Yun, J. E., Lee, H., Kimm, H., and Jee, S. H. (2011). Concentraciones de bilirrubina sérica total, directa e indirecta y síndrome metabólico entre la población coreana. Endocrine 39, 182-189.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kaliora, A. C., Dedoussis, G. V., y Schmidt, H. (2006). Dietary antioxidants in preventing atherogenesis. Atherosclerosis 187, 1-17.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kamisako, T., Kobayasi, Y., Takeuchi, K., Ishihara, T., Higuchi, K., Tanaka, Y., Gabazza, E. C., and Adachi, Y. (2000). Recent advances in bilirubin metabolism research: the molecular mechanism of hepatocyte bilirubin transport and its clinical relevance. J. Gastroenterol. 35, 659-664.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kapitulnik, J., and Maines, M. D. (2009). Funciones pleiotrópicas de la biliverdina reductasa: señalización celular y generación de bilirrubina citoprotectora y citotóxica. Trends Pharmacol. Sci. 30, 129-137.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kaur, H., Hughes, M. N., Green, C. J., Naughton, P., Foresti, R., and Motterlini, R. (2003). Interacción de la bilirrubina y la biliverdina con especies reactivas de nitrógeno. FEBS Lett. 543, 113-119.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ko, G. T., Chan, J. C., Woo, J., Lau, E., Yeung, V. T., Chow, C. C., Li, J. K., So, W. Y., y Cockram, C. S. (1996). Serum bilirubin and cardiovascular risk factors in a Chinese population. J. Cardiovasc. Risk 3, 459-463.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kwon, K. M., Kam, J. H., Kim, M. Y., Kim, M. Y., Chung, C. H., Kim, J. K., Linton, J. A., Eom, A., Koh, S. B., y Kang, H. T. (2011). Asociación inversa entre la bilirrubina total y el síndrome metabólico en mujeres rurales coreanas. J. Womens Health (Larchmt) 20, 963-969.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lee, S. S., Gao, W., Mazzola, S., Thomas, M. N., Csizmadia, E., Otterbein, L. E., Bach, F. H., and Wang, H. (2007). La hemo-oxigenasa-1, el monóxido de carbono y la bilirrubina inducen tolerancia en los receptores hacia los aloinjertos de islotes mediante la modulación de las células reguladoras T. FASEB J. 21, 3450-3457.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levinson, S. S. (1997). Relación entre la bilirrubina, la apolipoproteína B y la enfermedad arterial coronaria. Ann. Clin. Lab. Sci. 27, 185-192.
Pubmed Abstract | Pubmed Full Text
Lin, J. P., O’Donnell, C. J., Schwaiger, J. P., Cupples, L. A., Lingenhel, A., Hunt, S. C., Yang, S., y Kronenberg, F. (2006). Association between the UGT1A1*28 allele, bilirubin levels, and coronary heart disease in the Framingham Heart Study. Circulation 114, 1476-1481.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lin, J. P., Schwaiger, J. P., Cupples, L. A., O’Donnell, C. J., Zheng, G., Schoenborn, V., Hunt, S. C., Joo, J., and Kronenberg, F. (2009). Conditional linkage and genome-wide association studies identify UGT1A1 as a major gene for anti-atherogenic serum bilirubin levels-the Framingham Heart Study. Atherosclerosis 206, 228-233.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Litwack, G., Ketterer, B., y Arias, I. M. (1971). Ligandina: una proteína hepática que une esteroides, bilirrubina, carcinógenos y una serie de aniones orgánicos exógenos. Nature 234, 466-467.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maghzal, G. J., Leck, M. C., Collinson, E., Li, C., and Stocker, R. (2009). Limited role for the bilirubin-biliverdin redox amplification cycle in the cellular antioxidant protection by biliverdin reductase. J. Biol. Chem. 284, 29251-29259.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maines, M. D. (1997). El sistema hemo oxigenasa: un regulador de los gases de segundo mensajero. Annu. Rev. Pharmacol. Toxicol. 37, 517-554.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mancuso, C., Bonsignore, A., Di Stasio, E., Mordente, A., and Motterlini, R. (2003). Bilirubin and S-nitrosothiols interaction: evidence for a possible role of bilirubin as a scavenger of nitric oxide. Biochem. Pharmacol. 66, 2355-2363.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mazzone, G. L., Rigato, I., Ostrow, J. D., Bossi, F., Bortoluzzi, A., Sukowati, C. H., Tedesco, F., and Tiribelli, C. (2009). Bilirubin inhibits the TNFalpha-related induction of three endothelial adhesion molecules. Biochem. Biophys. Res. Commun. 386, 338-344.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Meister, A., y Anderson, M. E. (1983). Glutathione. Annu. Rev. Biochem. 52, 711-760.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Miralem, T., Hu, Z., Torno, M. D., Lelli, K. M., and Maines, M. D. (2005). El silenciamiento del gen de la biliverdina reductasa humana mediado por un ARN de interferencia pequeño, pero no el de la hemo oxigenasa-1, atenúa la inducción de la oxigenasa mediada por arsenito y aumenta la apoptosis en células renales 293A. J. Biol. Chem. 280, 17084-17092.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nakao, A., Murase, N., Ho, C., Toyokawa, H., Billiar, T. R., y Kanno, S. (2005). La administración de biliverdina previene la formación de hiperplasia intimal inducida por una lesión vascular. Circulation 112, 587-591.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nakao, A., Neto, J. S., Kanno, S., Stolz, D. B., Kimizuka, K., Liu, F., Bach, F. H., Billiar, T. R., Choi, A. M., Otterbein, L. E., y Murase, N. (2000). Protection against ischemia/reperfusion injury in cardiac and renal transplantation with carbon monoxide, biliverdin and both. Am. J. Transplant. 5, 282-291.
CrossRef Full Text
Neuzil, J., y Stocker, R. (1993). La bilirrubina atenúa el daño mediado por los radicales en la albúmina sérica. FEBS Lett. 331, 281-284.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pubmed Abstract | Pubmed Full Text
Noguchi, M., Yoshida, T., y Kikuchi, G. (1979). Specific requirement of NADPH-cytochrome c reductase for the microsomal heme oxygenase reaction yielding biliverdin IX alpha. FEBS Lett. 98, 281-284.
Resumen de Pubmed | Texto completo de Pubmed | Texto completo de CrossRef
Nolting, P. R., Kusters, D. M., Hutten, B. A., Kastelein, J. J., y el grupo de estudio ExPRESS. (2011). Niveles de bilirrubina sérica en la hipercolesterolemia familiar: ¿un nuevo marcador de riesgo de enfermedad cardiovascular? J. Lipid Res. 52, 1755-1759.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Novotný, L., y Vítek, L. (2003). Relación inversa entre la bilirrubina sérica y la aterosclerosis en los hombres: un meta-análisis de los estudios publicados. Exp. Biol. Med. (Maywood) 228, 568-571.
Pubmed Abstract | Pubmed Full Text
Ollinger, R., Bilban, M., Erat, A., Froio, A., McDaid, J., Tyagi, S., Csizmadia, E., Graca-Souza, A. V., Liloia, A., Soares, M. P., Otterbein, L. E., Usheva, A., Yamashita, K., y Bach, F. H. (2005). Bilirubin: a natural inhibitor of vascular smooth muscle cell proliferation. Circulation 112, 1030-1039.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ollinger, R., Wang, H., Yamashita, K., Wegiel, B., Thomas, M., Margreiter, R., and Bach, F. H. (2007). Aplicaciones terapéuticas de la bilirrubina y la biliverdina en los trasplantes. Antioxid. Redox Signal. 9, 2175-2185.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Papez, M. J., Civalier, C. J., Thorne, L. B., and Gulley, M. L. (2009). El genotipo del promotor de UGT1A1 no está fuertemente asociado con la gravedad de la enfermedad arterial coronaria. Diagn. Mol. Pathol. 18, 226-231.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pedersen, A. O., Shonheyder, F., and Broderson, R. (1977). Photooxidation of human serum albumin and its complex with bilirubin. Eur. J. Biochem. 72, 213-221.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Perlstein, T. S., Pande, R. L., Beckman, J. A., and Creager, M. A. (2008a). Nivel de bilirrubina total en suero y enfermedad arterial periférica prevalente en las extremidades inferiores: National Health and Nutrition Examination Survey (NHANES) 1999 to 2004. Arterioscler. Thromb. Vasc. Biol. 28, 166-172.
CrossRef Full Text
Perlstein, T. S., Pande, R. L., Creager, M. A., Weuve, J., y Beckman, J. A. (2008b). Nivel de bilirrubina total en suero, accidente cerebrovascular prevalente y resultados del accidente cerebrovascular: NHANES 1999-2004. Am. J. Med. 121, 781-788.
CrossRef Full Text
Rantner, B., Kollerits, B., Anderwald-Stadler, M., Klein-Weigel, P., Gruber, I., Gehringer, A., Haak, M., Schnapka-Köpf, M., Fraedrich, G., y Kronenberg, F. (2008). Association between the UGT1A1 TA-repeat polymorphism and bilirubin concentration in patients with intermittent claudication: results from the CAVASIC study. Clin. Chem. 54, 851-857.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Rodella, L., Lamon, B. D., Rezzani, R., Sangras, B., Goodman, A. I., Falck, J. R., y Abraham, N. G. (2006). Carbon monoxide and biliverdin prevent endothelial cell sloughing in rats with type I diabetes. Free Radic. Biol. Med. 40, 2198-2205.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roy-Chowdhury, J. (1996). «El metabolismo de la bilirrubina y sus trastornos», en Hepatology. A Textbook of Liver Disease, 3rd Edn, Vol. 1, eds D. Zakim and T. D. Boyer (Philadelphia: W. D. Saunders), 323-361.
Roy-Chowdhury, N., Lu, Y., and Roy-Chowdhury, J. (2008) «Bilirbuin metabolism,» in Textbook of Hepatology: From Basic Science to Clinical Practice, 3rd Edn, eds J. Rodés, J. P. Benhamou, A. T. Blei, J. Reichen, and M. Rizzetto (Hoboken, NJ: Wiley), 165-174.
Ryter, S. W., Morse, D., and Choi, A. M. (2007). Monóxido de carbono y bilirrubina: terapias potenciales para la lesión y la enfermedad pulmonar/vascular. Am. J. Respir. Cell Mol. Biol. 36, 175-182.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sarady-Andrews, J. K., Liu, F., Gallo, D., Nakao, A., Overhaus, M., Ollinger, R., Choi, A. M., y Otterbein, L. E. (2005). La administración de biliverdina protege contra la lesión pulmonar aguda inducida por endotoxina en ratas. Am. J. Physiol. Lung Cell Mol. Physiol. 289, L1131-L1137.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schwertner, H. A., Jackson, W. G., and Tolan, G. (1994). Asociación de una baja concentración sérica de bilirrubina con un mayor riesgo de enfermedad arterial coronaria. Clin. Chem. 40, 18-23.
Pubmed Abstract | Pubmed Full Text
Schwertner, H. A., and Vítek, L. (2008). Síndrome de Gilbert, alelo UGT1A1*28 y riesgo de enfermedad cardiovascular: posibles efectos protectores y aplicaciones terapéuticas de la bilirrubina. Atherosclerosis 198, 1-11.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sedlak, T. W., and Snyder, S. H. (2009). Ciclando los vagones para la biliverdina reductasa. J. Biol. Chem. 284, le11.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stevens, B., and Small, R. D. (1976). La fotoperoxidación de moléculas orgánicas insaturadas-XV. O2 1Δg quenching by bilirubin and biliverdin. Photochem. Photobiol. 23, 33-36.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stocker, R., and Ames, B. (1987). Potential role of conjugated bilirubin and copper in the metabolism of lipid peroxides in the bile. Proc. Natl. Acad. Sci. U.S.A. 84, 8130-8134.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stocker, R., y Maghzal, G. J. (2009). Respuesta a Sedlak y Snyder: el pequeño cimarrón del ciclo de amplificación de la biliverdina reductasa. J. Biol. Chem. 284, le12.
CrossRef Full Text
Stocker, R., y Peterhans, E. (1989a). Interacción sinérgica entre la vitamina E y los pigmentos biliares bilirrubina y biliverdina. Biochim. Biophys. Acta 1002, 238-244.
Stocker, R., and Peterhans, E. (1989b). Antioxidant properties of conjugated bilirubin and biliverdin: relevant scavenging of hypochlorous acid. Free Radic. Res. Commun. 6, 57-66.
CrossRef Full Text
Stocker, R., Yamamoto, Y., McDonagh, A., Glazer, A., y Ames, B. N. (1987a). La bilirrubina es un antioxidante de posible importancia fisiológica. Science 235, 1043-1045.
CrossRef Full Text
Stocker, R., Glazer, A. N., y Ames, B. N. (1987b). Antioxidant activity of albumin-bound bilirubin. Proc. Natl. Acad. Sci. U.S.A. 84, 5918-5922.
CrossRef Full Text
Sugamura, K., y Keaney, J. F. Jr. (2011). Especies reactivas de oxígeno en las enfermedades cardiovasculares. Free Radic. Biol. Med. 51, 978-992.
Abstracto de Pubmed | Texto completo de Pubmed | Texto completo de Crack
Tapan, S., Karadurmus, N., Dogru, T., Ercin, C. N., Tasci, I., Bilgi, C., Kurt, I., y Erbil, M. K. (2011). Disminución de los niveles de LDL pequeñas y densas en el síndrome de Gilbert. Clin. Biochem. 44, 300-303.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tell, G., and Gustincich, S. (2009). Estado redox, estrés oxidativo y mecanismos moleculares de los efectos protectores y tóxicos de la bilirrubina en las células. Curr. Pharm. Des. 15, 2908-2914.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Temme, E. H. M., Zhang, J. J., Schouten, E. G., and Kesteloot, H. (2001). Serum bilirubin and 10-year mortality risk in a Belgian population. Cancer Causes Control 12, 887-894.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tenhunen, R., Marver, H. S., y Schmid, R. (1969). Microsomal heme oxygenase. Caracterización de la enzima. J. Biol. Chem. 244, 6388-6394.
Pubmed Abstract | Pubmed Full Text
Tenhunen, R., Ross, M. E., Marver, H. S., and Schmid, R. (1970). Reduced nicotinamide-adenine dinucleotide phosphate dependent biliverdin reductase: partial purification and characterization. Biochemistry 9, 298-303.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Valko, M., Rhodes, C. J., Moncol, J., Izakovic, M., and Mazur, M. (2006). Free radicals, metals and antioxidants in oxidative stress-induced cancer. Chem. Biol. Interact. 160, 1-40.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vítek, L., Jirsa, M., Brodanová, M., Kaláb, M., Mareček, Z., Danzig, V., Novotný, L., y Kotal, P. (2002). Gilbert syndrome and ischemic heart disease: a protective effect of elevated bilirubin levels. Atherosclerosis 160, 449-456.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vitek, L., y Ostrow, J. D. (2009). Química y metabolismo de la bilirrubina; aspectos perjudiciales y protectores. Curr. Pharm. Des. 15, 2869-2883.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, H. D., Yamaya, M., Okinaga, S., Jia, Y. X., Kamanaka, M., Takahashi, H., Guo, L. Y., Ohrui, T., y Sasaki, H. (2002). Bilirubin ameliorates bleomycin-induced pulmonary fibrosis in rats. Am. J. Respir. Crit. Care Med. 165, 406-411.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, X., Chowdhury, J. R., y Chowdhury, N. R. (2006a). Metabolismo de la bilirrubina: fisiología aplicada. Curr. Pediatr. 16, 70-74.
CrossRef Full Text
Wang, H., Lee, S. S., Dell’Agnello, C., Tchipashvili, V., d’Avila, J. C., Czismadia, E., Chin, B. Y., y Bach, F. H. (2006b). Bilirubin can induce tolerance to islet allografts. Endocrinology 147, 762-768.
CrossRef Full Text
Wegiel, B., Gallo, D., Csizmadia, E., Roger, T., Kaczmarek, E., Harris, C., Zuckerbraun, B. S., y Otterbein, L. E. (2011). La biliverdina inhibe la expresión del receptor tipo Toll-4 (TLR4) a través de la translocación nuclear dependiente del óxido nítrico de la biliverdina reductasa. Proc. Natl. Acad. Sci. U.S.A. 108, 18849-18854.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Yamashita, K., McDaid, J., Ollinger, R., Tsui, T. Y., Berberat, P. O., Usheva, A., Csizmadia, E., Smith, R. N., Soares, M. P., y Bach, F. H. (2004). Biliverdin, a natural product of heme catabolism, induces tolerance to cardiac allografts. FASEB J. 18, 765-767.
Pubmed Abstract | Pubmed Full Text
Yoshida, T., y Kikuchi, G. (1974). Secuencia de la reacción del catabolismo del hemo catalizada por el sistema de la hemo oxigenasa microsomal. FEBS Lett. 48, 256-261.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Yoshida, T., Noguchi, M., and Kikuchi, G. (1980). Forma oxigenada del complejo hemo oxigenasa y requerimiento de un segundo electrón para iniciar la degradación del hemo desde el complejo oxigenado. J. Biol. Chem. 255, 4418-4420.
Pubmed Abstract | Pubmed Full Text
Yoshino, S., Hamasaki, S., Ishida, S., Kataoka, T., Yoshikawa, A., Oketani, N., Saihara, K., Okui, H., Shinsato, T., Ichiki, H., Kubozono, T., Kuwahata, S., Fujita, S., Kanda, D., Nakazaki, M., Miyata, M., y Tei, C. (2011). Relación entre la concentración de bilirrubina, la función endotelial coronaria y el estrés inflamatorio en pacientes con sobrepeso. J. Atheroscler. Thromb. 18, 403-412.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhou, H., Qian, H., Liu, J., Zhu, D., Ding, W., Pan, P., Jin, D., Wang, J., y Li, W. (2011). Protección contra la lesión del injerto pulmonar de donantes con muerte cerebral con monóxido de carbono, biliverdina, o ambos. J. Heart Lung Transplant. 30, 460-466.
Abstracto Pubmed | Texto completo Pubmed | Texto completo de la revista
Zhu, H., Wang, J., Jiang, H., Ma, Y., Pan, S., Reddy, S., y Sun, X. (2010). Bilirubin protects graftsagainst non-specific inflammation-induced injury in syngeneic intraportal islet transplantation. Exp. Mol. Med. 42, 739-748.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text