Introducción
La creciente resistencia a los insecticidas y los impactos en la salud humana y ambiental han fomentado el uso de hongos entomopatógenos (FEA) para el control biológico (Inglis et al., 2001). Los entornos tropicales albergan una impresionante biodiversidad microbiana (Thompson et al., 2017), incluidos muchos parásitos de artrópodos (Mahe et al., 2017). Sin embargo, los EPF más comunes comercialmente en los agroecosistemas tropicales y subtropicales pertenecen, con mucho, a dos géneros: Beauveria y Metarhizium (Ascomycota: Hypocreales) (Faria y Wraight, 2007; Li et al., 2010; Kumar et al., 2018; Mascarin et al., 2019). Aquí, revisamos la literatura centrada en el control de plagas de artrópodos con entomopatógenos, con especial énfasis en estos dos géneros.
Metarhizium y Beauveria tienen distribuciones pan-globales que revelan una importante diversificación genética, con un amplio rango de insectos hospederos y vastos nichos ecológicos (Driver et al., 2000; Rehner y Buckley, 2005; Zimmermann, 2007). Por lo tanto, muchos aspectos del uso de estos EPF para controlar las plagas abarcan los gradientes latitudinales, y los discutimos en general. Sin embargo, las condiciones ambientales y la composición de las especies pueden diferir enormemente entre las regiones tropicales y las templadas, por lo que discutimos estos factores con referencia específica a los estudios tropicales y utilizamos la teoría general resultante de los sistemas modelo para llenar las lagunas de la literatura actual y estimular nuevos estudios.
Los EPF se formulan generalmente como biopesticidas y se aplican en respuesta a los brotes. Sin embargo, si el hábitat se adapta bien a la cepa fúngica particular al medio ambiente puede ser posible que las aplicaciones fúngicas sirvan como liberaciones inoculativas, donde los EPF permanecen en el suelo y previenen los brotes de insectos. Aquí describimos las preferencias de nicho de los hongos entomopatógenos para ayudar a informar sobre el uso de EPF para prevenir brotes de plagas. Nos centramos en dos especies Beauveria bassiana y Metarhizium anisopliae, pero lo más probable es que cada una de ellas represente una gama más amplia de especies y cepas que anteriormente se agrupaban. Por lo tanto, la mayoría de los artículos citados sobre estas especies de hongos se refieren a Beauveria bassiana y Metarhizium anisopliae sensu lato, debido a las recientes revisiones taxonómicas (por ejemplo, Driver et al., 2000; Bidochka et al., 2001; Inglis et al, 2019).
Beauveria y Metarhizium
Las especies de hongos entomopatógenos, B. bassiana y M. anisopliae controlan una amplia gama de plagas (Kassa et al., 2004; Castrillo et al., 2010; Migiro et al., 2010; Singha et al., 2010; Skinner et al., 2012; Akmal et al., 2013; Wraight et al., 2016). Estos hongos también pueden habitar en la superficie de las hojas de diversas especies de plantas y entornos (Meyling y Eilenberg, 2006a; Garrido-Jurado et al., 2015), habitar en el suelo como saprófitos (Evans, 1982) o crecer de forma endofítica (Greenfield et al., 2016). La aparentemente amplia distribución y diversidad de hospedadores de patógenos atacados por estos hongos, y la persistencia en el medio ambiente cuando los hospedadores son escasos, sugieren un valor potencial en los programas de gestión integrada de plagas a través de diversos lugares y condiciones (Lacey et al., 2015).
La persistencia y eficacia de los propágulos de hongos en las plantas está directamente influenciada por la temperatura, la humedad, la luz solar y la actividad microbiana en el filoplano (Jaronski, 2010). Gran parte de nuestros conocimientos provienen de estudios in vitro (Fargues et al., 1997; Luz y Fargues, 1997; Fargues y Luz, 2000; Devi et al., 2005; Shin et al., 2017). Sin embargo, no está claro si los datos in vitro se pueden extrapolar a las condiciones de campo (Keyser et al., 2017), debido a la influencia del entorno en procesos como el potencial de infección, la persistencia de los conidios y las complejas interacciones abióticas y bióticas que rara vez se duplican en los entornos de laboratorio (Inglis et al., 2001; Lacey et al., 2015).
Metarhizium y Beauveria colonizan fácilmente las rizosferas de las plantas, formando asociaciones endofíticas (Vega et al., 2009; Behie et al., 2015). Las especies de Beauveria se asocian con varias especies de plantas tropicales o subtropicales, como el cacao (Posada y Vega, 2005), el plátano (Akello et al., 2008) y el café (Vega, 2008). Tras la colonización endofítica, Metarhizium robertsii puede incluso transferir a las plantas el nitrógeno derivado de los insectos (Behie et al., 2012). Las afiliaciones de Beauveria y Metarhizium como huéspedes de plantas en la agricultura y los servicios ecosistémicos (es decir, la simbiosis beneficiosa en las plantas y el control de las poblaciones de plagas de insectos) los convierten en candidatos prometedores para su aplicación como biopesticidas en la agricultura tropical. El uso de EPF como bioplaguicidas en una variedad de agroecosistemas ofrece oportunidades interesantes y sostenibles de gestión agrícola, pero el conocimiento profundo de las especies de hongos endémicos es crucial para identificar los escenarios y entornos en los que el patógeno de insectos será más eficaz (Meyling y Eilenberg, 2007; Meyling et al, 2009; Pérez-González et al., 2014).
La vida en el suelo
El suelo puede actuar como reservorio de los inóculos fúngicos (Castrillo et al., 2010), dispersándose por encima del suelo mediante el viento, la lluvia y la actividad de los insectos, o a través de la infección de los insectos que viven en el suelo y el crecimiento radial de las hifas (Meyling y Eilenberg, 2007). La eficacia y la persistencia de los hongos hipocreales están influidas por el tipo de suelo, los niveles de humedad y las interacciones microbianas (Inglis et al., 2001). Aunque los suelos tropicales pueden contener una materia orgánica y una diversidad microbiana muy elevadas, los niveles agrícolas de cada una de ellas dependen principalmente de las prácticas de gestión de las explotaciones (Moeskops et al., 2010; Bai et al., 2018), y la textura varía mucho entre los suelos tropicales, sin que se distinga claramente de los sistemas templados (Pulla et al., 2016). Por lo tanto, es probable que los estudios de zonas templadas que describen los efectos de las características físicas del suelo sobre la persistencia y la eficacia de los EPF sean directamente aplicables a los sistemas tropicales.
Los suelos con alto contenido de materia orgánica suelen estar repletos de microbios, lo que permite potencialmente las interacciones antagónicas entre los microbios (Inglis et al., 1998; Pal y Gardener, 2006). En estudios realizados en zonas templadas, los efectos antagónicos de una mayor actividad microbiana en el suelo contribuyeron a la inhibición de B. bassiana (Studdert y Kaya, 1990; Kessler et al., 2003; Quesada-Moraga et al., 2007), B. brongniartii (Kessler et al., 2004) y M. anisopliae (Jabbour y Barbercheck, 2009). Por ejemplo, el alto contenido de humedad del suelo promovió la aparición de organismos antagonistas, lo que sugiere que la humedad del suelo podría reducir directa o indirectamente la supervivencia de las conidias (Lingg y Donaldson, 1981; Jabbour y Barbercheck, 2009). Sin embargo, esto ha sido refutado por otros estudios en regiones templadas que encontraron poca o ninguna relación entre la humedad del suelo y la ocurrencia de EPF, potencialmente debido a la variación limitada en los niveles de humedad del suelo muestreados o la deficiencia de oxígeno (Griffin, 1963; Ali-Shtayeh et al., 2003; Kessler et al., 2003).
Los niveles de oxígeno del suelo durante la infección pueden promover el crecimiento del micelio, la tolerancia térmica, la germinación y la virulencia contra los insectos (Garza-López et al., 2012; Miranda-Hernández et al., 2014; García-Ortiz et al., 2015; García-Ortiz et al., 2018; Oliveira y Rangel, 2018). Los estudios in vitro revelan una correlación positiva entre las concentraciones enriquecidas de oxígeno (26 y 30% de O2) y la calidad conidial cuando se comparan con los niveles normales de oxígeno atmosférico (21% de O2) (Miranda-Hernández et al., 2014; García-Ortiz et al., 2015; García-Ortiz et al., 2018). Del mismo modo, a niveles deprivados de oxígeno, se aplica el mismo contraste en el crecimiento de conidias y virulencia, reduciéndose bajo concentraciones de oxígeno ambiental (Garza-López et al., 2012; Oliveira y Rangel, 2018). La germinación en condiciones de hipoxia es menor que en niveles atmosféricos normales (Garza-López et al., 2012), aumentando a medida que se enriquecen las condiciones de oxígeno (Miranda-Hernández et al., 2014). Así, airear el suelo durante el crecimiento del micelio puede facilitar el desarrollo óptimo de los hongos entomopatógenos y el control de la plaga.
La textura del suelo influye en la transmisión y retención de los propágulos fúngicos. El aumento del contenido de arcilla puede promover la persistencia de los hongos entomopatógenos, probablemente debido al menor tamaño de los poros y/o a la adsorción de los conidios a la arcilla y a las partículas orgánicas (Ignoffo et al., 1977; Storey y Gardner, 1988; Quesada-Moraga et al., 2007). Sin embargo, un alto contenido de arcilla también puede inhibir la capacidad de un huésped potencial para encontrarse con otro, debido a la reducción de la porosidad para la penetración de los conidios a las capas más profundas del suelo y la transmisión potencial (Vänninen et al., 2000; Fuxa y Richter, 2004). Por lo tanto, la filtración mecánica de la estructura del suelo puede ser un determinante importante de la persistencia y eficacia de los hongos entomopatógenos cuando se aplican al suelo (Storey y Gardner, 1988). Por ejemplo, la eficacia de B. bassiana contra las hormigas rojas del fuego Solenopsis invicta mejoró cuando se aplicó a suelos más húmedos, promoviendo la transmisión de conidias y las tasas de infección (Fuxa y Richter, 2004).
Preferencia de nicho
La hipótesis de selección de hábitat
Las interacciones bióticas pueden alterar la persistencia de los EPF tropicales (Jaronski, 2010), particularmente La hipótesis de selección de hábitat para las especies de Metarhizium sugiere que esta es una diferencia clave entre las regiones templadas y tropicales (Bidochka et al., 2002). Bidochka y Small (2005) sugirieron que los genotipos de Metarhizium se asocian con tipos de hábitat en las regiones templadas y polares y que es más probable que se asocien con ciertos insectos huéspedes en las regiones (sub)tropicales. Los autores también sugirieron que M. anisopliae se originó en el sudeste asiático, pero que ahora comprende un conjunto de especies crípticas, muchas de las cuales atraviesan grandes barreras geográficas. Los estudios sobre Beauveria y Metarhizium en zonas templadas han puesto de manifiesto su preferencia por la selección de hábitat en lugar de las asociaciones con insectos hospedadores (Meyling y Eilenberg, 2006b; Meyling et al., 2009; Ormond et al., 2010). Cualquier asociación con insectos huéspedes de M. anisopliae en latitudes más altas se atribuyó al hábitat del insecto, lo que sugiere que los factores abióticos podrían estar impulsando la estructura genética de la población (Bidochka et al., 2001).
Takatsuka (2007) caracterizó aislados de Beauveria de Japón usando ISSR-PCR y no encontró evidencia de coevolución a largo plazo entre el hongo y los insectos hospederos, apoyando la hipótesis de Bidochka et al. (2002) de que la variación en la persistencia del estado saprofito de vida libre de un patógeno facultativo de insectos impulsa la estructura genética de la población. Por el contrario, Bridge et al. (1997) sugirieron la coevolución entre los aislados tropicales de M. flavoviride var. minus de un único genotipo y los insectos pertenecientes a la superfamilia Acridoidea. Los aislados tropicales de M. flavoviride var. minus con rasgos de preferencia por el hospedador difieren de los que tienen una derivación europea. Curiosamente, la mayoría de los aislados en las publicaciones que apoyan la hipótesis de Bidochka y Small (2005) sobre la asociación de Metarhizium spp. con especies de insectos hospedadores tienen un origen tropical (Rombach et al., 1986; St. Leger et al., 1992; Bridge et al., 1993, 1997; Leal et al., 1994; Tigano-Milani et al., 1995). Sin embargo, se necesitan futuros análisis para definir estas relaciones.
Las cepas de Metarhizium se han adaptado a entornos particulares, apoyando estrategias versátiles de historia de vida (Lovett y St. Leger, 2015). Los ajustes en las respuestas al estrés ambiental pueden surgir de la adaptación a factores ambientales abióticos (por ejemplo, la temperatura, la radiación UV y la humedad) y bióticos relacionados con la infección de un huésped (por ejemplo, antimicrobianos y factores de estrés de comportamiento) (Lovett y St. Leger, 2015; Ortiz-Urquiza y Keyhani, 2015). Los conidios producidos bajo estrés abiótico y biótico pueden soportar un rango ambiental más amplio y mejorar la virulencia contra los insectos (Li et al., 2015; Rangel et al., 2015). Por ejemplo, la superación de las fiebres de comportamiento del huésped durante la infección puede producir aislados de hongos entomopatógenos más termotolerantes (Fargues et al., 1997; Blanford y Thomas, 2000; Rangel et al., 2005). Los rasgos defensivos del comportamiento de los saltamontes pueden dar lugar a discrepancias entre las especies de hongos entomopatógenos y su eficacia en el control de las poblaciones de la plaga a diferentes temperaturas (Inglis et al., 1999). Las ninfas de saltamontes infectadas con B. bassiana y M. acridum experimentaron niveles reducidos de mortalidad cuando se aumentó la temperatura, y M. acridum superó sustancialmente a B. bassiana en la mortalidad de ninfas a temperaturas más altas (Inglis et al., 1999).
A partir de las pruebas presentadas principalmente para Metarhizium, proponemos dos hipótesis generales para el EPF: (i) Los factores abióticos son los principales determinantes de la estructura genética de la población en latitudes más altas, debido a la necesidad del insecto patógeno de adaptarse a la estacionalidad y a las condiciones ambientales extremas. (ii) Por el contrario, los factores bióticos (interacciones con otras especies y vías de infección asociadas al hongo-hospedador) son los principales reguladores de la estructura genética de la población de EPF en latitudes más bajas. A continuación evaluamos estas hipótesis a la luz de investigaciones recientes. Para presentar visualmente nuestras hipótesis, hemos construido un modelo conceptual (Figura 1). Esto pretende describir cualitativamente nuestras hipótesis para estimular la investigación futura, en lugar de mantenerse como un modelo matemático.
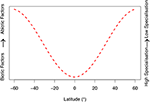
Figura 1. Modelo conceptual cualitativo basado en nuestras revisiones de las hipótesis desarrolladas. La especificidad de las comunidades fúngicas entomopatógenas cambia con la latitud, correspondiendo a factores bióticos y abióticos. Los factores bióticos están relacionados con las interacciones con el hospedador y otros microbios (es decir, carreras armamentísticas coevolutivas y vías de infección). Los factores abióticos incluyen variables ambientales como la temperatura, la humedad, la radiación UV y los factores de estrés oxidativo y osmótico. El rango latitudinal se limitó a 60°N y 60°S, ya que esta cifra no tiene en cuenta los extremos climáticos más allá de estos umbrales en las comunidades fúngicas. Nuestra hipótesis es que en latitudes más bajas los hongos entomopatógenos habitan en condiciones ambientales más idóneas, a pesar de la mayor presión de otras especies fúngicas, y de la mayor defensa del huésped (para más información, véanse las secciones «Condiciones abióticas y adaptación» e «Interacciones bióticas y adaptación» del texto principal). Esto se corresponde con un aumento de la especialización de los hongos entomopatógenos.
Condiciones abióticas y adaptación
Los hongos que habitan en latitudes más altas experimentan un mayor rango de temperaturas debido a la estacionalidad (Wielgolaski e Inouye, 2003). Por lo tanto, los factores de estrés abióticos (en particular la temperatura) en latitudes más altas pueden impulsar predominantemente la genética de la población y la adaptabilidad de EPF. En las regiones templadas, los EPF deben adaptarse a una amplia gama y a mayores niveles de intensidad climática (Maggi et al., 2013; Wang et al., 2017), por lo que los factores abióticos influyen principalmente en la supervivencia del patógeno generalista (Bidochka et al., 2001; Lennon et al., 2012). Por el contrario, nuestra hipótesis es que los factores bióticos de baja latitud, como la riqueza de especies y las asociaciones patógeno-insecto que impulsan las carreras armamentísticas coevolutivas, influyen predominantemente en la historia vital de la EPF. La B. bassiana filogenética se agrupa por tipo de hábitat más en latitudes altas estacionalmente variables (Ormond et al., 2010), aunque un estudio no encontró ningún efecto estacional en regiones de climas subtropicales (Garrido-Jurado et al., 2015). Las investigaciones estructuradas filogenéticamente sugieren que B. bassiana adapta la regulación genética a las condiciones ambientales, y que la adaptación al hábitat impulsa la dinámica de la población (Bidochka et al., 2002; Xiao et al., 2012). Por lo tanto, las diferencias en la magnitud de las condiciones ambientales estacionales en diferentes latitudes pueden contribuir a las disimilitudes temporales observadas en la dinámica de la población de B. bassiana entre los estudios.
Las condiciones ambientales cercanas a los límites de supervivencia de los hongos entomopatógenos pueden impulsar la adaptación local cuando estos límites se experimentan regularmente (Doberski, 1981; Vidal et al., 1997). La temperatura óptima para el crecimiento y la virulencia contra los insectos hospederos de las especies de Metarhizium y Beauveria está generalmente entre 25 y 30°C (Luz y Fargues, 1997; Ekesi et al., 1999; Devi et al., 2005; Bugeme et al., 2009). Sin embargo, existe una variación significativa en la preferencia térmica de las especies de hongos patógenos y sus efectos en los huéspedes potenciales, debido al entorno en el que los patógenos evolucionaron (Fargues et al., 1997; Bugeme et al., 2009; Alali et al., 2019), y las cepas individuales pueden diferir en su óptimo térmico (Doberski, 1981; Thomas y Jenkins, 1997; Alali et al., 2019). Las cepas de M. acridum obtenidas de un entorno cálido mostraron un mayor rendimiento a temperaturas más altas que las derivadas de un clima mucho más frío (Thomas y Jenkins, 1997). Del mismo modo, las cepas subtropicales de B. bassiana recogidas en las zonas más cálidas de Siria demostraron una mayor capacidad termotolerante que el aislado recogido en un lugar que experimentaba temperaturas más bajas (Alali et al., 2019). En cuanto a la virulencia contra los insectos, los aislados templados de B. bassiana fueron significativamente más eficaces contra el escarabajo de la corteza del olmo (Scolytus scolytus F.) a bajas temperaturas (de 2 a 6°C) que los aislados de M. anisopliae procedentes de latitudes tropicales y subtropicales (Doberski, 1981), aunque es imposible separar las diferencias de las especies fúngicas de las diferencias derivadas de las fuentes geográficas de las dos cepas fúngicas. B. bassiana y M. anisopliae también son sensibles a la radiación ultravioleta, lo que ha motivado el uso de protectores UV en las pulverizaciones de campo a base de aceite (Inglis et al., 1995; Shin et al., 2017; Kumar et al., 2018). La tolerancia a los rayos UV suele variar entre los aislados de diferentes latitudes (Braga et al., 2001; Fernandes et al., 2008), y tipos de hábitat (Bidochka et al., 2001). Los aislados de B. bassiana y M. anisopliae más cercanos al ecuador presentan una mayor tolerancia a los rayos UV, y las poblaciones adaptadas al frío de latitudes más altas suelen experimentar condiciones óptimas en temperaturas más frías (Fernandes et al., 2008). En Canadá, los aislados de Metarhizium que se encuentran en hábitats boscosos son menos tolerantes a la radiación UV y están más adaptados al frío en comparación con los paisajes agrícolas (Bidochka et al., 2001). Por tanto, la selección abiótica en latitudes altas (por ejemplo la exposición a los rayos UV en un determinado tipo de hábitat) para grupos genéticos específicos de hongos entomopatógenos podría influir en su eficacia en la agricultura, especialmente si los aislados proceden de hábitats boscosos o de setos.
Interacciones bióticas y adaptación
Los bosques tropicales soportan una alta diversidad de micotoxinas entomopatógenas, donde se encuentran mayoritariamente los teleomorfos (estadios sexuales) de los hongos hipocreales y suelen estar más especializados en su rango de hospedadores que los morfotipos asexuales (Evans, 1982; Vega et al., 2012; Hu et al., 2014). En cambio, los FEP de desarrollo asexual (anamorfos) habitan tanto en climas tropicales como templados (Vega et al., 2012). Los estudios de laboratorio en sistemas modelo que aumentaron la biodiversidad observaron la correspondiente intensificación de las carreras armamentísticas evolutivas entre huéspedes y parásitos (Betts et al., 2018). Del mismo modo, la diversidad genética y la especificidad del hospedador de algunas especies de hongos sugieren que los insectos hospedadores pueden ejercer fuertes presiones selectivas sobre los patógenos a través de una cascada de mecanismos de defensa y contradefensa (Maurer et al., 1997; Evans et al., 2011; Mukherjee y Vilcinskas, 2018). Por ejemplo, Metarhizium a menudo evolucionó de especialista a patógeno de insectos generalista; una expansión en el rango de huéspedes que coincide con la ocupación fúngica de un rango latitudinal en expansión (Bidochka y Small, 2005; Hu et al., 2014). Sin embargo, en zonas de selva tropical con alta densidad de especies, la alta diversidad fúngica tropical puede experimentar una mayor presión de los hospedadores y competidores que puede favorecer la aparición de patógenos como el género teleomorfo Cordyceps (Evans, 1982; Sung et al., 2007; Aung et al., 2008), y entomopatógenos fúngicos especializados del género Ophiocordyceps (Aung et al., 2008; Evans et al., 2011; Araújo et al., 2015). Los análisis filogenómicos sugieren que Beauveria spp. es la fase de vida asexual del linaje de Cordyceps (Xiao et al., 2012). A pesar de que Beauveria tiene vínculos genéticos directos con Cordyceps, las especies generalistas Beauveria y Metarhizium son menos comunes en los hábitats de la selva tropical y se encuentran con más frecuencia en la agricultura (Rehner, 2005; Aung et al., 2008). El contraste en las historias de vida entre estos especialistas y los hongos generalistas podría atribuirse a la pérdida de las mutaciones puntuales inducidas por repetición en B. bassiana y Metarhizium spp. (infiere que el ciclo sexual es raro en ambos hongos), que era un requisito previo de estos hongos patógenos para la expansión de las familias de genes (Xiao et al., 2012; Lovett y St. Leger, 2017).
Dado el probable origen del sudeste asiático de Metarhizium (el continente con mayor diversidad genotípica) (Bidochka y Small, 2005; Lovett y St. Leger, 2017), y los subsiguientes cambios evolutivos en la especificidad (Hu et al., 2014), una expansión del rango geográfico a las regiones templadas puede haber correspondido a un rango de huéspedes más generalista. Nuestra hipótesis es que esto podría deberse en parte a una menor riqueza de especies hospedadoras en las regiones templadas (Thompson et al., 2017), y a una necesidad de adaptarse a una mayor variación de las condiciones climáticas centrando la adaptación en las condiciones abióticas. Una cuestión pendiente es cómo la mayor diversidad potencial de hospedadores en los entornos tropicales altera estas presiones de selección. La investigación futura sobre cómo las carreras armadas entre insectos y patógenos alteran la composición de la comunidad con los cambios de latitud mejoraría la gestión de los entomopatógenos en diferentes latitudes. Además, las evaluaciones empíricas de los hongos recogidos en diferentes latitudes y los experimentos de laboratorio mejorarán nuestro conocimiento de las especies fúngicas endémicas y su relevancia dentro de un sistema particular, junto con su uso apropiado en los regímenes de biocontrol.
Mejorar la persistencia de los hongos y la prevención de los brotes de insectos
La capacidad de algunas especies fúngicas para cruzar grandes barreras geográficas (es decir, de naturaleza cosmopolita) no implica que la aplicación de hongos patógenos como bioplaguicida agrícola garantice la persistencia de los hongos. Más bien, es necesario investigar la idoneidad de un patógeno fúngico específico para el entorno de destino, incluyendo los efectos interactivos de los factores bióticos/abióticos individuales. Los esfuerzos deben dirigirse a centrarse en las comunidades fúngicas endémicas y aplicarse dentro de su sistema derivado. Las diferencias regionales entre el tipo de aplicación de hongos adecuados, el rango de hospedadores (es decir, generalista frente a especialista) y los factores ambientales dominantes (bióticos/abióticos) sobre el rendimiento del patógeno pueden predecir mejor el éxito a largo plazo del biocontrol entomopatógeno y ayudar a prevenir los brotes de insectos.
Contribuciones de los autores
AM escribió el primer borrador. AM y TN contribuyeron significativamente a los borradores posteriores.
Financiación
AM recibió el apoyo de una beca AusIndustry Innovations Connections para TN.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Akello, J., Dubois, T., Coyne, D., y Kyamanywa, S. (2008). Efecto de Beauveria bassiana endofítica sobre las poblaciones del picudo del plátano, Cosmopolites sordidus, y sus daños en plantas de plátano cultivadas en tejidos. Entomol. Exp. Appl. 129, 157-165. doi: 10.1111/j.1570-7458.2008.00759.x
CrossRef Full Text | Google Scholar
Akmal, M., Freed, S., Malik, M. N., and Gul, H. T. (2013). Eficacia de Beauveria bassiana (Deuteromycotina: Hypomycetes) contra diferentes especies de áfidos en condiciones de laboratorio. Pak. J. Zool. 45, 71-78.
Google Scholar
Alali, S., Mereghetti, V., Faoro, F., Bocchi, S., Al Azmeh, F., y Montagna, M. (2019). Aislados termotolerantes de Beauveria bassiana como potencial agente de control de plagas de insectos en climas subtropicales. PLoS ONE 14:e0211457. doi: 10.1371/journal.pone.0211457
PubMed Abstract | CrossRef Full Text | Google Scholar
Ali-Shtayeh, M. S., Mara’i, A.-B. B. M., y Jamous, R. M. (2003). Distribution, occurrence and characterization of entomopathogenic fungi in agricultural soil in the Palestinian area. Mycopathologia 156, 235-244. doi: 10.1023/A:1023339103522
PubMed Abstract | CrossRef Full Text | Google Scholar
Araújo, J. P. M., Evans, H. C., Geiser, D. M., Mackay, W. P., and Hughes, D. P. (2015). Unravelling the diversity behind the Ophiocordyceps unilateralis complex: three new species of zombie-ant fungi from the Brazilian Amazon. Zootaxa 22, 224-238. doi: 10.11646/phytotaxa.220.3.2
CrossRef Full Text | Google Scholar
Aung, O. M., Soytong, K., and Hyde, K. (2008). Diversity of entomopathogenic fungi in rainforests of Chiang Mai Province, Thailand. Fungal Divers. 30, 15-22.
Google Scholar
Bai, Z., Caspari, T., González, M. R., Batjes, N. H., Mäder, P., Bünemann, E. K., et al. (2018). Efectos de las prácticas de gestión agrícola en la calidad del suelo: una revisión de los experimentos a largo plazo para Europa y China. Agric. Ecosyst. Environ. 265, 1-7. doi: 10.1016/j.agee.2018.05.028
CrossRef Full Text | Google Scholar
Behie, S. W., Jones, S. J., y Bidochka, M. J. (2015). Localización en el tejido vegetal de los hongos patógenos de insectos endofíticos Metarhizium y Beauveria. Fungal Ecol. 13, 112-119. doi: 10.1016/j.funeco.2014.08.001
CrossRef Full Text | Google Scholar
Behie, S. W., Zelisko, P., and Bidochka, M. J. (2012). Los hongos endofíticos parásitos de insectos translocan el nitrógeno directamente de los insectos a las plantas. Science 336, 1576-1577. doi: 10.1126/science.1222289
PubMed Abstract | CrossRef Full Text | Google Scholar
Betts, A., Gray, C., Zelek, M., MacLean, R. C., y King, K. C. (2018). La alta diversidad de parásitos acelera la adaptación y la diversificación del huésped. Science 360, 907-911. doi: 10.1126/science.aam9974
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., Kamp, A. M., Lavender, T. M., Dekoning, J., y De Croos, J. N. (2001). Habitat association in two genetic groups of the insect-pathogenic fungus Metarhizium anisopliae: uncovering cryptic species? Appl. Environ. Microbiol. 67, 1335-1342. doi: 10.1128/AEM.67.3.1335-1342.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., Menzies, F. V., and Kamp, A. M. (2002). Los grupos genéticos del hongo patógeno de insectos Beauveria bassiana están asociados con las preferencias de hábitat y crecimiento térmico. Arch. Microbiol. 178, 531-537. doi: 10.1007/s00203-002-0490-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., y Small, C. L. (2005). «Phylogeography of Metarhizium, an insect pathogenic fungus», en Insect-Fungal Associations: Ecology and Evolution, eds F. E. Vega and M. Blackwell (New York, NY: Oxford University Press), 75-118.
Google Scholar
Blanford, S., and Thomas, M. B. (2000). Comportamiento térmico de dos especies de acridios: efectos del hábitat y la estación del año en la temperatura corporal y el impacto potencial en el biocontrol con patógenos. Environ. Entomol. 29, 1060-1069. doi: 10.1603/0046-225X-29.5.1060
CrossRef Full Text | Google Scholar
Braga, G., Flint, S., Miller, C., Anderson, A., and Roberts, D. (2001). Variability in response to UV-B among species and strains of Metarhizium isolated from sites at latitudes from 61°N to 54°S. J. Invertebr. Pathol. 78, 98-108. doi: 10.1006/jipa.2001.5048
PubMed Abstract | CrossRef Full Text | Google Scholar
Bridge, P. D., Prior, C., Sagbohan, J., Lomer, C. J., Carey, M., and Buddie, A. (1997). Molecular characterization of isolates of Metarhizium from locusts and grasshoppers. Biodivers. Conserv. 6, 177-189. doi: 10.1023/A:1018387918686
CrossRef Full Text | Google Scholar
Bridge, P. D., Williams, M. A. J., Prior, C., and Paterson, R. R. M. (1993). Morphological, biochemical and molecular characteristics of Metarhizium anisopliae and M. flavoviride. J. Gen. Microbiol 139, 1163-1169. doi: 10.1099/00221287-139-6-1163
CrossRef Full Text | Google Scholar
Bugeme, D. M., Knapp, M., Boga, H. I., Wanjoya, A. K., and Maniania, N. K. (2009). Influencia de la temperatura en la virulencia de aislados fúngicos de Metarhizium anisopliae y Beauveria bassiana en la araña roja Tetranychus urticae. Mycopathologia 167, 221-227. doi: 10.1007/s11046-008-9164-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Castrillo, L. A., Bauer, L. S., Liu, H., Griggs, M. H., and Vandenberg, J. D. (2010). Caracterización de aislados de Beauveria bassiana (Ascomycota: Hypocreales) asociados a poblaciones de Agrilus planipennis (Coleoptera: Buprestidae) en Michigan. Biol. Control 54, 135-140. doi: 10.1016/j.biocontrol.2010.04.005
CrossRef Full Text | Google Scholar
Devi, K. U., Sridevi, V., Mohan, C. M., and Padmavathi, J. (2005). Effect of high temperature and water stress on in vitro germination and growth in isolates of the entomopathogenic fungus Beauveria bassiana (Bals.) Vuillemin. J. Invertebr. Pathol. 88, 181-189. doi: 10.1016/j.jip.2005.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Doberski, J. W. (1981). Estudios comparativos de laboratorio sobre tres hongos patógenos del escarabajo de la corteza del olmo Scolytus scolytus: Efecto de la temperatura y la humedad en la infección por Beauveria bassiana, Metarhizium anisopliae y Paecilomyces farinosus. J. Invertebr. Pathol. 37, 195-200. doi: 10.1016/0022-2011(81)90075-6
CrossRef Full Text | Google Scholar
Driver, F., Milner, R. J., y Trueman, J. W. H. (2000). A taxonomic revision of Metarhizium based on a phylogenetic analysis of rDNA sequence data. Mycol. Res. 104, 134-150. doi: 10.1017/S0953756299001756
CrossRef Full Text | Google Scholar
Ekesi, S., Maniania, N. K., and Ampong-Nyarko, K. (1999). Effect of temperature on germination, radial growth and virulence of Metarhizium anisopliae and Beauveria bassiana on Megalurothrips sjostedti. Biocontrol Sci. Technol. 9, 177-185. doi: 10.1080/09583159929767
CrossRef Full Text | Google Scholar
Evans, H. C. (1982). Los hongos entomógenos en los ecosistemas forestales tropicales: una evaluación. Ecol. Entomol. 7, 47-60. doi: 10.1111/j.1365-2311.1982.tb00643.x
CrossRef Full Text | Google Scholar
Evans, H. C., Elliot, S. L., and Hughes, D. P. (2011). Diversidad oculta tras el hongo zombi Ophiocordyceps unilateralis: Cuatro nuevas especies descritas de hormigas carpinteras en Minas Gerais, Brasil. PLoS ONE 6:e17024. doi: 10.1371/journal.pone.0017024
PubMed Abstract | CrossRef Full Text | Google Scholar
Fargues, J., Goettel, M. S., Smits, N., Ouedraogo, A., and Rougier, M. (1997). Effect of temperature on vegetative growth of Beauveria bassiana isolates from different origins. Mycologia 89, 383-892. doi: 10.1080/00275514.1997.12026797
CrossRef Full Text | Google Scholar
Fargues, J., and Luz, C. (2000). Efectos de la fluctuación de los regímenes de humedad y temperatura sobre el potencial de infección de Beauveria bassiana para Rhodnius prolixus. J. Invertebr. Pathol. 75, 202-211. doi: 10.1006/jipa.1999.4923
PubMed Abstract | CrossRef Full Text | Google Scholar
Faria, M. R. D., and Wraight, S. P. (2007). Micoinsecticidas y micoacaricidas: una lista completa con cobertura mundial y clasificación internacional de tipos de formulación. Biol. Control 43, 237-256. doi: 10.1016/j.biocontrol.2007.08.001
CrossRef Full Text | Google Scholar
Fernandes, E. K., Rangel, D. E. N., Moraes, Á. M. L., Bittencourt, V. R. E. P., y Roberts, D. W. (2008). Cold activity of Beauveria and Metarhizium, and thermotolerance of Beauveria. J. Invertebr. Pathol. 98, 69-78. doi: 10.1016/j.jip.2007.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuxa, J. R., and Richter, A. R. (2004). Efectos de la humedad y composición del suelo y del aislado fúngico sobre la prevalencia de Beauveria bassiana en colonias de laboratorio de la hormiga roja de fuego importada (Hymenoptera: Formicidae). Environ. Entomol. 33, 975-981. doi: 10.1603/0046-225X-33.4.975
CrossRef Full Text | Google Scholar
García-Ortiz, N., Figueroa-Martínez, F. J., Carrasco-Navarro, U., Favela-Torres, E., y Loera, O. (2018). La concentración de oxígeno en los cultivos modula la expresión de proteínas y las respuestas antioxidantes enzimáticas en conidios de Metarhizium lepidiotae. Fungal Biol. 122, 487-496. doi: 10.1016/j.funbio.2017.10.013
PubMed Abstract | CrossRef Full Text | Google Scholar
García-Ortiz, N., Tlecuitl-Beristain, S., Favela-Torres, E., y Loera, O. (2015). Producción y calidad de conidios por Metarhizium anisopliae var. lepidiotum: nivel crítico de oxígeno y periodo de competencia del micelio. Appl. Microbiol. Biotechnol. 99, 2783-2791. doi: 10.1007/s00253-014-6225-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Garrido-Jurado, I., Fernández-Bravo, M., Campos, C., y Quesada-Moraga, E. (2015). Diversidad de Hypocreales entomopatógenos en el suelo y los filoplanos de cinco sistemas de cultivo mediterráneos. J. Invertebr. Pathol. 130, 97-106. doi: 10.1016/j.jip.2015.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Garza-López, P. M., Konigsberg, M., Gómez-Quiroz, L. E., and Loera, O. (2012). Respuesta fisiológica y antioxidante de Beauveria bassiana Bals (Vuill.) a diferentes concentraciones de oxígeno. World J. Microbiol. Biotechnol. 28, 353-359. doi: 10.1007/s11274-011-0827-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Greenfield, M., Gómez-Jiménez, M. I., Ortiz, V., Vega, F. E., Kramer, M., y Parsa, S. (2016). Beauveria bassiana y Metarhizium anisopliae colonizan endofíticamente las raíces de la yuca tras su inoculación en el suelo. Biol. Control 95, 40-48. doi: 10.1016/j.biocontrol.2016.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Griffin, D. M. (1963). La humedad del suelo y la ecología de los hongos del suelo. Biol. Rev. 38, 141-166. doi: 10.1111/j.1469-185X.1963.tb00781.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Hu, X., Xiao, G., Zheng, P., Shang, Y., Su, Y., Zhang, X., et al. (2014). Trayectoria y determinantes genómicos de la especiación hongo-patógeno y la adaptación del huésped. Proc. Natl. Acad. Sci. U.S.A. 111, 16796-16801. doi: 10.1073/pnas.1412662111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ignoffo, C. M., Garcia, C., Hostetter, D. L., and Pinnell, R. E. (1977). Vertical movement of conidia of Nomuraea rileyi through sand and loam soils. J. Econ. Entomol. 70, 163-164. doi: 10.1093/jee/70.2.163
CrossRef Full Text | Google Scholar
Inglis, G., Goettel, M. S., Butt, T., and Strasser, H. (2001). «Use of hyphomycetous fungi for managing insect pests», en Fungi as Biocontrol Agents: Progress, Problems and Potential, eds T. M. Butt, C. Jackson, and N. Magan (Oxfordshire: CABI Publishing), 23-69. doi: 10.1079/9780851993560.0023
CrossRef Full Text | Google Scholar
Inglis, G. D., Duke, G. M., Goettel, M. S., Kabaluk, J. T., y Ortega-Polo, R. (2019). Biogeografía y diversidad genotípica de Metarhizium brunneum y Metarhizium robertsii en suelos del noroeste de América del Norte. Can. J. Microbiol. 65, 261-281. doi: 10.1139/cjm-2018-0297
PubMed Abstract | CrossRef Full Text | Google Scholar
Inglis, G. D., Duke, G. M., Kawchuk, L. M., y Goettel, M. S. (1999). Influencia de las temperaturas oscilantes en la infección competitiva y la colonización del saltamontes migratorio por Beauveria bassiana y Metarhizium flavoviride. Biol. control 14, 111-120. doi: 10.1006/bcon.1998.0666
CrossRef Full Text | Google Scholar
Inglis, G. D., Goettel, M. S., y Johnson, D. L. (1995). Influencia de los protectores de luz ultravioleta en la persistencia del hongo entomopatógeno, Beauveria bassiana. Biol. Control 5, 581-590. doi: 10.1006/bcon.1995.1069
CrossRef Full Text | Google Scholar
Inglis, G. D., Johnson, D. L., Kawchuk, L. M., and Goettel, M. S. (1998). Effect of soil texture and soil sterilization on susceptibility of ovipositing grasshoppers to Beauveria bassiana. J. Invertebr. 71, 73-81. doi: 10.1006/jipa.1997.4698
PubMed Abstract | CrossRef Full Text | Google Scholar
Jabbour, R., and Barbercheck, M. E. (2009). Efectos del manejo del suelo sobre los hongos entomopatógenos durante la transición a la agricultura orgánica en una rotación de granos forrajeros. Biol. Control 51, 435-443. doi: 10.1016/j.biocontrol.2009.08.004
CrossRef Full Text | Google Scholar
Jaronski, S. T. (2010). Factores ecológicos en el uso inundativo de entomopatógenos fúngicos. Biocontrol 55, 159-185. doi: 10.1007/s10526-009-9248-3
CrossRef Full Text | Google Scholar
Kassa, A., Stephan, D., Vidal, S., and Zimmermann, G. (2004). Laboratory and field evaluation of different formulations of Metarhizium anisopliae var. acridum submerged spores and aerial conidia for the control of locusts and grasshoppers. Biocontrol 49, 63-81. doi: 10.1023/B:BICO.0000009384.46858.aa
CrossRef Full Text | Google Scholar
Kessler, P., Enkerl, J., Schweize, C., and Keller, S. (2004). Survival of Beauveria brongniartii in the soil after application as a biocontrol agent against the European cockchafer Melolontha melolontha. Biocontrol 49, 563-581. doi: 10.1023/B:BICO.0000036441.40227.ed
CrossRef Full Text | Google Scholar
Kessler, P., Matzke, H., and Keller, S. (2003). El efecto del tiempo de aplicación y los factores del suelo en la aparición de Beauveria brongniartii aplicado como agente de control biológico en el suelo. J. Invertebr. Pathol. 84, 15-23. doi: 10.1016/j.jip.2003.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Keyser, C. A., Fernandes, É. K. K., Rangel, D. E. N., Foster, R. N., Jech, L. E., Reuter, K. C., et al. (2017). Bioensayos de laboratorio y ensayos en jaulas de campo de aislados de Metarhizium spp. con grillos de Mormón (Anabrus simplex) recolectados en el campo. Biocontrol 62, 257-268. doi: 10.1007/s10526-016-9782-8
CrossRef Full Text | Google Scholar
Kumar, K. K., Sridhar, J., Murali-Baskaran, R. K., Senthil-Nathan, S., Kaushal, P., Dara, S. K., et al. (2018). Bioplaguicidas microbianos para el manejo de plagas de insectos en la India: estado actual y perspectivas futuras. J. Invertebr. Pathol. 165, 74-81. doi: 10.1016/j.jip.2018.10.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lacey, L. A., Grzywacz, D., Shapiro-Ilan, D. I., Frutos, R., Brownbridge, M., y Goettel, M. S. (2015). Insectos patógenos como agentes de control biológico: de vuelta al futuro. J. Invertebr. Pathol. 132, 1-41. doi: 10.1016/j.jip.2015.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Leal, S. C. M., Bertioli, T. M., Butt, T. M., y Peberdy, J. F. (1994). Caracterización de aislados del hongo entomopatógeno Metarhizium anisopliae por RAPD-PCR. Mycol. Res. 98, 1077-1081. doi: 10.1016/S0953-7562(09)80436-X
CrossRef Full Text | Google Scholar
Lennon, J. T., Aanderud, Z. T., Lehmkuhl, B. K., y Schoolmaster, D. R. Jr. (2012). Mapping the niche space of soil microorganisms using taxonomy and traits. Ecology 93, 1867-1879. doi: 10.1890/11-1745.1
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, F., Shi, H.-Q., Ying, S.-H., y Feng, M.-G. (2015). Distintas contribuciones de una superóxido dismutasa cofacturada con Fe y dos con Cu/Zn a la antioxidación, la tolerancia a los rayos UV y la virulencia de Beauveria bassiana. Fungal Genet. Biol. 81, 160-171. doi: 10.1016/j.fgb.2014.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Z. B., Alves, S., Roberts, D., Fan, M., Delalibera, I., Tang, J., et al. (2010). Control biológico de insectos en Brasil y China: historia, programas actuales y razones de sus éxitos utilizando hongos entomopatógenos. Biocontrol Sci. Technol. 20, 117-136. doi: 10.1080/09583150903431665
CrossRef Full Text | Google Scholar
Lingg, A. J., y Donaldson, M. D. (1981). Factores bióticos y abióticos que afectan a la estabilidad de los conidios de Beauveria bassiana en el suelo. J. Invertebr. Pathol. 38, 191-200. doi: 10.1016/0022-2011(81)90122-1
CrossRef Full Text | Google Scholar
Lovett, B., and St. Leger, R. J. (2015). El estrés es la regla y no la excepción para Metarhizium. Curr. Genet. 61, 253-261. doi: 10.1007/s00294-014-0447-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett, B., y St. Leger, R. J. (2017). Los patógenos de los insectos. Microbiol. Spectr. 5, 1-19. doi: 10.1128/microbiolspec.FUNK-0001-2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Luz, C., y Fargues, J. (1997). Requisitos de temperatura y humedad para la germinación conidial de un aislado de Beauveria bassiana, patógeno de Rhodnius prolixus. Mycopathologia 138, 117-125. doi: 10.1023/A:1006803812504
PubMed Abstract | CrossRef Full Text | Google Scholar
Maggi, O., Tosi, S., Angelova, M., Lagostina, E., Fabbri, A. A., Pecoraro, L., et al. (2013). Adaptación de los hongos, incluyendo las levaduras, a los ambientes fríos. Plant Biosyst. 147, 247-258. doi: 10.1080/11263504.2012.753135
CrossRef Full Text | Google Scholar
Mahe, F., de Vargas, C., Bass, D., Czech, L., Stamatakis, A., Lara, E., et al. (2017). Los parásitos dominan las comunidades de protistas del suelo hiperdiversas en los bosques tropicales neotropicales. Nat. Ecol. Evol. 1:0091. doi: 10.1038/s41559-017-0091
PubMed Abstract | CrossRef Full Text | Google Scholar
Mascarin, G. M., Lopes, R. B., Delalibera, I., Fernandes, E. K. K., Luz, C., and Faria, M. (2019). Estado actual y perspectivas de los entomopatógenos fúngicos utilizados para el control microbiano de plagas de artrópodos en Brasil. J. Invertebr. Pathol. 165, 46-53. doi: 10.1016/j.jip.2018.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Maurer, P., Couteaudier, Y., Girard, P. A., Bridge, P. D., y Riba, G. (1997). Genetic diversity of Beauveria bassiana and relatedness to host insect range. Mycol. Res. 101, 159-164. doi: 10.1017/S0953756296002213
CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2006a). Isolation and characterisation of Beauveria bassiana isolates from phylloplanes of hedgerow vegetation. Mycol. Res. 110, 188-195. doi: 10.1016/j.mycres.2005.09.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2006b). Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agric. Ecosyst. Environ. 113, 336-341. doi: 10.1016/j.agee.2005.10.011
CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2007). Ecología de los hongos entomopatógenos Beauveria bassiana y Metarhizium anisopliae en agroecosistemas templados: potencial para el control biológico de conservación. Biol. Control 43, 145-155. doi: 10.1016/j.biocontrol.2007.07.007
CrossRef Full Text | Google Scholar
Meyling, N. V., Lubeck, M., Buckley, E. P., Eilenberg, J., and Rehner, S. A. (2009). Community composition, host range and genetic structure of the fungal entomopathogen Beauveria in adjoining agricultural and seminatural habitats. Mol. Ecol. 18, 1282-1293. doi: 10.1111/j.1365-294X.2009.04095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Migiro, L. N., Maniania, N. K., Chabi-Olaye, A., y Vandenberg, J. (2010). Patogenicidad de hongos entomopatógenos Metarhizium anisopliae y Beauveria bassiana (Hypocreales: Clavicipitaceae) aislados para el minador del guisante adulto (Diptera: Agromyzidae) y perspectivas de un dispositivo de autoinoculación para la infección en el campo. Environ. Entomol. 39, 468-475. doi: 10.1603/EN09359
PubMed Abstract | CrossRef Full Text | Google Scholar
Miranda-Hernández, F., Saucedo-Castañeda, G., Alatorre-Rosas, R., y Loera, O. (2014). Las condiciones de cultivo ricas en oxígeno mejoran la infectividad de los conidios y la calidad de dos cepas de Isaria fumosorosea para mejorar potencialmente los procesos de biocontrol. Pest Manage. Sci. 70, 661-666. doi: 10.1002/ps.3605
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeskops, B., Sukristiyonubowo Buchan, D., Sleutel, S., Herawaty, L., Husen, E., et al. (2010). Soil microbial communities and activities under intensive organic and conventional vegetable farming in West Java, Indonesia. Appl. Soil Ecol. 45, 112-120. doi: 10.1016/j.apsoil.2010.03.005
CrossRef Full Text | Google Scholar
Mukherjee, K., and Vilcinskas, A. (2018). El hongo entomopatógeno Metarhizium robertsii se comunica con el insecto huésped Galleria mellonella durante la infección. Virulence 9, 402-413. doi: 10.1080/21505594.2017.1405190
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira, A. S., and Rangel, D. E. N. (2018). La anoxia transitoria durante el crecimiento de Metarhizium robertsii aumenta la virulencia conidial a Tenebrio molitor. J. Invertebr. Pathol. 153, 130-133. doi: 10.1016/j.jip.2018.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Ormond, E. L., Thomas, A. P., Pugh, P. J., Pell, J. K., y Roy, H. E. (2010). Un hongo patógeno en el tiempo y el espacio: la dinámica de la población de Beauveria bassiana en un bosque de coníferas. FEMS Microbiol. Ecol. 74, 146-154. doi: 10.1111/j.1574-6941.2010.00939.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ortiz-Urquiza, A., y Keyhani, N. O. (2015). Señalización de la respuesta al estrés y virulencia: conocimientos de los hongos entomopatógenos. Curr. Genet. 61, 239-249. doi: 10.1007/s00294-014-0439-9
CrossRef Full Text | Google Scholar
Pal, K. K., and Gardener, M. B. (2006). Control biológico de los patógenos de las plantas. Plant Health Instr. doi: 10.1094/PHI-A-2006-1117-02Disponible en línea en: http://www.apsnet.org/edcenter/advanced/topics/Pages/BiologicalControl.aspx
CrossRef Full Text | Google Scholar
Pérez-González, V. H., Guzmán-Franco, A. W., Alatorre-Rosas, R., Hernández-López, J., Hernández-López, A., Carrillo-Benítez, M. G., et al. (2014). Diversidad específica de los hongos entomopatógenos Beauveria y Metarhizium en suelos agrícolas mexicanos. J. Invertebr. Pathol. 119, 54-61. doi: 10.1016/j.jip.2014.04.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Posada, F., y Vega, F. E. (2005). Establecimiento del hongo entomopatógeno Beauveria bassiana (Ascomycota: Hypocreales) como endófito en plántulas de cacao (Theobroma cacao). Mycologia 97, 1195-1200. doi: 10.1080/15572536.2006.11832729
PubMed Abstract | CrossRef Full Text | Google Scholar
Pulla, S., Riotte, J., Suresh, H. S., Dattaraja, H. S., y Sukumar, R. (2016). Controles de la variabilidad espacial del suelo en un bosque tropical seco. PLoS ONE 11:e0153212. doi: 10.1371/journal.pone.0153212
PubMed Abstract | CrossRef Full Text | Google Scholar
Quesada-Moraga, E., Navas-Cortes, J. A., Maranhao, E. A., Ortiz-Urquiza, A., y Santiago-Alvarez, C. (2007). Factores que afectan a la aparición y distribución de hongos entomopatógenos en suelos naturales y cultivados. Mycol. Res. 111(Pt 8), 947-966. doi: 10.1016/j.mycres.2007.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Rangel, D. E. N., Braga, G. U. L., Anderson, A. J., and Roberts, D. W. (2005). Variabilidad en la termotolerancia conidial de aislados de Metarhizium anisopliae de diferentes orígenes geográficos. J. Invertebr. Pathol. 88, 116-125. doi: 10.1016/j.jip.2004.11.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rangel, D. E. N., Braga, G. U. L., Fernandes, É. K. K., Keyser, C. A., Hallsworth, J. E., y Roberts, D. W. (2015). La tolerancia al estrés y la virulencia de los hongos patógenos de insectos están determinadas por las condiciones ambientales durante la formación de conidios. Curr. Genet. 61, 383-404. doi: 10.1007/s00294-015-0477-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehner, S., and Buckley, E. (2005). A Beauveria phylogeny inferred from nuclear ITS and EF1-alpha sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia 97, 84-98. doi: 10.3852/mycologia.97.1.84
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehner, S. A. (2005). «Phylogenetics of the insect pathogenic genus Beauveria», en Insect-Fungal Associations: Ecology and Evolution, eds F. E. Vega and M. Blackwell (New York, NY: Oxford University Press), 3-27.
Google Scholar
Rombach, M. C., Humber, R. A., and Roberts, D. W. (1986). Metarhizium flavoviride var. minus, var. nov., a pathogen of plant- and leafhoppers on rice in the Philippines and Solomon Islands. Mycotaxon 27, 87-92.
Google Scholar
Shin, T. Y., Bae, S. M., Kim, D. J., Yun, H. G., y Woo, S. D. (2017). Evaluación de la virulencia, la tolerancia a los factores ambientales y las actividades antimicrobianas de los hongos entomopatógenos contra la araña roja de dos manchas, Tetranychus urticae. Mycoscience 58, 204-212. doi: 10.1016/j.myc.2017.02.002
CrossRef Full Text | Google Scholar
Singha, D., Singha, B., and Dutta, B. K. (2010). Potential of Metarhizium anisopliae and Beauveria bassiana in the control of tea termite Microtermes obesi Holmgren in vitro and under field conditions. J. Pest. Sci. 84, 69-75. doi: 10.1007/s10340-010-0328-z
CrossRef Full Text | Google Scholar
Skinner, M., Gouli, S., Frank, C. E., Parker, B. L., and Kim, J. S. (2012). Manejo de Frankliniella occidentalis (Thysanoptera: Thripidae) con formulaciones granulares de hongos entomopatógenos. Biol. Control 63, 246-252. doi: 10.1016/j.biocontrol.2012.08.004
CrossRef Full Text | Google Scholar
St. Leger, R. J., May, B., Allee, L. L., Frank, D. C., Staples, R. C., y Robers, D. W. (1992). Genetic differences in allozymes and in formation of infection structures among isolates of the entomopathogenic fungus Metarhizium anisopliae. J. Invertebr. 60, 89-101. doi: 10.1016/0022-2011(92)90159-2
CrossRef Full Text | Google Scholar
Storey, G. K., and Gardner, W. A. (1988). Movimiento de un spray acuoso de Beauveria bassiana en el perfil de cuatro suelos de Georgia. Environ. Entomol. 17, 135-139. doi: 10.1093/ee/17.1.135
CrossRef Full Text | Google Scholar
Studdert, J. P., and Kaya, H. K. (1990). Efecto del potencial hídrico, la temperatura y el recubrimiento de arcilla sobre la supervivencia de los conidios de Beauveria bassiana en un suelo de marga y turba. J. Invertebr. Pathol. 55, 417-427. doi: 10.1016/0022-2011(90)90086-L
CrossRef Full Text | Google Scholar
Sung, G.-H., Hywel-Jones, N. L., Sung, J.-M., Luangsa-ard, J. J., Shrestha, B., and Spatafora, J. W. (2007). Phylogenetic classification of Cordyceps and the clavicipitaceous fungi. Stud. Mycol. 57, 5-59. doi: 10.3114/sim.2007.57.01
PubMed Abstract | CrossRef Full Text | Google Scholar
Takatsuka, J. (2007). Characterization of Beauveria bassiana isolates from Japan using inter-simple-sequence-repeat-anchored polymerase chain reaction (ISSR-PCR) amplification. Appl. Entomol. Zool. 42, 563-571. doi: 10.1303/aez.2007.563
CrossRef Full Text | Google Scholar
Thomas, M. B., and Jenkins, N. E. (1997). Effects of temperature on growth of Metarhizium flavoviride and virulence to the variegated grasshopper, Zonocerus variegatus. Mycol. Res 101, 1469-1474. doi: 10.1017/S0953756297004401
CrossRef Full Text | Google Scholar
Thompson, L. R., Sanders, J. G., McDonald, D., Amir, A., Ladau, J., Locey, K. J., et al. (2017). Un catálogo comunitario revela la diversidad microbiana multiescalar de la Tierra. Nature 551, 457-463. doi: 10.1038/nature24621
PubMed Abstract | CrossRef Full Text | Google Scholar
Tigano-Milani, M. S., Gomes, A. C. M. M., y Sobral, B. W. S. (1995). Variabilidad genética entre los aislamientos brasileños del hongo entomopatógeno Metarhizium anisopliae. J. Invertebr. 65, 206-210. doi: 10.1006/jipa.1995.1031
CrossRef Full Text | Google Scholar
Vänninen, I., Tyni-Juslin, J., and Hokkanen, H. (2000). Persistencia de Metarhizium anisopliae y Beauveria bassiana aumentados en suelos agrícolas finlandeses. Biocontrol 45, 201-222. doi: 10.1023/A:1009998919531
CrossRef Full Text | Google Scholar
Vega, F. E. (2008). Patología de insectos y endófitos fúngicos. J. Invertebr. Pathol. 98, 277-279. doi: 10.1016/j.jip.2008.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Vega, F. E., Goettel, M. S., Blackwell, M., Chandler, D., Jackson, M. A., Keller, S., et al. (2009). Fungal entomopathogens: new insights on their ecology. Fungal Ecol. 2, 149-159. doi: 10.1016/j.funeco.2009.05.001
CrossRef Full Text | Google Scholar
Vega, F. E., Meyling, N. V., Luangsa-ard, J. J., and Blackwell, M. (2012). «Fungal entomopathogens,» in Insect Pathology, eds F. E. Vega and H. K. Kaya (Cambridge, MA: Academic Press), 171-220. doi: 10.1016/B978-0-12-384984-7.00006-3
CrossRef Full Text | Google Scholar
Vidal, C., Fargues, J., and Lacey, L. A. (1997). Variabilidad intraespecífica de Paecilomyces fumosoroseus: efecto de la temperatura sobre el crecimiento vegetativo. J. Invertebr. 70, 18-26. doi: 10.1006/jipa.1997.4658
CrossRef Full Text | Google Scholar
Wang, M., Tian, J., Xiang, M., y Liu, X. (2017). Estrategia de vida de los hongos adaptados al frío con la referencia de varias especies representativas. Mycology 8, 178-188. doi: 10.1080/21501203.2017.1370429
PubMed Abstract | CrossRef Full Text | Google Scholar
Wielgolaski, F. E., y Inouye, D. W. (2003). «High latitude climates», en Phenology: An Integrative Environmental Science, ed M. D. Schwartz (Dordrecht: Springer), 175-194. doi: 10.1007/978-94-007-0632-3_12
CrossRef Full Text | Google Scholar
Wraight, S. P., Ugine, T. A., Ramos, M. E., y Sanderson, J. P. (2016). Eficacia de las aplicaciones de pulverización de hongos entomopatógenos contra los trips de las flores occidentales que infestan las impatiens de invernadero en condiciones de humedad variable. Biol. Control 97, 31-47. doi: 10.1016/j.biocontrol.2016.02.016
CrossRef Full Text | Google Scholar
Xiao, G., Ying, S. H., Zheng, P., Wang, Z. L., Zhang, S., Xie, X. Q., et al. (2012). Genomic perspectives on the evolution of fungal entomopathogenicity in Beauveria bassiana. Sci. Rep. 2:483. doi: 10.1038/srep00483
PubMed Abstract | CrossRef Full Text | Google Scholar
Zimmermann, G. (2007). Revisión sobre la seguridad del hongo entomopatógeno Metarhizium anisopliae. Biocontrol Sci. Technol. 17, 879-920. doi: 10.1080/09583150701593963
CrossRef Full Text | Google Scholar