Dada la abundancia de funciones que debe realizar un biorreactor, es posible que se pregunte cómo puede hacerlo todo. ¿Qué componentes necesita? ¿Cómo sabe cuáles son las condiciones actuales del biorreactor y cómo puede corregirlas? Y, por último, sólo para tener una perspectiva: ¿cómo toma los datos capturados durante un bioproceso por lotes, los muestra de una manera significativa, y luego los guarda y evalúa mientras los mantiene organizados?
A continuación se tratan los parámetros de proceso más importantes y los mecanismos para regularlos:
- Mezcla del cultivo
- Control de la temperatura
- Control del pH
- Alimentación de nutrientes
- Gasificación
- Presión control
- Prevención de la formación de espuma
Mezcla del cultivo
El cultivo en un biorreactor necesita ser mezclado a fondo en todo momento. Si los nutrientes en el biorreactor no se dispersan lo suficientemente bien, las condiciones en ciertas partes del biorreactor se desviarán significativamente del ideal. El pH podría ser demasiado ácido, por ejemplo, o el suministro de nutrientes podría ser insuficiente. Desviaciones como éstas no sólo reducen la eficacia del bioproceso previsto, sino que también pueden favorecer las modificaciones genéticas. La distribución de la temperatura es una preocupación adicional. Sin una agitación uniforme, los microorganismos o los cultivos celulares situados a lo largo del borde del recipiente serán literalmente hervidos, mientras que los situados en el centro se enfriarán. Si alguna vez ha calentado una sopa en el microondas y luego se la ha comido con gran expectación sin removerla, sabrá a qué nos referimos.
La velocidad típica de removido varía, entre otras cosas, en función del organismo cultivado:
| Organismo | Ritmo de mezcla | ||||
| Bacterias, Levaduras, Hongos | 500 – 1500 min-1 | ||||
| Células de mamíferos, Células de insectos o de plantas | 30 – 300 min-1 | ||||
El ajuste de las velocidades de agitación para el cultivo de microorganismos, células de plantas, células de animales o células de insectos es muy importante, ya que éstos reaccionan de forma diferente al estrés de cizallamiento, es decir.e., la tensión mecánica causada por la agitación. Dependiendo de la línea celular, los cultivos celulares pueden tener una respuesta mucho más intensa a una agitación demasiado vigorosa, es decir, simplemente mueren, una tendencia que los científicos describen con mayor precisión (y diplomacia) como «sensible al estrés de cizallamiento». La disponibilidad de oxígeno puede variarse durante el bioproceso cambiando la velocidad de agitación, asegurando así un crecimiento celular óptimo.
Medir y controlar la temperatura
Tanto los microorganismos como los cultivos celulares tienen enzimas que funcionan mejor dentro de ciertos rangos de temperatura y pH. Si las condiciones caen fuera de estos rangos, el bioproceso deseado avanzará mucho más lentamente, porque el crecimiento y el rendimiento metabólico dependen en gran medida de estas enzimas, es decir, de las proteínas catalíticamente activas. En el peor de los casos, las condiciones ambientales desfavorables pueden incluso destruirlas. Los cultivos de células de mamíferos se sienten más cómodos dentro de un rango muy estrecho de temperaturas, uno que sólo se da desde su perspectiva cuando la temperatura dentro del recipiente de cultivo es de 37 °C.
Por lo tanto, en el biorreactor se utiliza un sensor de resistencia de platino conocido como sensor Pt100 para determinar la temperatura. Tiene una resistencia de 100 Ω a 0 °C, y cubre el rango de medición biológicamente relevante esperado bastante bien cuando se calibra adecuadamente.
El rango de temperatura típico varía, entre otras cosas, en función del organismo cultivado:
| Organismo | Gama de temperatura | ||||
| Bacterias, Levaduras, Hongos | +20 °C a +60 °C | ||||
| Mamíferos, Células de insectos o plantas | +25 °C a +37 °C | ||||
Si se trabaja a temperaturas cercanas o inferiores a la temperatura ambiente, se necesitará un sistema de refrigeración activo, como un enfriador de recirculación. Para la mayoría de los bioprocesos, la temperatura debe permanecer constante durante todo el cultivo. Sin embargo, para algunos productos, como la penicilina o las proteínas recombinantes (es decir, las proteínas de bioingeniería que utilizan organismos modificados genéticamente), cambiar la temperatura al final de la fase de crecimiento activa genes importantes para la formación del producto y, por tanto, es beneficioso. En el caso de los métodos de producción que implican cultivos celulares, a veces también se reduce la temperatura al final del bioproceso (una técnica conocida como «cambio de temperatura» en biotecnología) para que el producto final se mantenga estable para su uso posterior.
Hay varias formas de utilizar un circuito de calentamiento y/o enfriamiento para regular la temperatura:
-
-
- Un bloque de calentamiento eléctrico con espiral de enfriamiento incorporada
- Una almohadilla de calentamiento de silicona envuelta alrededor del recipiente de cultivo después de la esterilización
- Una doble camisa en la que se hace circular agua. La temperatura se ajusta mediante un calentador eléctrico o vapor y una válvula solenoide para la entrada de agua de refrigeración
-
Medir y controlar el pH
Medir y controlar el pH es un aspecto muy importante en los bioprocesos, ya que los cambios en el pH pueden alterar significativamente las condiciones de crecimiento – generalmente con consecuencias importantes. Los medios de cultivo suelen incluir tampones, es decir, sustancias que mitigan los cambios demasiado bruscos del pH causados por la adición de un ácido o una base. Como el goteo de un ácido en el medio de cultivo puede dañar muchas líneas celulares, los científicos suelen enriquecer cuidadosamente la mezcla de gases utilizada en el cultivo celular con CO2 en lugar de añadir un ácido líquido. El gas se disuelve entonces en el medio de cultivo, permitiendo que el dióxido de carbono influya en el pH en combinación con un tampón.
Gamas de pH típicas según el organismo cultivado:
| Organismo | pH | ||||
| Bacterias, levaduras, hongos | 4.5 – 7,0 | ||||
| Células de mamíferos | 6.7 – 7,4 | ||||
| Células de insectos | 6,2 – 6,9 | ||||
| Células vegetales | 5.5 | ||||
Para medir el pH durante el bioproceso, cada biorreactor está equipado con un sensor de pH conocido como electrodo combinado para el pH. El biorreactor puede corregir cualquier desviación del pH; para ello, se dispone de una solución ácida y/o alcalina que se conecta al recipiente de cultivo mediante tubos y bombas. La concentración del ácido y de la base debe seleccionarse hábilmente para que esto funcione: si es demasiado alta, las gotas de ácido o base concentrados pueden dañar los microorganismos y los cultivos celulares antes de que se distribuyan en el biorreactor. Si, por el contrario, la concentración es demasiado baja, los operadores tendrán que añadir más ácido o base, diluyendo innecesariamente el medio de cultivo.
Añadir nutrientes
Durante un bioproceso, los microorganismos suelen consumir una amplia gama de nutrientes. La composición básica de un medio nutritivo suele consistir en agua, una fuente de energía utilizable por el organismo (por ejemplo, glucosa), así como los nutrientes que necesita (carbono, nitrógeno y fósforo), sales y oligoelementos. Dependiendo del organismo, son necesarios otros compuestos que no pueden ser sintetizados por uno mismo (vitaminas, aminoácidos esenciales, etc.).
Dependiendo de la estrategia del bioproceso, estos nutrientes se ponen a disposición al principio de un bioproceso (bioproceso por lotes) o se añaden a lo largo del tiempo, como en un lote alimentado o en un proceso continuo.
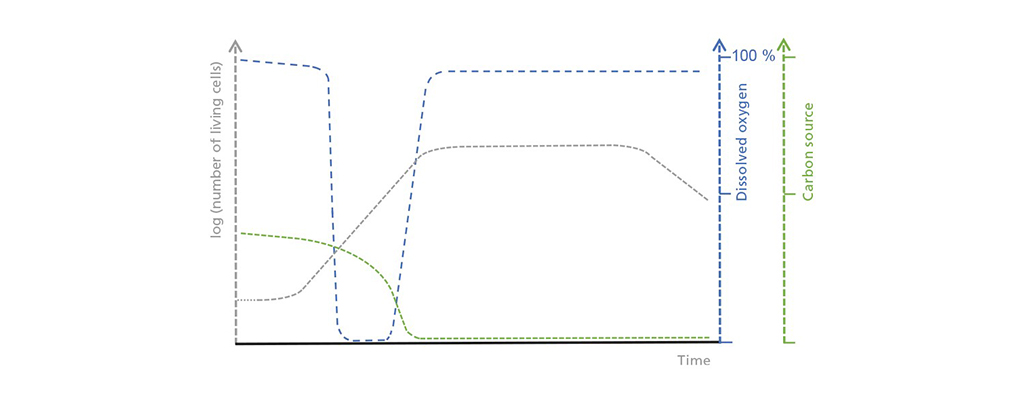
Ilustración esquemática de las correlaciones entre la concentración de células vivas, el oxígeno disuelto y la fuente de carbono limitante en el funcionamiento por lotes. En la fase inicial de retardo, el recuento de células vivas sólo aumenta lentamente, lo que conduce a una absorción moderada pero constante de la fuente de carbono. El consumo de oxígeno aumenta durante la fase de crecimiento exponencial hasta que supera el posible aporte de oxígeno. Una vez que la fuente de carbono se agota, comienza la fase estacionaria y le sigue una fase muerta, durante la cual el número de células vivas disminuye drásticamente.
Si quiere saber más sobre las diferentes estrategias de alimentación, eche un vistazo a nuestro blog-post: La diferencia entre los procesos por lotes, alimentados y continuos.
Gasificación
Durante el bioproceso, el biorreactor alimenta una mezcla de gas estéril como el aire en el medio de cultivo. La agitación constante no sólo distribuye los nutrientes, sino que también reduce el tamaño de las burbujas de gas que surgen en el recipiente de cultivo, liberando así eficazmente el oxígeno en la solución nutritiva. Esto es importante, porque los microorganismos y los cultivos celulares sólo pueden absorber el oxígeno que se ha disuelto en la solución nutritiva.
Las demandas de oxígeno varían: las bacterias aeróbicas necesitan oxígeno, mientras que otras prefieren mezclas de gases como el gas de síntesis («syngas»). Los organismos anaerobios, sin embargo, pueden prescindir por completo de la gasificación, alimentándose únicamente de sustancias inorgánicas y orgánicas del medio de cultivo, como el nitrato o el fumarato.
A diferencia de los microorganismos, los cultivos celulares se gasifican con algo más que aire: el contenido de oxígeno de la mezcla de gases también puede verse influido por nitrógeno puro y oxígeno puro. La composición exacta depende de la aplicación del cultivo celular. Para mantener constante la atmósfera de gas, el biorreactor necesita sistemas de control precisos.
Al principio del bioproceso, por ejemplo, un cultivo suele necesitar menos oxígeno -y, por tanto, una menor alimentación de gas-, ya que el crecimiento todavía progresa lentamente. Sin embargo, más adelante, un crecimiento más rápido requiere mucho más oxígeno. Además de garantizar un suministro constante del gas o la mezcla de gases deseados, el biorreactor también suministra la cantidad correcta de gas en el momento adecuado. Para ello, el biorreactor dispone de puertos de gas conectados al aire presurizado del edificio, a un compresor o a una bombona de gas.
La tasa de gaseo se suele medir en litros por minuto. Para disponer de un parámetro genérico aplicable a varios biorreactores, la tasa también se indica frecuentemente como tasa de gaseo específica, que se refiere a múltiplos del volumen de trabajo (volúmenes del recipiente por minuto, vvm) y se expresa como min-1. Un valor típico para los bioprocesos microbianos es de 1 a 1,5 veces el volumen de trabajo por minuto. Para un biorreactor con un volumen de trabajo de 4 L, la tasa máxima de gaseo sería, por tanto, de 4 L * 2 L-1 min-1 = 8 L min-1. En los cultivos celulares, por el contrario, la tasa máxima suele ser del 10% al 15% del volumen de trabajo por minuto como forma de mantener las burbujas de gas pequeñas y así evitar la formación de espuma y el daño a las células por la explosión de las burbujas.
Cambiar la tasa de gas, sin embargo, no es la única forma de controlar la eficiencia con la que el biorreactor suministra oxígeno y otros gases al medio de cultivo. Cuanto mayor sea la superficie del número total de todas las burbujas de gas en el biorreactor -es decir, cuanto más finamente distribuidas estén las propias burbujas de gas- más eficazmente se transferirá el oxígeno del gas a la fase líquida. Esto significa, por ejemplo, que el aumento de la velocidad de agitación puede mejorar la oxigenación para los microorganismos, ya que el agitador hace que las burbujas de gas sean aún más pequeñas y, por lo tanto, aumenta la superficie total de todas las burbujas de gas en el biorreactor.
La regulación precisa de la pO2 -y, por lo tanto, el control preciso de la tasa de gaseado y de la composición del gas- es muy importante, ya que, normalmente, la pO2 no debería ser el factor inhibidor del crecimiento del cultivo. Sin embargo, si no se controla lo suficiente, la pO2 se convierte en el factor limitante.
Dado que la alimentación de gas al biorreactor suele ser seca, la humedad del biorreactor puede recogerse en la corriente de salida durante la gasificación. A una tasa de gaseo elevada, no sólo bajaría el nivel de llenado, sino que la humedad también bloquearía el filtro de salida, impidiendo que se produzca una ventilación adecuada y permitiendo que se acumule la presión. Para evitar este efecto, los biorreactores están equipados con un refrigerador de escape eficiente en el que la humedad del escape se condensa y puede gotear de nuevo en el biorreactor antes de llegar al filtro de escape.
Medición y control de la presión
Cuanto mayor sea la presión en el recipiente, más oxígeno se disolverá. Los recipientes de cultivo fabricados en vidrio suelen estar homologados sólo para una presión de hasta 0,5 bares, que no es ni la mitad de la presión de un neumático de bicicleta medianamente lleno. A una presión de funcionamiento superior, los recipientes de cultivo de vidrio ligeramente dañados pueden reventar, lo que supone un riesgo para la seguridad. Por este motivo, debe garantizar siempre una línea de escape libre y sin presión del biorreactor manteniendo el filtro de escape seco y sustituyéndolo con regularidad; en el proceso, también estará garantizando la integridad del recipiente de cultivo, por supuesto. A diferencia de los recipientes de cultivo de vidrio, los biorreactores de acero inoxidable están diseñados para presiones más altas e, incluso en su configuración estándar, son adecuados para presiones de hasta 2 bares (un neumático de bicicleta bien lleno). Además, estos sistemas suelen estar equipados con un mecanismo de control de la presión basado en un sensor de presión en el biorreactor y una válvula proporcional en la línea de escape. No sólo pueden medir la presión en el biorreactor, sino que también pueden controlarla activamente.

Prevención de la formación de espuma
Fuera de las bañeras y los vasos de cerveza, la espuma es un efecto secundario bastante impopular, especialmente en los biorreactores. La espuma se forma en la interfaz entre la fase líquida y la gaseosa en el recipiente de cultivo y puede encontrar rápidamente su camino bajo la placa superior. En el peor de los casos, bloquea el filtro de escape, que a su vez bloquea el flujo de gas. Por ello, la mayoría de los biorreactores están equipados con un sistema para combatir la formación de espuma. Los antiespumantes mecánicos en el espacio de cabeza se reservan para biorreactores de acero inoxidable bastante grandes, mientras que los sistemas de control antiespumante basados en agentes químicos (como PPG, Struktol o antiespumantes a base de silicona) pueden encontrarse en biorreactores más pequeños.
Un sistema típico de control antiespumante consiste en un sensor instalado a una altura específica en el recipiente de cultivo. Si la altura de la espuma alcanza el sensor, se bombea un agente antiespumante desde un depósito al recipiente de cultivo. Estos agentes antiespumantes son activos en la interfaz líquido-gas y aumentan la tendencia de las burbujas de espuma a colapsar. En los casos especialmente difíciles en los que la espuma no se disuelve inmediatamente, se repite el procedimiento después de un tiempo preestablecido (una estrategia de «retardo de disparo &). Se recomienda tener cuidado al utilizar un agente antiespumante: si se dispensa incluso una cantidad ligeramente superior a la necesaria, puede quedar como una segunda piel en la superficie del líquido, lo que dificulta el intercambio de gases. Los agentes antiespumantes también contrarrestan la transferencia eficiente de oxígeno, porque el cambio en la tensión superficial promueve el colapso de las burbujas de gas en el biorreactor, reduciendo así la superficie disponible para el intercambio de gases. La selección del agente adecuado también depende del bioproceso en cuestión, ya que las bacterias y las células reaccionan de forma diferente a determinados productos químicos.
Bonus: las ventajas de utilizar un software SCADA
Hoy en día, los resultados generados en un biorreactor deben recogerse y evaluarse de la forma más centralizada posible, ya que es la única forma de aplicar eficazmente los modernos algoritmos de big data para generar más información y comprender mejor el funcionamiento de un proceso. Ese es el trabajo del software SCADA. En el primer paso, todos los datos del biorreactor pueden leerse -sin mayor intervención por parte del usuario- y almacenarse de forma centralizada para evaluarlos por sí mismos o compararlos con otros datos de lotes. De este modo, se pueden generar rápidamente ideas para nuevos experimentos e incluso estrategias de lotes complejas. Un software SCADA profesional permite planificarlos con facilidad y, a continuación, controlar el biorreactor, que idealmente será un proceso totalmente automatizado. Además, el software SCADA también integra varios componentes en el entorno del biorreactor. Entre ellos se encuentran herramientas para la optimización del proceso mediante la técnica de diseño de experimentos (DoE) o potentes sensores de software, que pueden utilizarse simultáneamente para calcular información adicional directamente a partir de los parámetros del proceso por lotes e incluso para regular dichos parámetros. Por ejemplo, el cociente respiratorio (RQ) puede utilizarse para obtener una estimación de la actividad metabólica mediante la relación entre el dióxido de carbono excretado y el oxígeno absorbido.
Son tantas las posibilidades -especialmente cuando el biorreactor y el software SCADA están perfectamente adaptados- que no podríamos describirlas todas. Si está interesado en saber más sobre todo lo que puede ofrecer un software SCADA moderno, eche un vistazo al software de la plataforma de bioprocesos eve®

.