08 ago 2019
Mencionen la ApoE y el alzhéimer, y la conversación gira en torno al alelo E4, el gen de mayor susceptibilidad a la enfermedad. Pero la ApoE tiene otra cara, en la ApoE2. Aunque esta isoforma protege contra la EA, los científicos apenas la han estudiado. Ahora la ApoE2 está atrayendo la atención de los científicos, que se preguntan cómo es posible que algunas personas mantengan su agudeza mental hasta una edad avanzada. En la Conferencia Internacional de la Asociación de Alzheimer, celebrada del 14 al 18 de julio en Los Ángeles, un estudio sobre los genotipos de ApoE en 5.000 casos de EA confirmados por autopsia reveló que las personas con dos copias de E2 ven caer su riesgo de demencia en un sorprendente 90 por ciento en comparación con las que tienen el genotipo común E3/E3. Otros trabajos sugieren que esto podría deberse a que la ApoE2 reduce la patología amiloide y tau, y aumenta el volumen de materia gris en regiones cerebrales críticas. Los beneficios de la E2 parecen ser específicos del Alzheimer, no genéricos de la neurodegeneración.
La ApoE es la principal proteína transportadora de colesterol en el cerebro. Se ha estudiado desde su descubrimiento como gen de riesgo de EA a principios de la década de 1990, pero está surgiendo recientemente como un centro de respuestas gliales a la deposición de agregados de amiloide y tau (noticias de agosto de 2018; noticias de septiembre de 2017). El gen existe como tres alelos polimórficos -E2, E3 y E4- con una frecuencia mundial del 8%, 78% y 14%, respectivamente. También se conocen varias formas mutadas, por ejemplo las denominadas mutaciones de Heidelberg, Pittsburgh y Christchurch (Feussner et al., 1992; Kamboh et al., 1999; Wardell et al., 1987).
ApoE4 es, con mucho, la que más atención recibe por parte de los investigadores de la EA, porque aumenta el riesgo de EA hasta 15 veces, dependiendo de la población estudiada, y se da en el 40 por ciento de las personas con EA. El E2, el alelo protector, ha recibido poca atención, porque es el menos común de los tres y está ausente en gran medida de las muestras de EA. Las personas con una copia de E2 tienen la mitad de probabilidades de desarrollar EA en comparación con las que tienen el genotipo más común E3/E3. Pero, ¿tiene el E2 adicional algún efecto más allá de eso? «No hemos sabido si la dosis de E2 tiene un riesgo diferencial, es decir, si el riesgo de E2/2 es significativamente menor que el de E2/3», dijo Eric Reiman al presentar el estudio.
Para averiguarlo, Reiman y sus colegas del Banner Alzheimer’s Institute, de Phoenix, Gyungah Jun, de la Universidad de Boston, Joseph Arboleda, del Massachusetts Eye and Ear, Yakeel Quiroz, del Hospital General de Massachusetts, y sus colegas del Consorcio de Genética de la EA decidieron analizar los datos de un montón de cerebros. Analizaron la contribución de los tres alelos ApoE al riesgo de demencia y a la patología en 5.007 cerebros del ADGC. Esta muestra incluía 4.018 casos de demencia de Alzheimer confirmados por autopsia, además de 989 donantes no afectados desde el punto de vista patológico y cognitivo. Además de proporcionar un número suficiente para estudiar a los homocigotos E2/E2, esta cohorte evita el problema de la confusión de los diagnósticos erróneos al eliminar las demencias que no se deben a la EA, así como a las personas que tenían patología de EA en el momento de la muerte pero no tenían demencia.
Como era de esperar, los homocigotos ApoE2 eran raros: sólo 24 de más de 5.000 personas, o el 0,5 por ciento. En comparación con otros genotipos, tenían muchas menos probabilidades de padecer EA. Los homocigotos E2 representaban el 0,1% de los casos, pero el 1,9% de los controles sanos. En cambio, los homocigotos ApoE4/4 representaban el 15,6 por ciento de los casos y sólo el 1 por ciento de los controles. En otras palabras, 19 de los 24 ApoE2/2 eran cognitivamente sanos, pero sólo 10 de los 633 ApoE4/4 lo eran.
Los homocigotos E2 tenían una reducción del riesgo del 66 por ciento en comparación incluso con los portadores de E2/3, una reducción del riesgo del 87 por ciento en comparación con el genotipo más común, E3/3, y una enorme reducción del riesgo del 99,6 por ciento en comparación con las personas que eran E4/4. Básicamente, la mayoría de las personas con E4/4 padecen demencia de Alzheimer, mientras que pocas con ApoE 2/2 lo hacen.
Tener dos alelos E2 se correlaciona con menos placa amiloide y patología de ovillos neurofibrilares tau. El efecto protector de ApoE2 sobre la patología de tau seguía siendo evidente incluso cuando se ajustaba por la carga de placa amiloide. Eso refleja datos recientes de animales que sugieren que la ApoE4 actúa para empeorar la patología de tau independientemente del amiloide (Shi et al., 2017).
El principal hallazgo del nuevo estudio se hace eco del de un estudio anterior realizado por Pieter-Jelle Visser, de la Universidad de Maastricht (Países Bajos), y sus colegas. Habían encontrado 16 portadores de ApoE2/2 en una muestra de 7.583 personas, de las cuales 10 eran cognitivamente normales y amiloides negativos, mientras que 301 de los 386 portadores de ApoE4/4 de la muestra tenían demencia de Alzheimer. Esta muestra, sin embargo, no fue confirmada por la patología (Jansen et al., 2015).
¿Qué importancia tiene la confirmación neuropatológica? Reiman et al. compararon las estimaciones de riesgo derivadas de la cohorte verificada por autopsia con las calculadas a partir de una cohorte de 23.857 personas vivas a las que se les había diagnosticado clínicamente una probable demencia por EA o que eran cognitivamente normales, y cuyo estado amiloide era desconocido. En ese análisis, tanto el efecto protector de 2/2 como el aumento del riesgo debido a 4/4 fueron subestimados. Por ejemplo, los científicos descubrieron que el odds ratio asociado a E4/E4 sobre E3/E3 en la muestra clínica era de 10,7, frente a 31,22 en los casos confirmados patológicamente. Los efectos de la dosis tanto para E2 como para E4 también se subestimaron en la muestra viva. Así, el análisis de la autopsia proporciona estimaciones de riesgo actualizadas, y probablemente más precisas, para todos los genotipos de ApoE, creen Reiman y sus colegas, al menos para estos participantes en la investigación de raza blanca no hispana.
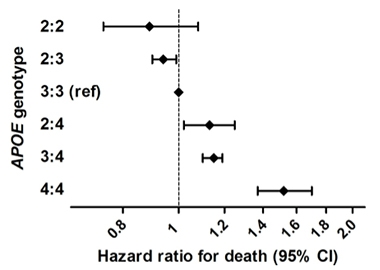
Extensión de la vida. En un amplio estudio epidemiológico que combinó seis cohortes poblacionales de personas con ascendencia europea, los homocigotos ApoE2 tenían un menor riesgo de morir que otros genotipos. Los homocigotos ApoE4 presentaban el mayor riesgo.
Se sabe que el impacto de la ApoE en el Alzheimer difiere entre grupos étnicos. Este tipo de estudio es necesario con sujetos más diversos, más homocigotos E2/2 y teniendo en cuenta los posibles efectos de los alelos ApoE en la supervivencia, que podrían sesgar los resultados. No obstante, Reiman dijo: «Nuestros resultados sugieren que la homocigosidad ApoE2 se asocia con un riesgo excepcionalmente bajo de EA, que el impacto de APOE y sus variantes en el riesgo de EA es significativamente mayor de lo que se apreciaba anteriormente, y que hay una razón de peso para descubrir tratamientos que promuevan este efecto protector».
Eso coincide con los resultados recientes de Sudha Seshadri, de la Universidad de Salud de Texas, San Antonio, Frank Wolters, del Centro Médico Erasmus, Rotterdam, Países Bajos, y sus colegas. Encontraron una ventaja de supervivencia para los portadores de ApoE2 en un estudio de 38.537 personas de seis cohortes basadas en la población (Wolters et al., 2019). Identificaron 239 homocigotos E2, que llevaron las vidas más largas. El efecto de E2 solo se explicaba en parte por sus efectos sobre los lípidos sanguíneos o la enfermedad vascular. Los homocigotos E4 tenían el mayor riesgo de muerte, y esto se explicaba en gran medida por su asociación con la demencia. Seshadri dijo a Alzforum que los investigadores analizarán la EA y los cambios cognitivos, así como las medidas de PET amiloide y tau en esta muestra.
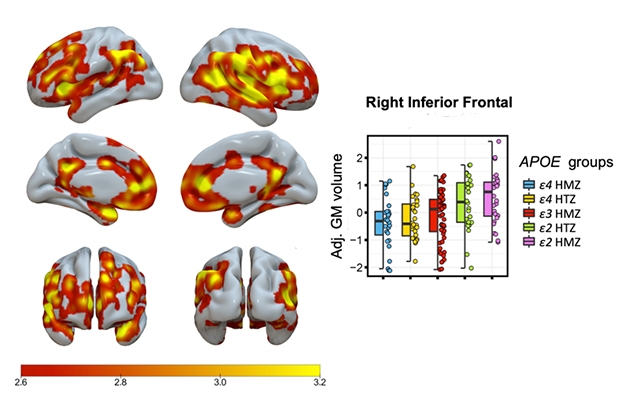
Bit by Bit. El sombreado indica las áreas con un aumento significativo relacionado con el genotipo ApoE en el volumen de la materia gris, siendo los homocigotos E4/4 los que tienen el volumen más bajo y los E2/2 el más alto. El gráfico muestra los datos de una región del cerebro.
¿Cómo podría la ApoE2 otorgar resiliencia? Para averiguarlo, Gemma Salvadó, del Centro de Investigación Cerebral de Barcelonaβeta (España), presentó un estudio en el que ella y sus coautores reunieron datos de imágenes de diferentes muestras de tantos homocigotos ApoE2 de edad avanzada como pudieron. Su objetivo era comparar la estructura cerebral de los E2/2 con la de otros genotipos de ApoE.
Previamente, la E2 se había relacionado con cambios sutiles en la morfología del cerebro en personas sanas, incluyendo una atrofia más lenta del hipocampo en la vejez, y hipocampos más grandes en la edad media (Chiang et al., 2010; Fennema-Notestine et al., 2011). En la infancia, se ha informado de que los portadores de E2 tienen cortezas entorrinales más gruesas que los homocigotos de E3 o los portadores de E4 (Shaw et al., 2007). Pero todos estos estudios se centraron en personas con una copia de E2.
Para averiguar lo que haría ese E2 extra, Salvadó recopiló y analizó los datos de la resonancia magnética de personas sin problemas cognitivos en el estudio ALFA en Barcelona (Molinuevo et al. 2016), la cohorte del Centro Médico de la Universidad de Ámsterdam, los estudios de imágenes de acceso abierto OASIS y ADNI. Encontró 28 homocigotos E2/E2. Emparejó a cada uno de ellos con otros cinco sujetos del mismo centro en función de la edad, el sexo y el nivel educativo, y uno de cada uno de los otros genotipos de ApoE. Eso dio un total de 168 sujetos, con una edad media de 62 años.
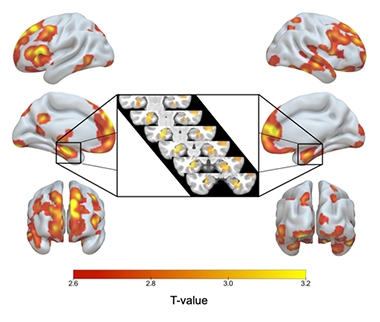
ApoE2/2 Sobre 3/3. El sombreado de rojo a amarillo indica las regiones del cerebro en las que los homocigotos ApoE2 tenían más materia gris que los homocigotos E3, incluyendo ambos hipocampos (recuadro).
En comparación con sus homólogos E3/3, los E2/2 tenían un mayor volumen de materia gris en sus hipocampos y otras áreas características de la EA, incluyendo el córtex temporal medial, el temporal inferior, el polo temporal, el precuneus y las regiones parietales superiores. Los homocigotos E2 también tenían más materia gris en áreas relacionadas con la resiliencia cognitiva en el envejecimiento, concretamente en el cíngulo anterior y las áreas prefrontales mediales (Arenaza-Urquijo et al., 2019; Harrison et al., 2018). En comparación con los heterocigotos E2/3, los homocigotos E2 presentaban pocas diferencias significativas en materia gris, pero tenían hipocampos aún más grandes que los 2/3.
Salvadó informó de un aumento escalonado, relacionado con el genotipo, del volumen de la materia gris, siendo los homocigotos E4/4 los que tenían el volumen más bajo, los E3/3 los intermedios, los E2/3 los más altos y los E2/2 los más altos (véase la imagen de abajo).

ApoE2/2 sobre 2/3. En comparación con el siguiente genotipo protector, ApoE2/3, los homocigotos E2 tienen más materia gris sólo en algunas áreas pequeñas.
Cree que la mayor cantidad de materia gris en zonas estratégicas del cerebro puede ayudar a los homocigotos E2 a hacer frente a la patología de la EA, si es que aparece. Dado que la ApoE2 aumenta la corteza entorrinal ya en la infancia, la capacidad de recuperación puede surgir de los procesos de desarrollo, dijo.
«Estos son hallazgos muy importantes», comentó Reiman. «Sugieren que si la atrofia es como la erosión de la banda de rodadura de los neumáticos, los homocigotos E2 pueden empezar con más banda de rodadura», dijo. Salvadó está tratando de ampliar el estudio para observar a más homocigotos de cohortes adicionales, y otros modos de imagen.
Terry Goldberg, de la Universidad de Columbia, Nueva York, ha estado estudiando los posibles mecanismos de neuroprotección mediada por ApoE2 durante años (Conejero-Goldberg et al., 2014). En la AAIC, Goldberg presentó resultados sobre la relación de los alelos de ApoE con la neuropatología en la EA, y amplió el análisis a otras enfermedades.
Utilizó datos de 1.557 cerebros de la base de datos del National Alzheimer’s Coordinating Center que contaban con evaluaciones clínicas y neuropatológicas. Como tenía tan pocos homocigotos E2, Goldberg agrupó los genotipos E2/E2 y E2/E3, para una muestra de 130. En ese grupo combinado, uno de cada cuatro cerebros presentaba cambios neuropáticos de la EA, en comparación con el 40% de los E3/3, el 65% de los E3/4 y el 85% de los E4/4. En consonancia con trabajos anteriores, los portadores de E2 tenían la patología amiloide más leve, el menor número de placas neuríticas y la patología tau más leve. Un análisis estadístico de mediación sugirió que la asociación de ApoE2 con la reducción de los ovillos pasaba en parte por su efecto sobre el amiloide, y era en parte independiente del amiloide. Esto concuerda con los resultados de Reiman.
En este conjunto de datos, también, la ApoE2 protegió fuertemente, incluso si Goldberg no analizó los homocigotos: E2 redujo el riesgo de patología amiloide y tau a la mitad en comparación con E3, y en un 90 por ciento en comparación con E4.
¿Qué es más potente, E2 o E4? Al comparar los genotipos E2/E4 y E3/E4, Goldberg encontró niveles comparables de patología. En todo caso, el emparejamiento E2/E4 era peor. Esto sugiere que el E4 supera los efectos protectores del E2. «Se podría decir que E4 es tóxico», concluyó Goldberg. Esto sugiere que las terapias que utilizan construcciones virales para introducir E2 en el tejido cerebral que expresa E4 pueden no ser útiles, dijo.
¿Qué pasa con otras enfermedades neurodegenerativas?
La literatura ofrece resultados mixtos sobre E2 y E4 en la demencia frontotemporal. Algunos estudios sugieren que la E2 promueve el riesgo (noticia de marzo de 2016) mientras que otros le atribuyen protección y culpan del riesgo a la E4 (Mishra et al., 2017). En la AAIC, Goldberg informó de que E2 se asoció con una patología más grave de TDP-43 entre 103 casos de demencia frontotemporal, y con más patología de tau en 28 casos de enfermedad de Pick y 51 casos de parálisis supranuclear progresiva. Advirtió que estos números son tan pequeños que los resultados podrían ser espurios. Goldberg no sabe si estos pacientes tenían mutaciones en C9ORF72 o progranulina, y la acumulación de TDP-43 puede estar asociada a la edad. En los casos de patología de la α-sinucleína, Goldberg descubrió que la ApoE4 promueve, y la E2 reduce, la propagación de la patología de los cuerpos de Lewy fuera de su origen en el mesencéfalo, hacia las áreas límbicas y neocorticales
En conjunto, estos estudios ponen de relieve una apreciación renovada del enorme impacto que ejerce la ApoE en la patogénesis de la EA (por ejemplo, véase Wu y Zhao, 2016). La profunda protección que ofrece la E2 probablemente reavivará el interés de los desarrolladores de fármacos, que ya lo han intentado antes y han fracasado, pero que quizá ahora consideren oportuno volver a examinar este objetivo.-Pat McCaffrey
Citaciones de noticias
- ApoE: ¿Culpable común de la microglía en el envejecimiento, el Alzheimer y la taupatía? 11 Ago 2018
- La ApoE4 empeora todo lo relacionado con la Tau, de principio a fin 20 Sep 2017
- ¿Et Tu, ApoE2? Un artículo afirma que el alelo aumenta el riesgo de demencia en la ELA 1 Mar 2016
Citaciones de artículos
- Feussner G, Funke H, Weng W, Assmann G, Lackner KJ, Ziegler R.Hiperlipoproteinemia grave de tipo III asociada a un fenotipo inusual de apolipoproteína E1 y a un genotipo épsilon 1/’null’. Eur J Clin Invest. 1992 Sep;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST.A novel mutation in the apolipoprotein E gene (APOE*4 Pittsburgh) is associated with the risk of late-onset Alzheimer’s disease. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoprotein E2-Christchurch (136 Arg—-Ser). Nueva variante de la apolipoproteína E humana en un paciente con hiperlipoproteinemia de tipo III. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.ApoE4 exacerba notablemente la neurodegeneración mediada por tau en un modelo de ratón de tauopatía. Nature. 2017 Sep 28;549(7673):523-527. Epub 2017 Sep 20 PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Prevalencia de la patología amiloide cerebral en personas sin demencia: un meta-análisis. JAMA. 2015 May 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE investigators.The impact of APOE genotype on survival: Results of 38,537 participants from six population-based cohorts (E2-CHARGE). PLoS One. 2019;14(7):e0219668. Epub 2019 Jul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .Índices de atrofia del hipocampo y biomarcadores del LCR en sujetos mayores APOE2 normales. Neurology. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.Presence of ApoE ε4 allele associated with thinner frontal cortex in middle age. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN.Cortical morphology in children and adolescents with different apolipoprotein E gene polymorphisms: an observational study. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.El proyecto ALFA: Una plataforma de investigación para identificar las características fisiopatológicas tempranas de la enfermedad de Alzheimer. Alzheimers Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3 PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P.The metabolic brain signature of cognitive resilience in the 80+: beyond Alzheimer pathologies. Brain. 2019 Abr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ.Morfología cerebral, cognición y β-amiloide en adultos mayores con rendimiento de memoria superior. Neurobiol Aging. 2018 Jul;67:162-170. Epub 2018 Mar 27 PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE.APOE2 mejora la neuroprotección contra la enfermedad de Alzheimer a través de múltiples mecanismos moleculares. Mol Psychiatry. 2014 Feb 4; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium.Gene-based association studies report genetic links for clinical subtypes of frontotemporal dementia. Brain. 2017 Abr 5; PubMed.
- Wu L, Zhao L.ApoE2 y la enfermedad de Alzheimer: es hora de echar un vistazo más de cerca. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
Lectura adicional
Sin lectura adicional disponible