Abstract
El objetivo de este estudio, centrado en un pequeño número de casos, es tratar el angiosarcoma de mama, que representa menos del 1% de todos los tumores de mama de partes blandas, y finalmente compartir nuestra experiencia. Como consecuencia de la terapia conservadora de la mama (TCP), que es el tratamiento estándar en la actualidad, se ha puesto de manifiesto un nuevo tipo de angiosarcoma: Angiosarcoma Inducido por Radiación (RIAS).
Aquí se reporta un análisis retrospectivo de los rasgos característicos de los pacientes con RIAS, junto con un relato del tratamiento integrado y el resultado de seis casos de RIAS tratados en nuestra institución desde 2013 hasta 2018.
El angiosarcoma de mama como consecuencia de la cirugía y la radioterapia se ha registrado raramente, pero es una complicación documentada del tratamiento con radiación para el cáncer de mama, con una alta tasa de recurrencia y malos resultados.
Sigue siendo un desafío clínico, radiológico e histológico, por lo que se requiere un alto índice de sospecha en pacientes susceptibles. La mastectomía simple es la principal opción de tratamiento, sin embargo, se está centrando un número creciente de estudios en el uso de la radioterapia y la quimioterapia, cada una con un grado variable de éxito. La reirradiación puede tenerse en cuenta para aumentar el control local, mientras que la quimioterapia puede considerarse para los casos en un estadio más avanzado.
Abordaje
RIAS: Angiosarcoma Inducido por Radiación; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: Resonancia magnética; IMRT: Radioterapia de intensidad modulada
Palabras clave
Angiosarcoma de mama (AS), Angiosarcoma inducido por radiación (RIAS), Mastectomía radical (RM), Tumores inducidos por radiación, Radioterapia adyuvante, Radioterapia de intensidad modulada (IMRT)
Introducción
En este trabajo se analiza el diagnóstico, el manejo y el resultado del RIAS en un pequeño número de pacientes con cáncer de mama.
Como tumor vascular muy raro, el angiosarcoma de mama (AS) puede dividirse en primario, si surge sin un precursor conocido, o secundario, si se produce en el lugar de la piel previamente irradiada, en cuyo caso se conoce como angiosarcoma inducido por radiación (RIAS) de la mama . Pero, todavía, no existen directrices basadas en la evidencia sobre el tratamiento ideal de los angiosarcomas.
En aquellas pacientes sometidas a cirugía conservadora de la mama con radioterapia adyuvante, la incidencia estimada de RIAS varía entre el 0,05 y el 0,3%, representando menos del 1% de los tumores de mama y aproximadamente un 3% de todos los sarcomas de tejidos blandos.
La incidencia de RIAS parece estar aumentando, tal vez como reflejo del largo período de latencia para el desarrollo de estos tumores tras la adopción generalizada de la radioterapia adyuvante para el cáncer de mama.
El diagnóstico de RIAS de la mama se retrasa a menudo debido a su aspecto benigno y a la dificultad para diferenciarlo de los cambios cutáneos inespecíficos inducidos por la radiación previa o de otra enfermedad . Los hallazgos radiológicos también suelen ser inespecíficos. Aunque el RIAS se desarrolla típicamente 10 años después de la radioterapia para el cáncer de mama, el período de latencia puede oscilar entre 6 meses y 20 años , lo que lleva a algunos autores a creer que probablemente se esté infradeclarando y que las verdaderas tasas de incidencia son, por tanto, más altas. A medida que aumenta la incidencia del cáncer de mama, el uso de la cirugía conservadora de la mama seguida de radioterapia ha ido sustituyendo a la mastectomía radical como tratamiento estándar. La incidencia asociada de RIAS también está aumentando, con una incidencia acumulada estimada de 0,9-3,2 por cada 1000 casos de cáncer de mama . En un amplio estudio de cohortes basado en la población, los antecedentes de radioterapia previa como tratamiento del cáncer de mama se asociaron con un aumento de 26 veces en el riesgo de desarrollar angiosarcoma en comparación con los grupos de control no irradiados . El pronóstico de los pacientes con RIAS sigue siendo malo, con tasas de supervivencia global a 5 años que oscilan entre el 27 y el 48%. A pesar de que el RIAS se describió por primera vez a principios de la década de 1920, su biología molecular sigue siendo controvertida y, por lo tanto, no hay ninguna terapia dirigida disponible.
Actualmente, la resección quirúrgica agresiva es comúnmente defendida como el tratamiento de elección. Faltan datos que demuestren la eficacia de la quimioterapia adyuvante .
La cirugía, en forma de escisión amplia o mastectomía, es el pilar del tratamiento en la enfermedad localizada. Algunos estudios han informado de una asociación entre los márgenes R0 y la mejora de la tasa de supervivencia, aunque no se ha demostrado que sea independiente de otros factores biológicos, como el tamaño del tumor . Hay algunas pruebas de que la quimioterapia neoadyuvante puede mejorar los resultados en el tratamiento del angiosarcoma, cuya rareza limita nuestro conocimiento a informes de casos o pequeñas series de casos retrospectivos .
Con el fin de caracterizar una población de pacientes con RIAS, tratadas en nuestro hospital durante un periodo de 5 años, hemos realizado un estudio retrospectivo analizando la utilidad de la mamografía, la ecografía y la resonancia magnética (RM) para nuestro diagnóstico .
Nuestro trabajo ha sido reportado de acuerdo con los criterios SCARE .
Materiales y Métodos
Nuestra serie de casos se refiere a pacientes con angiosarcoma de mama histológicamente probado, desarrollado después de la radioterapia para el cáncer de mama, entre 2013 y 2018, y analiza las estrategias de tratamiento con un enfoque multidisciplinario.
Los pacientes afectados, seis mujeres con angiosarcoma de mama inducido por la radiación, fueron identificados a través de una búsqueda exhaustiva en el período mencionado del registro de cáncer de nuestra institución, en el Hospital Universitario de Catania. La edad media fue de 70 años, con un rango de 59-79 años. Los pacientes habían realizado el manejo diagnóstico y terapéutico previo en varias instituciones, por lo que la información no está toda disponible. La descripción de las características de las pacientes y los procedimientos de tratamiento realizados tras el diagnóstico de RIAS se describen en la Tabla 1. Todas las pacientes habían sido sometidas a tratamiento conservador de la mama en el momento del diagnóstico, con radioterapia adyuvante administrada mediante radioterapia conformada tridimensional convencional a una dosis total de 50 Gy, con fraccionamiento diario de 2 Gy, con o sin refuerzo del lecho tumoral de 10 Gy. Los tumores eran del lado derecho en 3 pacientes y del lado izquierdo en los otros 3. Durante el tratamiento adyuvante, cinco de las seis pacientes recibieron quimioterapia sistémica basada en antraciclinas, de acuerdo con las directrices institucionales, mientras que todas las pacientes recibieron terapia hormonal adyuvante con tamoxifeno e inhibidores de la aromatasa. Ninguna paciente tenía cáncer HER2-positivo en el momento del diagnóstico.
Durante el seguimiento, tras una mediana de 7,6 años (rango: 5-11 años), se realizó el diagnóstico de angiosarcoma de mama ipsilateral: los signos más frecuentemente exhibidos por las pacientes al inicio fueron nódulos cutáneos de color rojo-violáceo, localizados en el contexto de los campos de irradiación, con una tasa de crecimiento moderadamente variable desde unas pocas semanas hasta 4-6 meses. Todas las pacientes recibieron una confirmación histológica de angiosarcoma secundario y se realizó una mastectomía radical en todos los casos. Para diagnosticar el RIAS se siguieron los criterios de Cahan y Arlen: sarcoma surgido dentro del campo previamente irradiado; un período de latencia de al menos 3 años entre la radioterapia y el desarrollo del sarcoma; y una distinción histológica entre el sarcoma secundario y la neoplasia primaria. A las seis pacientes se les realizó un estudio radiológico completo con mamografía, ecografía y RM (en 4/6 pacientes) para intentar confirmar la sospecha clínica de RIAS, pero no se identificaron características patognomónicas. El creciente interés de la literatura científica por identificar características específicas de la «firma de radiación» no ha producido aún datos consolidados. Tres de los seis pacientes destacados en nuestra serie de casos fueron objeto de un estudio inmunohistoquímico para la evaluación de la expresión de MYC, que había mostrado una alta expresión en dichos pacientes. La tabla 1 informa también de las características histológicas del tumor. La fecha del diagnóstico de RIAS se definió como el día en que se realizó el diagnóstico histológico. El periodo de latencia se definió como el tiempo transcurrido desde la primera sesión de radiación y la fecha del diagnóstico de RIAS. Sólo una paciente presentaba metástasis sincrónicas (en el pulmón) en el momento del diagnóstico de RIAS, mientras que otras cinco pacientes sólo presentaban enfermedad mamaria.
Tabla 1: Características de las pacientes y procedimientos de tratamiento. Ver Tabla 1
Todos los pacientes sometidos a cirugía en nuestro Hospital fueron discutidos en una reunión multidisciplinar de sarcomas en una fase preoperatoria. Los pacientes se clasificaron como con enfermedad resecable si la evaluación preoperatoria indicaba que se podía conseguir un margen negativo de 2 cm o más mediante cirugía con o sin reconstrucción quirúrgica plástica en forma de colgajo miocutáneo único pediculado o libre. Si los márgenes negativos deseados requerían una reconstrucción más amplia, como por ejemplo con un rejuvenecimiento extenso mediante un gran injerto de piel, el paciente se clasificaría como con enfermedad irresecable.
La enfermedad rápidamente progresiva, en la que el volumen de la enfermedad aumentaba en un lapso de tiempo de 2 a 3 semanas, pasando de ser adecuada para la mastectomía sola o en combinación con un colgajo pediculado a requerir una reconstrucción más extensa, también se consideraba irresecable en términos oncológicos.
Se realizaron biopsias preoperatorias para confirmar la presencia de AS y excluir otras enfermedades.
El cirujano que operaba consideraba que la resección era completa desde el punto de vista macroscópico. Histológicamente, la resección se clasificó como R0 (microscópicamente negativa) si los márgenes negativos eran de más de 1 cm circunferencialmente o R1 (microscópicamente positiva) si el tumor se extendía hasta o dentro de menos de 1 cm del margen de resección.
Cuatro pacientes fueron reclutados para la reirradiación inmediata, mientras que un paciente fue tratado después de 13 meses cuando se produjo una recaída parietal (había rechazado la reirradiación inmediata), el último paciente fue excluido de la reirradiación, ya que había alcanzado los límites de dosis para el corazón en el tratamiento anterior. La decisión sobre la administración de quimioterapia adyuvante se tomó caso por caso, basándose en los datos disponibles en relación con los tratamientos anteriores recibidos y el estado de rendimiento de los pacientes. Una paciente recibió cuatro ciclos de quimioterapia con epirubicina-ifosfamida, otra epirubicina sola durante seis ciclos, tres fueron excluidas por razones médicas (edad, comorbilidades o dosis de tolerancia de las antraciclinas ya alcanzadas previamente). Un paciente recibió paclitaxel semanal durante 12 ciclos por metástasis pulmonares sincrónicas.
La radioterapia se administró teniendo en cuenta las dosis recibidas de los tejidos sanos en la irradiación anterior y la administración previa de antraciclinas. Por estos motivos, se optó por realizar la reirradiación mediante radioterapia de intensidad modulada (IMRT, ver Figura 1), utilizando una técnica de step-and-shoot, según nuestros procedimientos institucionales . La dosis de radiación y el esquema de fraccionamiento que se utilizaron fueron variados: dos pacientes recibieron fraccionamiento convencional a 50 Gy, dos pacientes recibieron 40 Gy (porque el tiempo transcurrido desde la irradiación anterior era corto y la neoplasia estaba localizada en la mama izquierda), una paciente 35 Gy en fracción de 5 Gy una vez a la semana (debido a un menor cumplimiento clínico).
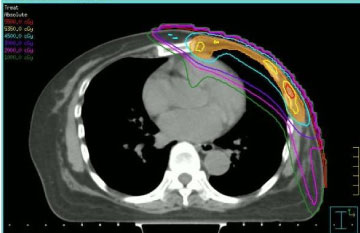 Figura 1: Imagen transversal de TC con distribución de dosis de intensidad modulada por pasos. Ver Figura 1
Figura 1: Imagen transversal de TC con distribución de dosis de intensidad modulada por pasos. Ver Figura 1
Resultados
No se registraron márgenes positivos en las pacientes que habían recibido mastectomía radical realizada por el mismo equipo quirúrgico.
Después de la mastectomía radical, las pacientes recibieron el tratamiento según lo previsto, sin ninguna interrupción, tanto para la quimioterapia como para la radioterapia. En una mediana de seguimiento de 22 años (rango: 1,5-4 años), tres pacientes están vivas, sin evidencia de recaída o enfermedad progresiva. Un paciente con metástasis pulmonares sincrónicas en el momento del diagnóstico sigue recibiendo tratamiento oncológico activo. Una paciente desarrolló metástasis pulmonares y óseas, pero sigue viva en el momento de presentar el trabajo. Los dos últimos pacientes desarrollaron metástasis pulmonares, una de ellas asociada a una recidiva local, y fallecieron al cabo de 8-10 meses (la distribución de las características de los pacientes en relación con la presentación de la enfermedad y el tratamiento recibido se describe en la Tabla 1). En general, la supervivencia libre de enfermedad fue de 14 meses para cinco pacientes sin enfermedad sistémica en el momento del diagnóstico de RIAS, mientras que la supervivencia libre de progresión para el paciente metastásico sincrónico en el momento del diagnóstico fue de 12 meses.
Como es de esperar, los resultados de supervivencia más pobres, reportados en la literatura, se notaron en pacientes que presentaban enfermedad localmente avanzada no apta para el manejo quirúrgico en comparación con los casos de nuestra serie. Estos factores ponen de manifiesto la importancia del diagnóstico precoz en los pacientes con RIAS. Los angiosarcomas suelen presentarse de forma insidiosa con cambios cutáneos de color púrpura o rojo y pueden confundirse fácilmente con hematomas o cambios cutáneos benignos, lo que provoca un retraso en la investigación y el diagnóstico. La detección precoz y la remisión rápida pueden reducir potencialmente el número de pacientes que presentan una enfermedad irresecable y mejorar el control de la enfermedad tanto local como a distancia.
Discusión
Los tumores inducidos por la radiación suelen surgir en el contexto o en el borde del campo de irradiación, donde la dosis no es uniforme y puede resultar inferior a la necesaria para inducir la destrucción celular, o causar mutaciones que pueden conducir al proceso de carcinogénesis. Como efecto de las radiaciones ionizantes, las modificaciones químicas y bioquímicas inducidas en los organismos vivos producen alteraciones funcionales y morfológicas de las células causando un daño biológico. Toda célula, capaz de replicarse, puede convertirse en potencialmente cancerosa; si las células que presentan modificaciones cromosómicas escapan a los controles celulares normales, puede producirse la carcinogénesis.
La probabilidad de desarrollar tumores en las pacientes sometidas a radioterapia para tratar el cáncer de mama es muy baja y no puede limitar el uso de la radioterapia cuando está indicada. Las dosis de radiación superiores a 50 Gy inducen la muerte celular y las dosis inferiores (
Numerosos estudios han sugerido la correlación entre la aparición de sarcomas de tejidos blandos y los tratamientos de radiación realizados para tratar los tumores de mama. La radioterapia aumenta el riesgo de desarrollar sarcomas de tejidos blandos y, en particular, de desarrollar angiosarcoma . El RIAS representa, aproximadamente, menos del 1% de los tumores de mama . El angiosarcoma radioinducido tiene muchas manifestaciones clínicas: Las pacientes suelen mostrar cambios cutáneos asintomáticos que apenas pueden distinguirse de las alteraciones actínicas comunes que pueden encontrarse tras el tratamiento de radioterapia en la mama. Las pacientes suelen mostrar una hinchazón palpable, una zona de color rojo púrpura similar a un hematoma. Los angiosarcomas pueden confundirse con manifestaciones benignas como los angiomas o la telangiectasia atípica. También pueden aparecer pápulas moradas o nódulos eritematosos.
A pesar de todos los esfuerzos terapéuticos, la tasa de supervivencia a cinco años varía del 27% al 62,8% (2-3). Aunque el RIAS se desarrolla típicamente 10 años después de los tratamientos de radiación para el cáncer de mama, el período de latencia puede variar de 6 meses a 20 años. El angiosarcoma radioinducido es indistinguible del angiosarcoma espontáneo, pero pueden evaluarse algunas diferencias: Lae, et al. compararon la amplificación de c-myc en el cromosoma 8q24.21 en 32 especímenes de RASB y 15 especímenes de angiosarcoma esporádico .
En nuestra serie, los pacientes presentaban signos inespecíficos de la enfermedad, pero el diagnóstico se realizó rápidamente en la mayoría de los casos. El periodo de latencia fue acorde con el descrito en la literatura, con una mediana de tiempo de 76 años.
Se sabe que el RAS tiene una alta tasa de recurrencia. La recurrencia local, ya sea en el lecho del tumor o a lo largo de la cicatriz quirúrgica, se detecta en la mayoría (96%) de los casos de RIAS. Esto se debe probablemente al crecimiento multifocal del RIAS o a los restos de tejido maligno tras la cirugía, incluso con márgenes quirúrgicos negativos. La enfermedad metastásica, más frecuentemente a los pulmones y al hígado, puede estar presente al mismo tiempo o poco después de las recidivas locales . Abbott, et al. revisaron retrospectivamente todos los casos de RIAS publicados hasta 2017 y resumieron los datos . Los autores encontraron que la tasa de recurrencia local fue del 59% y que la mediana de tiempo hasta la recurrencia fue de 6 meses (rango, 1-78 meses). También descubrieron que la enfermedad metastásica solía ir precedida de al menos una recidiva local y que las localizaciones más comunes eran los pulmones, la mama contralateral y el esqueleto. Además, su revisión histológica de 42 casos sugirió que el RIAS poco diferenciado se asociaba a un alto riesgo de metástasis, mientras que los tumores bien diferenciados presentaban un mayor riesgo de recidiva local más que de metástasis a distancia.
El sarcoma inducido por radiación es una neoplasia rara pero muy agresiva. Su manejo es objeto de debate, ya que no se dispone de directrices de tratamiento, el pronóstico es malo y la tasa de supervivencia a los 5 años varía ampliamente, como se informó anteriormente . No obstante, la resección quirúrgica agresiva se suele defender como tratamiento de elección.
La cirugía, en forma de mastectomía con o sin reconstrucción plástica, es el tratamiento de elección en las pacientes que presentan enfermedad localizada. En las series de pacientes en tratamiento, es posible conseguir márgenes de resección microscópicamente completos (R0) en más del 80%. Los RIAS se presentan típicamente como lesiones multifocales. La tendencia de esta patología a crear depósitos de microsatélites puede contribuir a la dificultad de obtener un control local.
La importancia de realizar una resección patológica completa ha sido destacada en la literatura, aunque no se han publicado directrices estándar respecto a la distancia recomendada de eliminación. En la serie actual, se encontró que los que desarrollaron recurrencia local tenían márgenes más cercanos que los que no lo hicieron. Sin embargo, el estado de los márgenes no resultó ser un pronóstico independiente de los resultados oncológicos en esta serie. Esto sugeriría que la capacidad de conseguir mayores márgenes depende de otros factores biológicos del tumor que también determinan el resultado, como el tamaño. Es probable que la biología del tumor sea la principal responsable del resultado en el RIAS, aunque la cirugía inicial debe tener como objetivo la eliminación macroscópica, hay que advertir que lograr mayores márgenes negativos no equivale necesariamente a una mejora de los resultados de los pacientes.
A pesar del creciente número de estudios centrados en la quimioterapia y la radioterapia, ya sea neoadyuvante o adyuvante, su papel sigue sin estar claro. Aunque no hay datos que demuestren la eficacia de la quimioterapia adyuvante, datos recientes han sugerido que la radioterapia puede ser útil para prevenir las recidivas. La radioterapia adyuvante después de la cirugía, según Johnstone et al. permite un mejor control local . El papel de la IMRT en el tratamiento de la pared torácica se está evaluando actualmente, ya que puede reducir la tasa de incidencia de la toxicidad de la radiación al disminuir la irradiación de los órganos en riesgo (OAR). En un estudio de comparación dosimétrica, los autores informan que el plan de IMRT a la pared torácica y el objetivo, en comparación con los tratamientos convencionales, permite reducir la dosis máxima, aumentar la dosis mínima, lo que resulta en una mejor conformidad y uniformidad del volumen objetivo .
El papel y la eficacia de la quimioterapia no se ha establecido ya que el conjunto de datos disponibles proviene de grupos de muestras de pequeño tamaño, de los que no se pueden extraer conclusiones definitivas, pero probablemente los pacientes con mayor grado de malignidad, G3 y con recidiva, podrían beneficiarse más de la quimioterapia neo o adyuvante .
El uso de quimioterapia neo/adyuvante también se asoció a un mejor control local de la enfermedad en una gran serie retrospectiva de pacientes con sarcomas inducidos por la radiación de todas las localizaciones, aunque no se asoció a una mejora de las tasas de recaída sistémica o de supervivencia . No se encontró que la quimioterapia adyuvante produjera un beneficio en términos de control local o estudio de supervivencia global de los sarcomas de tejidos blandos de alto riesgo tratados con cirugía y radiación . Por lo tanto, hay pocas pruebas que sugieran que la quimioterapia neo/adyuvante produzca un beneficio de supervivencia en los RIAS, aunque ciertamente puede ser útil como terapia de inducción antes de la cirugía en aquellos que presentan una enfermedad localmente avanzada y puede ofrecer a los pacientes una paliación eficaz de la enfermedad. Las terapias dirigidas pueden ofrecer un tratamiento alternativo en pacientes con enfermedad progresiva.
En nuestra serie, como consecuencia de la alta tendencia a la recidiva local de esta neoplasia, hemos decidido proponer a todos los pacientes una segunda irradiación, excepto a uno de ellos por los problemas dosimétricos mencionados. Un paciente se negó a la reirradiación inmediata y el tratamiento se llevó a cabo en el momento de la recidiva. No fue posible programar un tratamiento radiante homogéneo para todos los pacientes, debido a la heterogeneidad de la muestra para las dosis de irradiación utilizadas previamente, al escaso cumplimiento clínico en un caso y, sobre todo, a la falta de indicaciones claras de la literatura y las guías. En cualquier caso, decidimos administrar el tratamiento mediante una técnica de intensidad modulada, para permitir una adecuada distribución de la dosis, una reducción de la exposición a la dosis de los tejidos sanos circundantes, especialmente para el parénquima pulmonar subyacente y el corazón.
Conclusiones
La radioterapia en el tratamiento del cáncer de mama se asocia con un mayor riesgo de sarcoma posterior, pero el porcentaje de riesgo es muy bajo.
La RAS es una lesión de tejidos blandos rara y agresiva, con opciones de tratamiento limitadas y altas tasas de recaída tanto local como sistémica.
Se requiere una observación cuidadosa después de la radioterapia adyuvante. El tratamiento estándar incluye la cirugía con mastectomía simple y la radioterapia adyuvante. La quimioterapia puede tener un papel en la reducción de la enfermedad localmente avanzada, aunque no tiene un efecto demostrado sobre la supervivencia.
El angiosarcoma es significativamente más frecuente en los casos tratados con radioterapia, ocurriendo especialmente en el campo de radiación o adyacente al mismo. La pequeña diferencia en el riesgo de sarcoma posterior para las pacientes con cáncer de mama que reciben radioterapia no sustituye el beneficio de la radioterapia.
Sin embargo, nuestra serie es demasiado pequeña para sacar conclusiones definitivas y esto es una limitación del estudio. Es necesario realizar más evaluaciones, también a través de un mayor número de casos, para tener una mejor clasificación de la patología y permitir un manejo multidisciplinar más preciso.
Conflictos de intereses
Ninguno de los Autores tiene conflictos de intereses que revelar.
Fuentes de financiación
Ninguna.
Aprobación ética
El comité de ética de la Universidad de Catania ha dado su aprobación.
Consentimiento informado
Se obtuvo el consentimiento informado por escrito de la paciente para la publicación de este informe de caso y las imágenes que lo acompañan. Una copia del consentimiento escrito está disponible para ser revisada por el Editor Jefe de esta revista a petición.
Contribuciones de los autores
Trovato Agata: Revisión y edición del artículo.
Registro de estudios de investigación
Ninguna.
Divulgación
Ninguno de los autores tiene nada que divulgar.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Angiosarcoma primario y secundario de la mama. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Resultados a largo plazo en pacientes con angiosarcomas de mama asociados a la radiación después de la cirugía y la radioterapia para el cáncer de mama. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Sarcomas inducidos por la radiación después de la radioterapia para el carcinoma de mama: una revisión a gran escala de una sola institución. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Angiosarcoma cutáneo de mama asociado a la radiación: mal pronóstico en una rara neoplasia secundaria. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Manejo clínico del angiosarcoma secundario después de la terapia de conservación de la mama. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Sarcoma de mama inducido por radiación: una revisión sistemática. Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Mayor riesgo de sarcoma de tejidos blandos tras la radioterapia en mujeres con carcinoma de mama. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Angiosarcoma asociado a la radiación después del cáncer de mama: alta tasa de recurrencia y mala supervivencia a pesar del tratamiento quirúrgico con resección R0. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Manejo quirúrgico del angiosarcoma inducido por la radiación después de la terapia de conservación de la mama. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Angiosarcomas localizados: la identificación de factores pronósticos y el análisis del impacto del tratamiento. Un análisis retrospectivo del Grupo Francés de Sarcoma (GSF/GETO) Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Talidomida combinada con quimioterapia neoadyuvante en angiosarcoma de mama con respuesta patológica completa: informe de un caso y revisión de la literatura. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Quimioterapia neoadyuvante para el angiosarcoma primario cutáneo/de tejidos blandos: determinación del comportamiento del tumor antes de la resección quirúrgica. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Metástasis en los ganglios linfáticos contralaterales en una mujer con cáncer de mama primario nuevo: ¿Enfermedad sistémica o difusión locorregional? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) La Declaración SCARE: Directrices de informes de casos quirúrgicos basados en el consenso. Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Sarcomas secundarios después de la radioterapia para el cáncer de mama: riesgo sostenido y mala supervivencia. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) ¿Puede la amplificación de c-myc discriminar de forma fiable el postradiación del angiosarcoma primario de mama? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiosarcoma de la mama después de la cirugía y la radioterapia para el cáncer de mama. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarcoma después de la terapia de conservación de la mama. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Evaluación dosimétrica del tratamiento integrado de IMRT de la pared torácica y la región supraclavicular para el cáncer de mama después de la mastectomía radical modificada. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Quimioterapia adyuvante con doxorrubicina, ifosfamida y lenograstim para el sarcoma de tejidos blandos resecado (EORTC 62931): un ensayo controlado aleatorio multicéntrico. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Los casos de tuberculosis mamaria aumentan en Sicilia. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Papel, momento y técnica de la radioterapia en el sarcoma sinovial pleuropulmonar pediátrico. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Radioterapia de intensidad modulada para el mesotelioma pleural maligno en recaída. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Experiencia de una sola institución de radioterapia de intensidad modulada para el mesotelioma pleural maligno en la Universidad de Catania. Future Oncol 14: 17-21.
Citación
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) Una experiencia de estudio de una sola institución de angiosarcoma de mama secundario después del tratamiento de conservación de la mama: Manejo multidisciplinario. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114