Oksalaatti-ionin Lewis-rakenne piirretään tässä ohjeessa vaihe vaiheelta. C2O42-:n Lewis-rakenteen piirtämiseen käytetään kokonaisvalenssielektronien käsitettä. Kun C2O42-:n Lewis-rakenne on saatu valmiiksi, pitäisi olla -2-varaus ja stabiilisuus. Näistä asioista opit tässä opetusohjelmassa.
Oksalaatti-ioni | C2O42-
Karbonaatti-ionilla on -2 varaus. Oksalaatti-ionissa on kaksi hiiliatomia.
C2O42- Lewis-rakenne
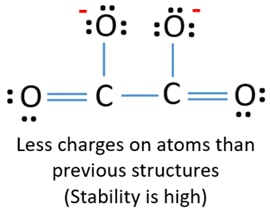
Kaksi hiiliatomia on yhdistetty yhteen hiiliatomiin. Samoin kaksi muuta happiatomia on liitetty toiseen hiiliatomiin. C2O42-ionin Lewis-rakenteessa ioni on symmetrinen C-C-sidoksen ympärillä.
C2O42-ionin Lewis-rakenteen piirtämisen vaiheet
C2O42-ionin Lewis-rakenteen piirtämiseen tarvitaan seuraavat vaiheet, ja ne selitetään yksityiskohtaisesti tässä opetusohjelmassa.
- Erittele hiili- ja happiatomien valanssikuorien elektronien kokonaislukumäärä. Tätä käytetään määrittämään sidosten, yksinäisten parien määrä atomien ympärillä.
- Kokonaiselektroniparit atomien ympärillä
- Keskeisen atomin valinta maksimaalisen valenssin mukaan
- Asetetaan yksinäiset parit atomeihin
- Tarkistetaan stabiilisuus ja minimoidaan atomien varaukset, jotta saadaan rakennettua stabiilein rakenne muuttamalla yksinäiset parit sidoksiksi.
Näiden vaiheiden tapaan seuraavat faktat ovat tärkeitä Lewis rakenteen piirtämisessä.
Hapen tulisi pitää negatiivisia varauksia Lewisin rakenteessa, koska happi pitää mielellään elektroneja kuin hiiliatomi.
Hapen elektronegatiivisuus on suurempi kuin hiilen.
Oikean Lewis-rakenteen piirtäminen on tärkeää, jotta CO32-:n resonanssirakenteet voidaan piirtää oikein.
C2O42-:n valanssikuorien elektronien kokonaislukumäärä
Hiili sijaitsee jaksollisen järjestelmän ryhmässä 4. Hiilellä on siis neljä elektronia valenssikuoressaan. Happi sijaitsee ryhmässä 6. Sillä on kuusi elektronia valenssikuoressa.
- Hiiliatomin antamien valenssielektronien kokonaismäärä = 4 * 2 = 8
C2O42- ionissa on neljä happiatomia, Näin ollen
- Happiatomien antamien valenssielektronien kokonaismäärä = 6 *4 = 24
C2O42- ionissa on -2 varaus. C2O42-ionin tapauksessa elektronipareja on yhteensä 17.
C2O42-ionin keskusatomi
Keskusatomina toimimiseksi on tärkeää, että sillä on suurempi valanssi. Hiilellä on paremmat mahdollisuudet olla keskusatomi (Katso kuva), koska hiilen valenssi voi olla 4. Hapen korkein valenssi on 2. Nyt voimme siis rakentaa luonnoksen C2O42- ionista.
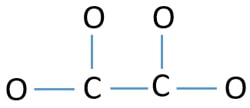
Yksittäiset atomiparit
- Ylläolevassa luonnoksessa on neljä C-O-sidosta ja yksi C-C-sidos, mikä tekee viisi sidosta. Näin ollen jäljellä on vain kaksitoista (17-5 = 12) valenssielektroniparia.
- Merkitään ensin nuo kaksitoista valenssielektroniparia yksinäisiksi pareiksi ulkopuolisten atomien (happiatomien) päälle. Yksi happiatomi ottaa kolme yksinäistä elektroniparia kahdeksikkosäännön mukaisesti (happiatomi ei voi pitää valenssikuoressaan enempää kuin kahdeksan elektronia).
- Neljälle happiatomille on käytetty kaksitoista elektroniparia. Nyt ei ole enää yksinäisiä pareja merkitsemättä hiiliatomeihin sen jälkeen, kun happiatomeihin (atomien ulkopuolelle) on merkitty yksinäiset parit.
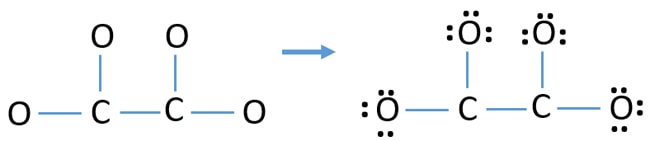
Atomien varaukset
Atomien elektroniparien merkitsemisen jälkeen (tässä tapauksessa vain happiatomeihin), meidän pitäisi merkitä kunkin atomin varaukset, jos niillä on varaus. Varausten merkitsemisellä on merkitystä, koska sen avulla määritetään ionin paras Lewis-rakenne. Kun olet merkinnyt varaukset, huomaat, että jokainen happiatomi saa -1 varauksen ja molemmat hiiliatomit saavat +1 varauksen.
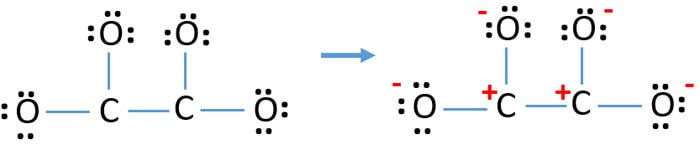
Tämä rakenne on hyvin epästabiili, koska ionissa on varauksia kaikkialla.
Tarkista stabiilisuus ja minimoi atomien varaukset muuttamalla yksinäiset parit sidoksiksi
- Happiatomeilla pitäisi olla negatiiviset varaukset, koska happiatomin elektronegatiivisuus on suurempi kuin hiiliatomin. Muuten voidaan sanoa, että happiatomien kyky pitää negatiivisia varauksia on suurempi kuin hiiliatomien.
- Piirretty rakenne ei ole stabiili, koska kaikilla atomeilla on varaus (Lewisin rakenteen pitäisi olla stabiili, jossa on vähemmän varauksia).
- Nyt meidän pitäisi yrittää minimoida varaukset muuttamalla yksinäinen pari tai parit sidoksiksi. Muunnetaan siis yhden happiatomin yksi yksinäinen pari C-O-sidokseksi.
- Nyt yhden hiiliatomin ja yhden happiatomin välillä on kaksoissidos (yksi C=O-sidos). Nyt hiiliatomin ja kolmen muun happiatomin välillä on kolme yksinkertaista sidosta (kaksi C-O-sidosta).
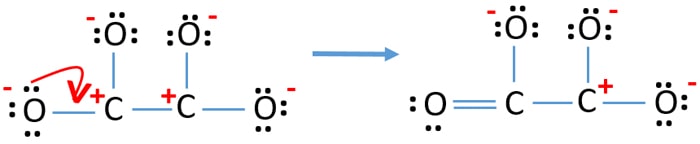
Uudessa rakenteessa atomien varaukset ovat pienemmät kuin edellisessä rakenteessa. Nyt yhdellä happiatomilla ja yhdellä hiiliatomilla ei ole varausta. Mutta kolmella happiatomilla (joilla on -1 negatiivinen varaus) ja toisella hiiliatomilla on edelleen varaus. Nyt ymmärrät, että tämä C2O42- rakenne on vakaampi kuin edellinen rakenne. Yritämme kuitenkin vähentää varauksia niin paljon kuin mahdollista.
Vähentää varauksia edelleen
Voit muuntaa toisen happiatomin yksinäisen parin C-O-sidokseksi kuten alla.
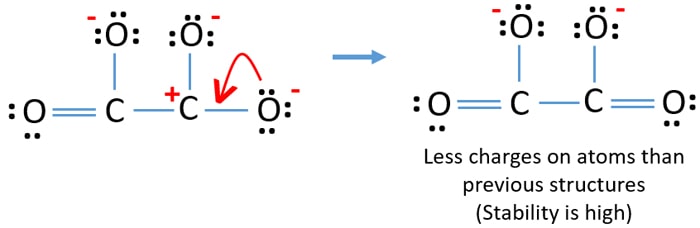
C2O42- (karbonaatti)ionin Lewis-rakenne
Kysymyksiä
Kysy kemian kysymyksesi ja löydä vastaukset
Seuraavat opetusohjelmat
.