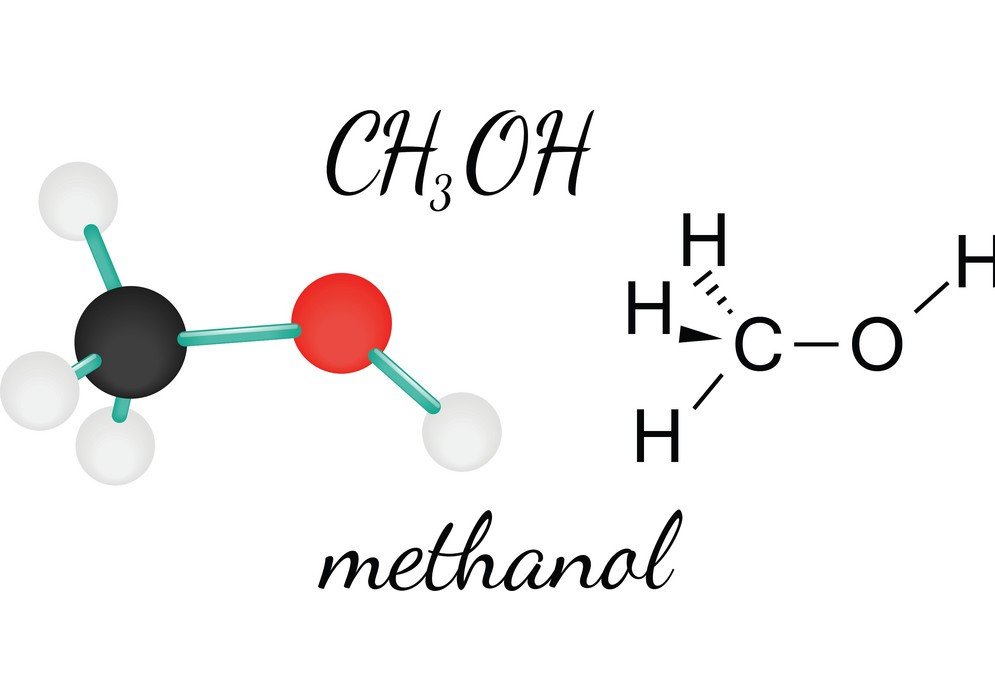
CH3OH eli metanoli on syttyvä, väritön ja haihtuva neste, jolla on tunnusomainen alkoholin haju. Metanolia tutkimalla voi saada selville molekyylin muodon, sidoskulman ja polaarisuuden. CH3OH:n poolisuus on yksi tärkeimmistä ominaisuuksista, sillä se auttaa tuntemaan yhdisteen muut ominaisuudet, kuten liukoisuuden, sähkövaraukset ja paljon muuta. Ymmärtääksemme metanolin poolisuuden, tarkastellaan ensin sidoskulmia ja atomien sijoittelua CH3OH-molekyylissä.

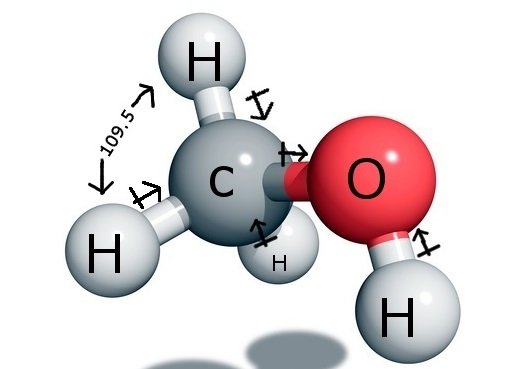
CH3OH Sidekulmat
Keskeinen hiiliatomi muodostaa yhdisteessä neljä sidosta, kolme vetyatomin kanssa ja yhden hydroksyyli ( OH) ryhmän kanssa. Ja koska tällä hiiliatomilla on sp3-hybridisaatio ja se muodostaa tetraedrin muodon, sen sidoskulmat sidosatomiensa kanssa ovat 109,5 astetta.
Happi sen sijaan muodostaa yhden sigmasidoksen, mutta sillä on kaksi yksinäistä paria, joten sen sidoskulma taipuu sidosparin ja yksinäisen parin repulsiovoimien vuoksi. Tämä pienentää sidoskulman 104,5 asteeseen.
Hiilellä on siis 109,5 asteen sidoskulma kaikkien kolmen vetyatomin kanssa ja 104,5 asteen sidoskulma hydroksyyliryhmän kanssa.
Onko CH3OH polaarinen?
Kaikkien yhdisteiden polaarisuus määräytyy yhdisteen nettomääräisen dipolimomentin mukaan. Tämä nettodipolimomentti voidaan tietää huomioimalla molekyylin atomien sähkövaraukset. Tässä tapauksessa sekä hiili- että happiatomit ( joita pidetään tämän yhdisteen geometrisina keskuksina) metanolissa ovat elektronegatiivisia atomeja. Happi on kuitenkin elektronegatiivisempi kuin yhdisteen hiili tai vety.
CH3OH ei voi olla pooliton, koska metanolimolekyylin atomien sähkövarauksissa on eroja. Hapella on enemmän elektronitiheyttä sen kahden yksinäisen elektroniparin vuoksi. Tämä aiheuttaa nettodipolin, joka osoittaa kohti happiatomia, mikä tekee CH3OH:sta poolisen.
Sähkövarausten lisäksi CH3OH-molekyyli on epäsymmetrinen, mikä kumoaa epäpolaarisuuden mahdollisuuden. Epäpolaarisella molekyylillä on symmetrinen rakenne, koska dipoli-dipolimomentti kumoutuu. Mutta koska metanolin muoto on mutkainen, se johtaa epäsymmetrisen rakenteen muodostumiseen, jolloin sähköisen dipolimomentin negatiivinen pää kääntyy kohti happiatomia. Näin ollen CH3OH on polaarinen molekyyli.
Nyt kun tiedämme CH3OH-molekyylin poolisuuden, käydään läpi joitakin sen fysikaalisia ominaisuuksia:
- Metanolin ( CH3OH) kiehumispiste on 64,7 °C.
- Metanolin sulamispiste on -97,6 °C.
- Metanolin molekyylipaino on 32,04 g/mol.
- Metanoli on polaarinen liuotin ja se tunnetaan myös nimellä puualkoholi, koska sitä valmistettiin aikoinaan tislaamalla puuta.
- Tämän yhdisteen tuoksu on etanoliin verrattuna makeamman puolella.
CH3OH:n käyttötarkoitukset
- Metanolia käytetään myös hiilivetyjen valmistukseen ja muiden kemikaalien, kuten formaldehydin, synteesiin.
- Sitä käytetään jäätymisenestoaineena putkissa.
- CH3OH:ta käytetään myös bensiinin lisäaineena useissa maissa sen alhaisen sulamispisteen vuoksi.
- Yhdistettä käytetään myös polttoaineena polttomoottoreissa.
- Monet monet lääkeyritykset käyttävät puhdasta metanolia muiden yhdisteiden synteesiin.
Toivottavasti tämä artikkeli auttaa sinua ymmärtämään molekyylin polaarisuutta ja sen fysikaalisia ominaisuuksia ja käyttötarkoituksia. CH3OH on polaarinen molekyyli, koska dipoli-dipolimomentti ei kumoudu sen epäsymmetrisen muodon vuoksi.