Introduction
Charophytes or basal Streptophytes; (Becker ja Marin, 2009; Leliaert et al., 2012) muodostavat monipuolisen taksonomisen valikoiman eläviä makean veden ja maanpäällisiä viherleviä, joilla on laaja valikoima yksisoluisia, säikeisiä ja ”parenkymaattisia” muotoja (Graham, 1993; Lewis ja McCourt, 2004). Karofyyttien esi-isälinja ilmestyi maalle ja asutti sen 450-500 miljoonaa vuotta sitten. Nämä organismit sopeutuivat maanpäällisiin olosuhteisiin, kykenivät selviytymään ja lisääntymään, kun ne olivat täysin alttiina ilmakehälle, ja jotkut jäsenet kehittyivät lopulta maakasveiksi (Zhong ym., 2013; Delwiche ja Cooper, 2015). Tämä viherkasvien ”terrestrialisaatio” edusti keskeistä biologista tapahtumaa, joka muutti ikuisesti planeetan biogeokemiaa ja luonnonhistoriaa. Maakasvien myöhempi yleistyminen muutti ilmakehän ja edelleen maaperän olosuhteita ja mahdollisti muiden monimuotoisten elämänmuotojen ilmaantumisen maalle. Maakasvien evoluutio muutti myös ihmiskunnan historiaa merkittävimmin maatalouden innovaation ja siitä seuranneen nykyaikaisen sivilisaation luomisen kautta. Osittain evolutiivisen merkityksensä vuoksi karofyytit ovat saaneet viime vuosikymmeninä merkittävää huomiota kasvibiologien keskuudessa (Pickett-Heaps ja Marchant, 1972; Pickett-Heaps, 1975; Mattox ja Stewart, 1984; Becker ja Marin, 2009; Harholt et al., 2016). Kun näiden levien biologiasta on kuitenkin saatu lisää uutta tietoa, niistä on tullut tärkeitä malleja biokemian, solubiologian, kehitysbiologian, ekologian ja yhä useammin myös molekyylibiologian perusilmiöiden ymmärtämisessä (Delwiche ja Cooper, 2015; Lemieux ym., 2016). Frontiers in Plant Science -sarja ”Charophytes” havainnollistaa näiden organismien merkitystä useilla kasvibiologisen tutkimuksen erityisalueilla. Tässä minikatsauksessa korostetaan karofyyttien ominaisuuksia malliorganismeina eri tutkimusaloilla. Se myös toivottavasti rohkaisee uutta tutkijasukupolvea laajentamaan näiden levien käyttöä perustutkimuksessa ja aloittamaan muiden taksonien seulonnan, joka puolestaan voi johtaa uusien mallicharofyyttien tunnistamiseen ja käyttöön.
Carofyyttien ”rivistö”
702>1970- ja 1980-luvuilla ultrastrukturaalisia (esim, solunjakautumismekanismi, lippulaitteen perusrakenne) ja biokemialliset (esim. entsyymiprofiilit) tiedot olivat tärkeimmät kriteerit viherlevän sisällyttämiselle karofyyttien sukulinjaan (Mattox ja Stewart, 1984; Lewis ja McCourt, 2004; Leliaert ym., 2012). Kloroplasti- ja ydingenomien ja transkriptomien molekyylianalyyseihin keskittyneet tutkimukset 1990-luvulta tähän päivään ovat vahvistaneet ja tarkentaneet aiempia taksonomisia ja fylogeneettisiä järjestelmiä (Timme ym., 2012; Delwiche ja Cooper, 2015). Tätä on lisäksi täydennetty yksityiskohtaisilla biokemiallisilla, immunologisilla ja solubiologiaan perustuvilla analyyseillä karofyyttien soluseinistä ja hormonien biosynteettisistä ja signalointireiteistä (Popper ja Fry, 2003; Popper, 2008; Sørensen ym., 2010, 2011, 2012; Zhang ja van Duijn, 2014; Ju ym., 2015; O’Rourke ym., 2015). Nykyisten karofyyttien monimuotoisuusprosentti on suhteellisen alhainen verrattuna muihin viherlevätaksoneihin, ja ne käsittävät 13 sukua ja 122 sukua (Becker ja Marin, 2009; Leliaert et al., 2012). Nykyiset fylogeneettiset näkemykset sijoittavat karofyytit kuuteen luokkaan (kuva 1; Delwiche ja Cooper, 2015). Perusluokkaa, Mesostigmatophyceae, edustaa yksi tunnettu suku, Mesostigma. Tämä levä on yksisoluinen biflagellaatti, jolla on ainutlaatuinen epäsymmetrinen muoto (eli kuin litistynyt pelastusvene), ja sitä peittävät kerrokset koristeellisesti muotoiltuja suomuja (Manton ja Ettl, 1965; Becker ym., 1991; Domozych ym., 1991, 1992). Toinen luokka, Chlorokybophyceae, koostuu myös yhdestä tunnetusta lajista, Chlorokybus atmophyticus. Tämä harvinainen levä muodostaa sarkinoidisen solupaketin, jota ympäröi paksu geelimäinen kuori (Rogers et al., 1980). On huomattava, että vaihtoehtoisten fylogenioiden mukaan Mesostigma ja Chlorokybus ovat sisarlinjoja, jotka yhdessä ovat sisarlinjoja kaikkien muiden streptofyyttien kanssa (Rodríguez-Ezpeleta et al., 2007). Kuuden luokan fylogeniassa kolmas luokka, Klebsormidiophyceae, koostuu kolmesta suvusta, jotka muodostavat yksinkertaisia haarautumattomia säikeitä (Sluiman et al., 2008), jotka ovat usein erilaisten maanpäällisten elinympäristöjen pinnoilla kasvavien ”biologisten kuorten” jäseniä. Useat tähän luokkaan kuuluvat lajit kestävät jopa merkittävää kuivumisstressiä, kun ne ovat osa aavikkokuorta (Mikhailyuk ym., 2008, 2014; Holzinger ja Karsten, 2013); toiset taas sietävät alhaisen lämpötilan ympäristöihin liittyvää kuivumisstressiä (Stamenkovic ym., 2014; Herburger ja Holzinger, 2015). Nämä kolme ensimmäistä luokkaa muodostavat ”varhaiset poikkeavat” karofyytit. Myös ”myöhäiseen divergenttiin” sukulinjaan kuuluu kolme luokkaa. Charophyceae- eli kivikasvustot esiintyvät yleisesti makean veden ekosysteemeissä, ja niillä on makroskooppiset monisoluiset talit, jotka koostuvat poikkeuksellisen pitkänomaisista soluista muodostuvista haarautuvien säikeiden aggregaatioista (Lewis ja McCourt, 2004). Tämän ryhmän jäsenillä on oogamiaan perustuva seksuaalinen lisääntyminen, johon kuuluu liikkuvia siittiöitä ja liikkumattomia munasoluja, jotka molemmat tuotetaan monisoluisissa gametangioissa. Coleochaetophyceae-ryhmään kuuluvat taksonit, joiden monisoluiset talit koostuvat haaroittuneista säikeistä tai parenkyymin kaltaisista talista (Graham, 1993; Delwiche et al., 2002). Näillä organismeilla on myös selvä oogamiaan perustuva seksuaalinen lisääntyminen. Coleochaetophyceae-heimoa tavataan tyypillisesti makean veden ja maanpäällisten elinympäristöjen rajapinnalla, usein epifyytteinä. Lopuksi suurin ja monimuotoisin karofyyttien ryhmä, Zygnematophyceae, koostuu yksisoluisista ja haarautumattomista säikeistä (Gontcharov et al., 2003; Guiry, 2013). Tämän ryhmän erityispiirre on konjugaatioon perustuva seksuaalinen lisääntyminen, joka edellyttää monimutkaista solu-solusignalointia ja adheesiota (Abe et al., 2016). Zygnematofyysilevät ovat yleisiä makean veden elinympäristöjen asukkaita, jotka esiintyvät toisinaan näyttävinä ephemeerisinä kukintoina, sekä kosteilla maa-alustoilla.

KUVIO 1. Zygnematofyysilevät. Pitkälle levinneet karofyytit. Ekstantit karofyytit jaetaan varhaisiin ja myöhäisiin erilaistuviin taksoneihin. Varhaisiin erilaistuviin taksoneihin kuuluvat Mesostigmatophyceae, Chlorokybophyceae ja Klebsormidiophyceae ja myöhäisiin erilaistuviin taksoneihin Charophyceae, Coleochaetophyceae ja Zygnematophyceae. Kunkin ryhmän edustajia ovat Mesostigma (Mesostigmatophyceae), Chlorokybus atmophyticus (Chlorokybophyceae), Klebsormidium flaccidum (Klebsormidiophyceae), Chara (Charophyceae), Coleochaete scutata (Coleochaetophyceae) ja Micrasterias (Zygnematophyceae).
Charofyytit malliorganismeina
Muutamia charofyyttejä on käytetty laajasti malliorganismeina biologisten perusprosessien tutkimuksessa. Niiden pienet ja yksinkertaiset talit (esim. maakasveihin verrattuna) ja helppous kokeellisessa manipuloinnissa ovat vain kaksi niiden ominaisuuksista, jotka tekevät niistä houkuttelevia malliorganismeja. Viimeaikaiset todisteet ovat myös osoittaneet, että monilla karofyyteillä on useita huomattavan samankaltaisia piirteitä kuin maakasveilla, kuten monien kasvun säätelijöiden biosynteettiset reitit (kuva 2; Boot et al., 2012; Hori et al., 2014; Wang et al., 2014, 2015; Holzinger ja Becker, 2015; Ju et al., 2015) ja useita soluseinän polymeerejä (Popper, 2008; Sørensen et al., 2010, 2011, 2012; Mikkelsen et al., 2014). Nämä kaksi ominaisuutta ovat tehneet karofyyteistä tehokkaita sellaisilla tutkimusalueilla kuin kasvien molekyylikehitys ja stressifysiologia. Vaikka monia karofyyttejä on käytetty monenlaisissa biologisissa tutkimuksissa, seuraavat taksonit ovat merkittävimpiä, koska niitä on käytetty laajasti malleina useilla tutkimusaloilla:
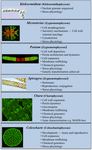
KUVIO 2. Karofyytit. Nykyiset mallit Charofyytit. Malleina käytetään useita Charofyyttejä, kuten Klebsormidiumia, Micrasteriasia, Peniumia, Spirogyraa, Charaa ja Coleochaetea; jokaisella on erityisiä ominaisuuksia, jotka tekevät siitä erityisen sopivan mallin tietyille fysiologisille ja biokemiallisille prosesseille.
Desmidit: Symmetriset mallit
Zygnematophyceae-heimon on hiljattain osoitettu olevan mitä todennäköisimmin maakasvien lähimpiä eläviä esivanhempia (Wodniok ym, 2011; Delwiche ja Cooper, 2015). Inklusiivisen placoderm-desmidiryhmän yksisoluisista jäsenistä on tullut tärkeitä malleja monien kasvien solubiologian ja kehityksen perusperiaatteiden selvittämiseksi. Suuri solukoko, huomattava symmetria/muoto, selväpiirteinen soluseinän arkkitehtuuri ja pitkälle kehitetyt endomembraani/sytorunkojärjestelmät ovat vain muutamia ominaisuuksia, jotka tekevät niistä erinomaisia solujärjestelmiä solufysiologian ja -kehityksen tutkimiseen. Viimeaikaiset vakaat muunnetut linjat ja pian sekvensoitavat genomit/transkriptomit tietyistä desmideistä ovat lisänneet entisestään niiden arvoa kasvitieteellisissä tutkimuksissa. Kaksi taksonia, Micrasterias ja Penium, ovat nousseet desmidien parhaiten tutkituiksi.
Micrasterias on ollut suosituin desmidi solubiologisessa tutkimuksessa viimeisten 50 vuoden ajan sen ainutlaatuisten ominaisuuksien vuoksi (Meindl, 1993; Lutz-Meindl, 2016). Micrasterias-solulla on bilateraalinen symmetria, jota usein korostaa näyttävästi leikattu (eli monilohkoinen) periferia. Solunjakautumisessa syntyvillä uusilla tytärpuolisoluilla ei ole tätä monimutkaista morfologiaa, vaan ne ovat muodoltaan pallomaisia. Monimutkainen sytokineettisen kehityksen jälkeinen kehitysohjelma, joka käyttää useita hyvin koordinoituja subcellulaarisia mekanismeja, synnyttää monilohkoisen fenotyypin tytärpuolisolujen laajenemisen aikana. Tämä ohjelma vastaa myös polymeerien laskeutumisesta sekä primaarisen että sekundaarisen soluseinän tuottamiseksi. Nämä tapahtumat keskittyvät suureen Golgin elinten ja niihin liittyvien vesikkelien verkostoon, joka tuottaa monimutkaisen erittymismekanismin. Tämä prosessi puolestaan kohdistuu tiettyihin solun pintakohtiin, jotka synnyttävät moninapaisen solun laajenemisen ja samanaikaisen soluseinän makromolekyylien ja solunulkoisen limakalvon erittymisen (Kim et al., 1996; Lutz-Meindl ja Brosch-Salomon, 2000; Oertel et al., 2004; Aichinger ja Lutz-Meindl, 2005). Erittävien komponenttien toimittaminen täsmällisiin solupinnan lokuksiin edellyttää kehittynyttä aktinomyosiinipohjaista sytomotilijärjestelmää, ja sitä ohjaavat useat signaalinvälityskaskadit (Meindl ym., 1994; Oertel ym., 2003). Lisäksi solujen morfogeneesi on erittäin herkkä ulkoiselle stressille (esim. oksidatiivinen stressi, suolapitoisuus, raskasmetallit), joka johtaa merkittäviin muutoksiin solujen erilaistumisessa (Darehshouri ym., 2008; Affenzeller ym., 2009; Andosch ym., 2012). Micrasterias on erinomainen organismi näiden subcellulaaristen ominaisuuksien analysointiin, koska sitä on helppo ylläpitää ja manipuloida laboratoriossa ja se soveltuu erityisen hyvin korkearesoluutioisen kuvantamisen hankkimiseen valo- ja elektronimikroskopialla, mukaan lukien immunosytokemia, Focused Ion Beam-Scanning Electron Microscopy (FIB-SEM) ja Electron Energy Loss Spectroscopy (EELS) -kuvausmenetelmällä (Lutz-Meindl, 2007; Eder ja Lutz-Meindl, 2008, 2010; Wanner ym., 2013; Lutz-Meindl ym., 2015). Lisäksi ensimmäiset molekyylianalyysit, mukaan lukien transformoitujen solulinjojen tuottaminen, ovat lisänneet entisestään Micrasterian käyttöä erityisesti soluseinän prosessoinnin molekyylidynamiikassa (Vannerum ym., 2010, 2011, 2012).
Viime vuosikymmenen aikana myös desmidista, Penium margaritaceumista, on tullut arvokas malliorganismi (Domozych ym., 2009, 2014; Sørensen ym., 2014; Rydahl ym., 2015; Worden ym., 2015). Toisin kuin Micrasterias, Peniumilla on yksinkertainen sylinterimäinen muoto, sillä on vain primaarinen soluseinä ja se laskeutuu seinämäpolymeerejä solun pinnan kahteen erityiseen paikkaan laajenemisen aikana (Domozych et al., 2011). Tämä suhteellinen yksinkertaisuus on erittäin houkutteleva selvitettäessä kasvisolujen kehityksen perusperiaatteita, mukaan lukien soluseinän kehitys, solun laajeneminen ja erittymisdynamiikka (Domozych et al., 2005, 2014; Ochs et al., 2014). Yksi sen tärkeimmistä ominaisuuksista on se, että siinä on samanlaisia soluseinän polymeerejä kuin monissa maakasveissa (esim. selluloosa, pektiinit, hemiselluloosat) ja että nämä polymeerit voidaan merkitä monoklonaalisilla vasta-aineilla. Elävien solujen merkitsemisen jälkeen ne voidaan palauttaa viljelyyn, jossa voidaan seurata solujen myöhempää laajenemista ja seinämän laskeutumistapahtumia (Domozych et al., 2009; Rydahl et al., 2015). Peniumia on myös helppo ylläpitää laboratoriossa, ja sen nopea kasvunopeus tarkasti kontrolloiduissa olosuhteissa tekee siitä erinomaisen näytteen monien kemiallisten aineiden laajamittaisiin samanaikaisiin mikroseulontoihin (kasvattamalla monikuoppalevyissä) ja niiden spesifisten vaikutusten arvioimiseen laajenemiseen/seinämän kehitykseen (Worden et al., 2015). Tämä auttaa merkittävästi paljastamaan tiettyjen alisoluisten komponenttien ja prosessien roolin laajentumisessa/erilaistumisessa. Viime aikoina stabiilien transformoitujen linjojen eristäminen (Sørensen et al., 2014) on lisännyt entisestään tämän levän potentiaalia tulevissa kasvisolututkimuksissa.
Chara ja Nitella: Cellular Giants for Plant Physiology
Charan ja Nitellan (Charophyceae) lajeja on jo pitkään käytetty näytteinä erilaisissa biologisissa tutkimuksissa, erityisesti niissä, jotka käsittelevät soludynamiikkaa, laajenemista ja sytoplasman virtausta (Green, 1954; Probine ja Preston, 1962). Niiden makroskooppiset talit eroavat toisistaan solmupisteillä, joista haaroja ja gametangioita syntyy, ja solmujen sisäisillä alueilla, jotka koostuvat poikkeuksellisen pitkänomaisista soluista. Solunsisäisissä soluissa on selvästi havaittavissa subcellulaaristen komponenttien kerrostuneisuus, jossa spiraalimaiset kloroplastit määrittelevät paikallaan pysyvän kuoren, joka ympäröi endoplasmaa, jossa tapahtuu nopein havaittu aktinomyosiinin synnyttämä sytoplasman virtaus. Sytoplasma sisältää erilaisia endomembraanikomponentteja, jotka osallistuvat dynaamisiin membraaniliikenneverkostoihin (esim. endosytoosi ja eksosytoosi), joita ohjataan monimutkaisilla signaalinsiirtokaskadeilla (Foissner ja Wastenys, 2000, 2012, 2014; Sommer ym., 2015; Foissner ym., 2016). Sisäsoluilla on soluseinät, joissa on runsaasti selluloosaa ja pektiiniä, homogalakturonaania (HG). Turgori on laajentumisen pääasiallinen liikkeellepaneva voima, ja pektiini on todennäköisesti seinämän laajentumista ohjaava kantava komponentti. HG:n syklinen, ei-entsymaattinen modulaatio ja samanaikainen kalsiumkompleksin muodostuminen on mekanismi, joka vastaa solun laajenemiseen johtavien seinämämodulaatioiden ohjaamisesta (Proseus ja Boyer, 2007, 2008, 2012; Boyer, 2016). Yksi Charan ja Nitellan teknisistä eduista solututkimuksessa on se, että solunsisäiset solut voidaan poistaa yksitellen; endoplasma ja soluseinät voidaan ”irrottaa” ja käyttää sitten akellulaarisina systeemeinä kokeelliseen manipulointiin.
Muilla taluksen komponenteilla, kuten juurakoilla, on organisoitu sytoplasman polaarinen organisaatio. Näissä soluissa on huipulla sijaitsevia sedimentoituvia, mineraalipitoisia statoliitteja, jotka toimivat painovoiman havaitsemisessa (Hodick et al., 1998; Braun, 2002; Braun ja Limbach, 2006). Tämä ominaisuus on tehnyt Charasta ensimmäisen charofyytin avaruudessa. TEXUS-raketin parabolisten lentojen aikana osoitettiin, että statoliitit aiheuttavat aktiinifilamentteihin jännitysvoimia. Voimien tasapaino (eli painovoima ja aktiinifilamenttien vastavoima) on vastuussa statoliittien oikeasta sijainnista juurakossa, mikä puolestaan takaa kyvyn reagoida painovoimavektoriin (Braun ja Limbach, 2006). Laserpinsettien ja hitaasti pyörivän sentrifugimikroskopian käyttö on osoittanut, että statoliittien laskeutuminen ei riitä aiheuttamaan ritsoidin kärjen painovoimaista taipumista. Pikemminkin mineraalirikkaiden statoliittien on laskeuduttava tietyille plasmakalvon alueille, jotta gravitrooppiset morfologiset vaikutukset etenisivät (Braun, 2002). Karaa on käytetty myös muiden ilmiöiden, kuten elektrofysiologian ja hormonien roolin ja liikkeen tutkimiseen (Belby, 2016).
Coleochaete for Developmental Studies and Pattern Development
Kasvin monisoluisen taluksen (eli kudoksen, elimen) muodostuminen edellyttää täsmällisiä, alueellisesti säädeltyjä solunjakautumistasoja, joita kontrolloivat useat geenisarjat, jotka ilmentyvät tietyissä pisteissä kehityksen aikana (Besson ja Dumais, 2011; Umen, 2014). Sekä kolmiulotteisessa tilassa että ajassa ohjattu taluksen morfogeneesi moduloituu myös vastauksena ulkoisiin stressitekijöihin. Kasveissa näistä kehitysohjelmista tekee vielä monimutkaisempia soluseinät, jotka eivät salli solujen siirtymistä tai kudosten joustavuutta. Niiden erityisten tapahtumien selvittäminen, jotka ovat keskeisiä taluksen muodon ja koon ilmenemisen kannalta, on usein vaikeaa maakasveissa, joissa solujen erityiskäyttäytymisen resoluutio on usein huonosti ratkaistavissa, kun ne on upotettu erittäin monimutkaisiin ja laaja-alaisiin kudoksiin/orgaaneihin. Niiden organismien käyttö, joilla on yksinkertaisempi taluksen muotoilu, on ollut eduksi kehityksen perusilmiöiden ymmärtämisessä, ja karofyyttisuku Coleochaete on yksi tällainen esimerkki. Tietyt lajit (esim. C. orbicularis, C. scutatum) tuottavat parenkymaattisen diskoidisen taluksen, joka kasvaa ulospäin yhdistelmällä anti- tai perikliinisiä solunjakautumia ja sen jälkeen tapahtuvaa uloimpien solujen laajenemista (Brown et al., 1994; Cook, 2004). Minkä tahansa solun jakautumistaso noudattaa yksinkertaisia sääntöjä, jotka perustuvat solun kokoon, solun muotoon ja maantieteelliseen sijaintiin taluksessa (Dupuy et al., 2010; Besson ja Dumais, 2011). Tämä ominaisuus mahdollistaa matemaattisten mallien rakentamisen, joiden avulla voidaan tulkita monisoluista morfogeneesiä (Domozych ja Domozych, 2014; Umen, 2014) ja saada kriittistä tietoa elinten ja kokonaisten organismien evoluutiosta, biomekaniikasta ja fysiologiasta. Lisäksi joitakin Coleochaete-lajeja on tutkittu laajasti niiden rakenteellisten ja toiminnallisten modulaatioiden selvittämiseksi, joita taluksessa tapahtuu kuivumisolosuhteissa (Graham ym., 2012), eli keskeisten piirteiden selvittämiseksi, kun halutaan ymmärtää varhaisten maakasvien evoluutiota ja kasvien kasvudynamiikkaa kuivuuden aikana.
Näkemyksiä genomi- ja geenitutkimuksista
Molekulaarisilla työkaluilla on monien muiden tekniikoiden tavoin kyky välittää uutta tietoa, jolla on merkitystä monilla tutkimusaloilla, mukaan lukien fysiologia ja kehitys. Esimerkiksi MADS-box-geeniperheen jäseniä on eristetty ja karakterisoitu kolmesta karofyytistä, Chara globularis, Coleochaete scutata ja Closterium peracerosum-strigosum-littorale (Tanabe et al., 2005). MADS-box-geenien ilmentymismalli karofyyteissä viittaa siihen, että niillä on merkitystä haploidien kehityksessä ja lisääntymisessä (Tanabe ym., 2005). Niiden uskotaan rekrytoituneen diploidisukupolveen ja niiden roolin kehityksessä monipuolistuneen edelleen maakasvien evoluution aikana (Tanabe et al., 2005). Tähän mennessä Klebsormidium flaccidum on ainoa karofyytti, josta on saatavilla lähes täydellinen ydingenomi (Hori et al., 2014); vaikka kloroplastien ja mitokondrioiden genomit on sekvensoitu kunkin kuuden karofyyttiluokan edustajilta, ja joistakin karofyyttien luokista on saatavilla EST:itä (Expressed Sequence Tags, ilmaistut sekvenssitunnisteet) (Delwiche, 2016). Klebsormidiumin genomista on jo löydetty geenejä useiden kasvihormonien ja signaloinnin välituotteiden synteesiin, mekanismeja suojautumiseen korkeaa valon intensiteettiä vastaan (Hori ym., 2014) ja ryhmän IIb WRKY-transkriptiotekijöiden läsnäoloa, joiden on aiemmin luultu esiintyneen ensimmäisen kerran sammalissa (Rinerson ym., 2015). Useita karofyyttien genomin sekvensointihankkeita on parhaillaan käynnissä (Delwiche, 2016), ja ne mahdollistavat yksityiskohtaisemmat vertailevat analyysit, joihin sisältyy suurempi määrä karofyyttejä, ja antavat mahdollisesti uutta tietoa lajien ja geenien välisistä evolutiivisista suhteista. Karofyyttien ainutlaatuinen asema streptofyyttien varhaisimpana erilaistuvana ryhmänä tekee niistä erityisen tehokkaan välineen evoluutio-kehitystutkimuksiin ja kehittyviin teknologioihin, kuten äskettäin saavutettuun stabiiliin transformaatioon Peniumissa (Sørensen et al., 2014) mahdollistavat tiettyjen geenien toiminnan tutkimisen.
Karofyyttien tuleva käyttö malliorganismeina
Kriittinen seuraava askel karofyyttitutkimuksessa on taksonit mukaan ottavien taksonien genomien analyysi ja vertailututkimukset maakasvien genomien kanssa. Tämä työ ei ainoastaan tuota keskeistä tietoa sopeutumismekanismeista, joita karofyytit ovat kehittäneet ilmaantuessaan ja menestyksekkäästi kolonisoidessaan maanpäällisiä elinympäristöjä, vaan se myös tarkentaa ja laajentaa entisestään nykyisten malliorganismien käyttöä kasvien perustutkimuksessa. Vaikka molekyylitutkimukset tukevat monia tutkimusaloja, kaksi välittömästi hyötyvää alaa ovat soluseinän biologia ja kasvun säätelijöiden dynamiikka kasvussa ja kehityksessä. Ensin mainitulla alalla karofyytit voivat selventää monia perustavanlaatuisia, mutta vielä huonosti selvitettyjä ilmiöitä, kuten pektiinin ja soluseinän proteiinien biosynteesiä, soluseinän polymeerien hallittua eritystä, laskeutumista ja sen jälkeisiä modulaatioita sekä kasvisolujen erityisiä, vuorovaikutteisia kalvojen siirtoverkkoja. Jälkimmäisen osalta karofyyttimallit auttaisivat tulkitsemaan molekyylisignaalien välittämistä, solubiologiaa ja kasvun ja kehityksen dynamiikkaa, jotka liittyvät hormoneihin, kuten etyleeniin ja auxiiniin. Viimeaikaiset ekofysiologiset tutkimukset karofyyteillä tarjoavat myös potentiaalista kriittistä tietoa sen määrittämiseksi, miten kasvisolut sopeutuvat stressiin, kuten kuivumiseen ja suolan sietokykyyn (Holzinger ja Karsten, 2013; Pichrtová et al., 2014; Herburger et al., 2015; Holzinger ja Becker, 2015; Holzinger ja Pichrtová, 2016; Kondo et al., 2016). Karofyyttitutkimuksen tulevaisuus on todellakin hyvin valoisa, ja siitä tulee näin ollen siunaus koko kasvibiologialle.
Tekijöiden panos
Kaikki luetellut kirjoittajat ovat antaneet merkittävän, suoran ja älyllisen panoksensa työhön ja hyväksyneet sen julkaistavaksi.
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Acknowledgement
Tämän työn tukena olivat NSF (USA) MCB-yhteistyöapurahat 1517345 ja 1517546.
Belby, M. J. (2016). Monimittakaavainen karsaanien koejärjestelmä: kalvosiirtimien elektrofysiologiasta solujen väliseen liitettävyyteen, sytoplasman virtaukseen ja auxiiniaineenvaihduntaan. Front. Plant Sci. 7:1052. doi: 10.3389/fpls.2016.01052
CrossRef Full Text | Google Scholar
Braun, M. (2002). Painovoiman havaitseminen edellyttää statoliitteja, jotka asettuvat tietyille plasmakalvoalueille karsaalien rihmastoissa ja protonemoissa. Protoplasma 219, 150-159. doi: 10.1007/s007090200016
CrossRef Full Text | Google Scholar
Braun, M., and Limbach, C. (2006). Hiidenlevien ritsoidit ja protonemat: mallisoluja polarisoituneen kasvun ja kasvien painovoiman aistimisen tutkimukseen. Protoplasma 229, 133-142. doi: 10.1007/s00709-006-0208-9
CrossRef Full Text | Google Scholar
Graham, L. E. (1993). Maakasvien alkuperä. New York, NY: John Wiley & Sons, 287.
Google Scholar
Herburger, K., and Holzinger, A. (2015). Kalloosin lokalisointi ja kvantifiointi Streptofyyttien viherlevissä Zygnema ja Klebsormidium: korrelaatio kuivumisen sietokyvyn kanssa. Plant Cell Physiol. 56, 2259-2270. doi: 10.1093/pcp/pcv139
CrossRef Full Text | Google Scholar
Lemieux, C., Otis, C., and Turmel, M. (2016). Streptofyyttien viherlevien vertailevat kloroplastigenomianalyysit paljastavat merkittäviä rakenteellisia muutoksia Klebsormidiophyceae-, Coleochaetophyceae- ja Zygnematophyceae-heimoissa. Front. Plant Sci. 7:697. doi: 10.3389/fpls.2016.00697
CrossRef Full Text | Google Scholar
Lutz-Meindl, U. (2007). Energiaa suodattavan transmissioelektronimikroskopian käyttö kuvan tuottamiseen ja elementtianalyysiin kasviorganismeissa. Micron 38, 181-196. doi: 10.1016/j.micron.2006.03.017
CrossRef Full Text | Google Scholar
Meindl, U. (1993). Micrasteriasolut morfogeneesin tutkimuksen mallijärjestelmänä. Microbiol. Rev. 57, 415-433.
Google Scholar
Pichrtová, M., Kulichova, J. ja Holzinger, A. (2014). Typpirajoitus ja hidas kuivuminen indusoivat kuivumisen sietokykyä konjugoituvissa viherlevissä (Zygnematophyceae, Streptophyta) polaarisista elinympäristöistä. PLoS ONE 9:e113137. doi: 10.1371/journal.pone.0113137
CrossRef Full Text | Google Scholar
Pickett-Heaps, J. D., ja Marchant, H. J. (1972). Viherlevien fylogenia: uusi ehdotus. Cytobios 6, 255-264.
Google Scholar
Stamenkovic, M., Woelken, E., and Hanelt, D. (2014). Eri maantieteellisistä paikoista kerättyjen Cosmarium-kantojen (Zygnematophyceae, Streptiophyta) ultrastruktuuri osoittaa lajikohtaisia eroja sekä optimaalisissa että stressilämpötiloissa. Protoplasma 251, 1491-1509.
Google Scholar
.