08.8.2019
Mainitaan ApoE ja Alzheimerin tauti, ja keskustelu kääntyy E4-alleeliin, joka on taudin voimakkain alttiusgeeni. Mutta ApoE:llä on toinenkin puoli, ApoE2. Vaikka tämä isoformi suojaa Alzheimerin tautia vastaan, tutkijat eivät ole juurikaan tutkineet sitä. Nyt ApoE2 herättää huomiota, kun tutkijat kysyvät, miten jotkut ihmiset säilyttävät henkisen terävyytensä vanhuuteen asti. Los Angelesissa 14.-18. heinäkuuta pidetyssä Alzheimer’s Associationin kansainvälisessä konferenssissa esitettiin tutkimus, jossa tutkittiin ApoE:n genotyyppejä 5 000 ruumiinavauksessa vahvistetussa Alzheimerin tautitapauksessa. Tutkimuksessa kävi ilmi, että ihmisillä, joilla on kaksi kopiota E2:ta, dementian riski laskee 90 prosenttia verrattuna niihin, joilla on yleinen E3/E3-genotyyppi. Muiden tutkimusten mukaan tämä saattaa johtua siitä, että ApoE2 vähentää amyloidi- ja tau-patologiaa ja lisää harmaan aineen määrää kriittisillä aivoalueilla. E2:n hyödyt näyttävät olevan Alzheimerin taudille ominaisia eivätkä yleisiä neurodegeneraatiolle.
ApoE on aivojen tärkein kolesterolia kuljettava proteiini. Sitä on tutkittu siitä lähtien, kun se löydettiin Alzheimerin taudin riskigeeniksi 1990-luvun alussa, mutta se on hiljattain noussut esiin keskuksena gliavasteissa amyloidin ja tau-aggregaattien laskeutumiseen (elokuun 2018 uutiset; syyskuun 2017 uutiset). Geeni esiintyy kolmena polymorfisena alleelina – E2, E3 ja E4 – joiden maailmanlaajuinen esiintymistiheys on vastaavasti 8 prosenttia, 78 prosenttia ja 14 prosenttia. Tunnetaan myös useita mutatoituneita muotoja, esimerkiksi niin sanotut Heidelberg-, Pittsburgh- ja Christchurch-mutaatiot (Feussner ym., 1992; Kamboh ym., 1999; Wardell ym., 1987).
ApoE4 saa ylivoimaisesti eniten huomiota AD-tutkijoilta, koska se lisää AD:n riskiä jopa 15-kertaiseksi tutkimusjoukosta riippuen, ja sitä esiintyy 40 prosentilla AD:tä sairastavista. E2, suojaava alleeli, on saanut vain vähän huomiota, koska se on kolmesta alleelista harvinaisin ja puuttuu suurelta osin AD-näytteistä. Ihmisillä, joilla on yksi kopio E2:sta, on puolet pienempi mahdollisuus sairastua Alzheimerin tautiin kuin niillä, joilla on yleisempi E3/E3-genotyyppi. Mutta onko ylimääräisellä E2:lla muuta vaikutusta? ”Emme ole tienneet, onko E2-annoksella erilainen riski, eli onko E2/2:n riski merkittävästi pienempi kuin E2/3:n”, Eric Reiman sanoi esitellessään tutkimuksen.
Taatakseen sen selville Reiman ja kollegat Banner Alzheimer’s Institutessa Phoenixissa, Gyungah Jun Bostonin yliopistossa, Joseph Arboleda Massachusettsin silmä- ja korvasairaalassa, Yakeel Quiroz Massachusettsin yleissairaalassa ja kollegat Alzheimerin tautien genetiikkakonsortiosta päättivät tarkastella tietoja monista aivoista. He analysoivat kaikkien kolmen ApoE-alleelin vaikutusta dementiariskiin ja patologiaan ADGC:n 5 007 aivossa. Näyte sisälsi 4 018 ruumiinavauksessa vahvistettua Alzheimerin dementiatapausta sekä 989 patologisesti ja kognitiivisesti sairastumatonta luovuttajaa. Sen lisäksi, että tämä kohortti tarjoaa riittävän määrän E2/E2-homotsygoottien tutkimiseen, siinä vältetään väärän diagnoosin aiheuttama sekoittava tekijä, koska siinä ei ole mukana dementioita, jotka eivät johdu Alzheimerin taudista, eikä henkilöitä, joilla oli kuolinhetkellä Alzheimerin taudin patologiaa, mutta joilla ei ollut dementiaa.
Odotetusti ApoE2-homotsygootit olivat harvinaisia – heitä oli vain 24 henkilöä yli 5 000:sta henkilöstä eli 0,5 prosenttia. Muihin genotyyppeihin verrattuna heillä oli paljon pienempi todennäköisyys sairastua Alzheimerin tautiin. E2-homotsygootteja oli 0,1 prosenttia tapauksista mutta 1,9 prosenttia terveistä kontrolleista. Sen sijaan ApoE4/4-homotsygootteja oli 15,6 prosenttia tapauksista ja vain 1 prosentti kontrolleista. Toisin sanoen 24:stä ApoE2/2:sta 19 oli kognitiivisesti terveitä, mutta 633:sta ApoE4/4:stä vain 10.
E2-homotsygooteilla riski pieneni 66 prosenttia jopa E2/3-kantajiin verrattuna, 87 prosenttia yleisimpään genotyyppiin, E3/3:een, verrattuna ja peräti 99,6 prosenttia E4/4-kantajiin verrattuna. Periaatteessa suurin osa ihmisistä, joilla on E4/4, sairastuu Alzheimerin dementiaan, kun taas vain harvat, joilla on ApoE 2/2, sairastuvat.
Kahden E2-alleelin omistaminen korreloi vähäisempään amyloidiplakin ja tau-neurofibrillaarisen rykelmän patologiaan. ApoE2:n suojaava vaikutus tau-patologiaan näkyi edelleen, vaikka amyloidiplakkikuormitus oikaistiin. Tämä heijastaa viimeaikaisia eläintietoja, jotka viittaavat siihen, että ApoE4 vaikuttaa pahentavasti tau-patologiaan amyloidista riippumatta (Shi ym., 2017).
Uuden tutkimuksen tärkein havainto mukailee Pieter-Jelle Visserin (Maastrichtin yliopisto, Alankomaat) ja kollegoiden aiempaa tutkimusta. He olivat löytäneet 7583 henkilön otoksesta 16 ApoE2/2-kantajaa, joista 10 oli kognitiivisesti normaaleja ja amyloidinegatiivisia, kun taas 386 ApoE4/4-kantajasta 301:llä oli Alzheimerin dementia. Tämä otos ei kuitenkaan ollut patologisesti vahvistettu (Jansen ym., 2015).
Miten tärkeää on neuropatologinen varmistus? Reiman ym. vertasivat ruumiinavauksella varmistetusta kohortista johdettuja riskiarvioita kohortista laskettuihin riskiarvioihin, joka koostui 23 857 elossa olevasta henkilöstä, joilla oli kliinisesti diagnosoitu todennäköinen Alzheimerin taudin dementia tai jotka olivat kognitiivisesti normaaleja ja joiden amyloidistatus oli tuntematon. Kyseisessä analyysissä sekä 2/2:n suojaava vaikutus että 4/4:n aiheuttama lisääntynyt riski aliarvioitiin. Tutkijat havaitsivat esimerkiksi, että E4/E4:n ja E3/E3:n välinen kertoimen suhde kliinisessä näytteessä oli 10,7 verrattuna 31,22:een patologisesti vahvistetuissa tapauksissa. Sekä E2:n että E4:n annosvaikutukset aliarvioitiin myös elävässä näytteessä. Näin ollen ruumiinavausanalyysi tarjoaa päivitetyt ja todennäköisesti tarkemmat riskiarviot kaikille ApoE-genotyypeille, uskovat Reiman ja kollegat, ainakin näiden ei-hispanovalkoisten tutkimushenkilöiden osalta.
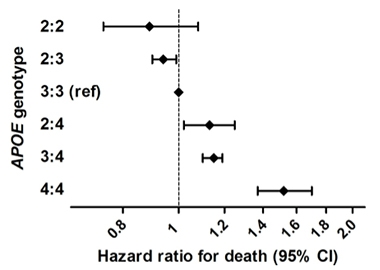
Life Extending. Suuressa epidemiologisessa tutkimuksessa, jossa yhdistettiin kuusi eurooppalaista syntyperää olevien ihmisten väestöpohjaista kohorttia, ApoE2-homotsygooteilla oli pienempi riski kuolla kuin muilla genotyypeillä. ApoE4-homotsygooteilla riski oli suurin.
ApoE:n vaikutuksen Alzheimerin tautiin tiedetään eroavan etnisten ryhmien välillä. Tämäntyyppistä tutkimusta tarvitaan monipuolisemmilla koehenkilöillä, useammilla E2/2-homotsygooteilla ja ottamalla huomioon ApoE-alleelien mahdolliset vaikutukset eloonjäämiseen, mikä voisi vääristää tuloksia. Siitä huolimatta Reiman sanoi: ”Tuloksemme viittaavat siihen, että ApoE2-homotsygootti liittyy poikkeuksellisen pieneen Alzheimerin taudin riskiin, että APOE:n ja sen varianttien vaikutus Alzheimerin taudin riskiin on huomattavasti suurempi kuin aiemmin on arvioitu ja että on olemassa pakottava syy löytää hoitoja, jotka edistävät tätä suojavaikutusta.”
Tämä on samansuuntaista kuin tuoreet tulokset, jotka ovat peräisin Sudha Seshadrilta (University of Texas Health, San Antonio), Frank Woltersilta (Erasmus Medical Center, Rotterdam, Hollanti) ja kollegoilta. He havaitsivat ApoE2-kantajien eloonjäämisedun tutkimuksessa, johon osallistui 38 537 ihmistä kuudesta väestöpohjaisesta kohortista (Wolters ym., 2019). He tunnistivat 239 E2-homotsygoottia, jotka elivät pisimpään. E2:n vaikutus selittyi vain osittain sen vaikutuksilla veren lipideihin tai verisuonisairauksiin. E4-homotsygooteilla oli suurin kuolemanriski, ja tämä selittyi suurelta osin sen yhteydellä dementiaan. Seshadri kertoi Alzforumille, että tutkijat aikovat tarkastella Alzheimerin tautia ja kognitiivisia muutoksia sekä amyloidi- ja tau-PET-mittauksia tässä näytteessä.
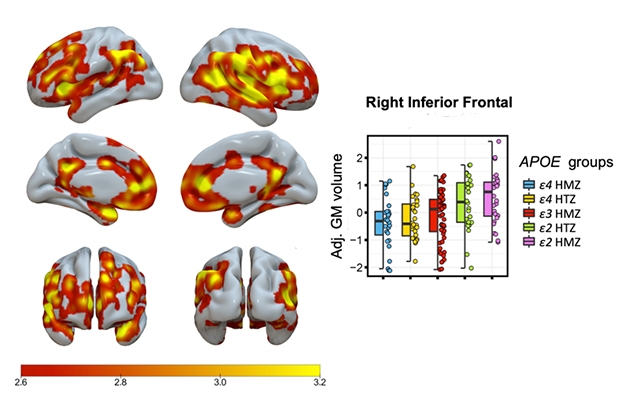
Bit by Bit. Varjostus osoittaa alueet, joilla harmaan aineen tilavuuden merkittävä vaiheittainen, ApoE-genotyyppiin liittyvä kasvu on havaittavissa; E4/4-homotsygooteilla on pienin ja E2/2-homotsygooteilla suurin tilavuus. Kuvassa esitetään tiedot yhdeltä aivojen alueelta.
Miten ApoE2 saattaa antaa joustavuutta? Sen selvittämiseksi Gemma Salvadó, Barcelonaβetan aivotutkimuskeskuksesta, Espanjasta, esitteli tutkimuksen, jossa hän ja apulaiskirjailijat kokosivat yhteen eri näytteistä saatuja kuvantamistietoja mahdollisimman monesta iäkkäästä ApoE2-homotsygootista. Heidän tavoitteenaan oli verrata E2/2:n aivojen rakennetta muiden ApoE-genotyyppien aivojen rakenteeseen.
Aiemmin E2 oli yhdistetty hienovaraisiin muutoksiin aivojen morfologiassa terveillä ihmisillä, kuten hitaampaan hippokampuksen surkastumiseen iäkkäässä iässä ja suurempiin hippokampuksiin keski-iässä (Chiang ym., 2010; Fennema-Notestine ym., 2011). Lapsuudessa E2-kantajilla on raportoitu olevan paksumpi entorinaalinen aivokuori kuin E3-homotsygooteilla tai E4-kantajilla (Shaw ym., 2007). Mutta nämä kaikki tutkimukset keskittyivät ihmisiin, joilla oli yksi kopio E2:sta.
Selvittääkseen, mitä tuo ylimääräinen E2 tekisi, Salvadó keräsi ja analysoi magneettikuvausdataa kognitiivisesti häiriintymättömistä ihmisistä Barcelonassa tehdyssä ALFA-tutkimuksessa (Molinuevo ym. 2016), Amsterdamin yliopistollisen lääketieteellisen keskuksen kohortissa, OASIS-avoimissa kuvantamistutkimuksissa ja ADNI:ssä. Hän löysi 28 E2/E2-homotsygoottia. Hän täsmäytti jokaisen heistä viiden muun koehenkilön kanssa samasta keskuksesta iän, sukupuolen ja koulutustason perusteella sekä yhden jokaisesta muusta ApoE-genotyypistä. Näin saatiin yhteensä 168 koehenkilöä, joiden keski-ikä oli 62.
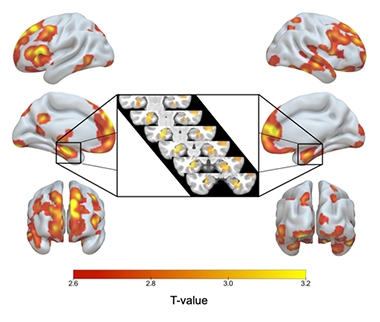
ApoE2/2 Yli 3/3. Puna-keltainen varjostus osoittaa aivoalueita, joilla ApoE2-homotsygooteilla oli enemmän harmaata ainetta kuin E3-homotsygooteilla, mukaan lukien molemmat hippokampukset (sisäkuva).
E2/2:lla oli E3/3-vertaisiinsa verrattuna suurempi harmaan aineen tilavuus hippokamppeissa ja muilla AD:n tunnusalueilla, mukaan lukien mediaalinen ohimoaivokuori, inferiorinen ohimoaivo, ohimolohko, prekuneus ja ylemmät parietaalialueet. E2-homotsygooteilla oli myös enemmän harmaata ainetta alueilla, jotka liittyvät kognitiiviseen vastustuskykyyn ikääntyessä, nimittäin anteriorisen cingulaatin ja mediaalisen prefrontaalialueen alueilla (Arenaza-Urquijo ym., 2019; Harrison ym., 2018). E2/3-heterotsygootteihin verrattuna E2-homotsygooteilla ei ollut juurikaan merkittäviä eroja harmaassa aineessa, mutta heillä oli jopa suuremmat hippokampukset kuin 2/3-heterotsygooteilla.
Salvadó raportoi harmaan aineen tilavuuden asteittaisesta, genotyyppiin liittyvästä kasvusta, jossa E4/4-homotsygooteilla oli pienin, E3/3-homotsygooteilla keskinkertainen, E2/3-homotsygooteilla suurempi ja E2/2-homotsygooteilla suurin tilavuus (ks. kuva alla).

ApoE2/2 Over 2/3. Verrattuna seuraavaksi suojaavaan genotyyppiin, ApoE2/3, E2-homotsygooteilla on enemmän harmaata ainetta vain muutamilla pienillä alueilla.
Hän uskoo, että suurempi harmaan aineen määrä strategisesti tärkeillä aivoalueilla saattaa auttaa E2-homotsygootteja selviytymään Alzheimerin taudin patologiasta, jos ja kun sitä ilmenee. Koska ApoE2 paisuttaa entorinaalista aivokuorta jo lapsuudessa, vastustuskyky voi hänen mukaansa kumpuaa kehitysprosesseista.
”Nämä ovat erittäin tärkeitä löydöksiä”, Reiman kommentoi. ”Ne viittaavat siihen, että jos surkastuminen on kuin renkaiden kulutuspinnan syöpyminen, E2-homotsygootit saattavat aloittaa enemmän kulutuspintaa”, hän sanoi. Salvadó pyrkii laajentamaan tutkimusta tarkastelemaan enemmän homotsygootteja lisäkohorteista ja muita kuvantamistapoja.
Terry Goldberg, Columbia University, New York, on tutkinut ApoE2:n välittämän hermosuojan mahdollisia mekanismeja jo vuosia (Conejero-Goldberg ym., 2014). AAIC:ssä Goldberg esitteli tuloksia ApoE-alleelien ja Alzheimerin taudin neuropatologian välisestä yhteydestä ja laajensi analyysin koskemaan myös muita sairauksia.
Hän käytti National Alzheimer’s Coordinating Centerin tietokannasta löytyviä tietoja 1557 aivosta, joissa oli sekä kliinisiä että neuropatologisia arvioita. Koska hänellä oli niin vähän E2-homotsygootteja, Goldberg ryhmitteli E2/E2- ja E2/E3-genotyypit yhteen, jolloin otos oli 130. Tässä yhdistetyssä ryhmässä yhdellä neljästä aivosta oli AD:n neuropaattisia muutoksia, kun taas E3/3:lla 40 prosenttia, E3/4:llä 65 prosenttia ja E4/4:llä 85 prosenttia. Aiempien tutkimusten mukaisesti E2-kantajilla oli lievin amyloidipatologia, vähiten neuriittisia plakkeja ja lievin tau-patologia. Tilastollinen välitysanalyysi osoitti, että ApoE2:n yhteys vähentyneisiin tangeleihin kulki osittain sen amyloidivaikutuksen kautta ja oli osittain riippumaton amyloidista. Tämä sopii yhteen Reimanin tulosten kanssa.
Tässäkin aineistossa ApoE2 suojasi voimakkaasti, vaikka Goldberg ei analysoinut homotsygootteja: E2 vähensi amyloidi- ja tau-patologian riskiä puoleen verrattuna E3:een ja 90 prosenttia verrattuna E4:ään.
Kumpi on tehokkaampi, E2 vai E4? Verrattaessa E2/E4- ja E3/E4-genotyyppejä Goldberg löysi vertailukelpoisia patologian tasoja. Jos jotain, niin E2/E4-pari oli huonompi. Tämä viittaa siihen, että E4 peittää E2:n suojaavat vaikutukset. ”Voisi sanoa, että E4 on myrkyllinen”, Goldberg totesi. Tämä viittaa siihen, että hoidot, joissa käytetään viruskonstruktioita E2:n syöttämiseksi E4:ää ilmentävään aivokudokseen, eivät ehkä auta, hän sanoi.
Miten on muiden hermoston rappeutumissairauksien laita?
Kirjallisuudessa on ristiriitaisia tuloksia E2:sta ja E4:stä frontotemporaalisessa dementiassa. Jotkut tutkimukset viittaavat siihen, että E2 edistää riskiä (maaliskuun 2016 uutinen), kun taas toiset uskovat sen suojaavan ja syyttävät riskistä E4:ää (Mishra ym., 2017). AAIC:ssä Goldberg raportoi, että E2 oli yhteydessä vakavampaan TDP-43-patologiaan 103:ssa frontotemporaalisen dementian tapauksessa ja suurempaan tau-patologiaan 28:ssa Pickin taudin tapauksessa ja 51:ssä progressiivisen supranukleaarisen halvauksen tapauksessa. Hän varoitti, että nämä luvut ovat niin pieniä, että tulokset voivat olla virheellisiä. Goldberg ei tiedä, oliko näillä potilailla C9ORF72- tai progranuliinimutaatioita, ja TDP-43:n kertyminen voi olla ikäsidonnaista. Tapauksissa, joissa on α-synukleiinipatologiaa, Goldberg havaitsi, että ApoE4 edistää ja E2 vähentää Lewyn kappale -patologian leviämistä keskiaivojen alkuperän ulkopuolelle limbisille ja neokortikaalisille alueille
Kokonaisuutena nämä tutkimukset tuovat esiin uuden arvostuksen siitä valtavasta vaikutuksesta, joka ApoE:llä on Alzheimerin taudin patogeneesiin (ks. esim. Wu ja Zhao, 2016). E2:n tarjoama syvä suoja herättää todennäköisesti uudelleen kiinnostusta lääkekehittäjien keskuudessa, jotka ovat yrittäneet ennenkin ja epäonnistuneet, mutta saattavat nyt nähdä aiheelliseksi tarkastella uudelleen tätä kohdetta.-Pat McCaffrey
Uutiset Sitaatit
- ApoE: Common Microglial Culprit in Aging, Alzheimer’s, and Tauopathy? 11 Aug 2018
- ApoE4 pahentaa kaikkea Tau:ta, alusta loppuun 20 Sep 2017
- Et Tu, ApoE2? Paper Claims Allele Boosts Risk for Dementia-in ALS 1 Mar 2016
Paper Citations
- Feussner G, Funke H, Weng W, Assmann G, Lackner KJ, Ziegler R.Severe type III hyperlipoproteinemia associated with unusual apolipoprotein E1 phenotype and epsilon 1/’null’ genotype. Eur J Clin Invest. 1992 Sep;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST. Uusi mutaatio apolipoproteiini E -geenissä (APOE*4 Pittsburgh) liittyy myöhään alkavan Alzheimerin taudin riskiin. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoproteiini E2-Christchurch (136 Arg—-Ser). Ihmisen apolipoproteiini E:n uusi variantti potilaalla, jolla on tyypin III hyperlipoproteinemia. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.ApoE4 pahentaa huomattavasti tau-välitteistä neurodegeneraatiota tauopatian hiirimallissa. Nature. 2017 Sep 28;549(7673):523-527. Epub 2017 Sep 20 PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Aivojen amyloidipatologian esiintyvyys henkilöillä, joilla ei ole dementiaa: meta-analyysi. JAMA. 2015 May 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE-tutkijat.APOE-genotyypin vaikutus eloonjäämiseen: tuloksia 38 537 osallistujasta kuudesta väestöpohjaisesta kohortista (E2-CHARGE). PLoS One. 2019;14(7):e0219668. Epub 2019 Jul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .Hippokampuksen surkastumisasteet ja CSF-biomarkkerit iäkkäillä APOE2-normaaleilla henkilöillä. Neurologia. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.ApoE ε4-alleelin läsnäolo liittyy ohuempaan otsalohkoon keski-iässä. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN. aivokuoren morfologia lapsilla ja nuorilla, joilla on erilaisia apolipoproteiini E -geenin polymorfismeja: havainnointitutkimus. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.The ALFA project: ALFA-projekti: tutkimusalusta Alzheimerin taudin varhaisten patofysiologisten piirteiden tunnistamiseksi. Alzheimers Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3 PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P. The metabolinen aivojen allekirjoitus kognitiivisesta kestävyydestä yli 80-vuotiailla: Alzheimerin patologioiden ulkopuolella. Brain. 2019 Apr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ. aivojen morfologia, kognitio ja β-amyloidi iäkkäillä aikuisilla, joilla on ylivoimainen muistisuoritus. Neurobiol Aging. 2018 Jul;67:162-170. Epub 2018 Mar 27 PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE. APOE2 parantaa neuroprotektiota Alzheimerin tautia vastaan useiden molekulaaristen mekanismien kautta. Mol Psychiatry. 2014 Feb 4; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium. geenipohjaiset assosiaatiotutkimukset raportoivat geneettisiä yhteyksiä frontotemporaalisen dementian kliinisiin alatyyppeihin. Brain. 2017 Apr 5; PubMed.
- Wu L, Zhao L.ApoE2 ja Alzheimerin tauti: aika katsoa tarkemmin. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
Lisälukemista
Ei saatavilla olevaa lisälukemista
.