Hiilitetrakloridi voidaan ilmaista muodossa CCl4, ja se koostuu yhdestä hiilimolekyylistä ja neljästä kloridimolekyylistä. Hiilitetrakloridi on pooliton. Miksi hiilitetrakloridi on pooliton? Se on pooliton, koska molekyylin dipolimomentit ovat tasaisesti jakautuneet keskeisen hiiliatomin ympärille. Tämä tarkoittaa, että niiden yksittäiset vaikutukset kumoutuvat ja molekyyli on neutraali.
Neljä klooriatomia sijaitsevat symmetrisesti tetraedrin neljässä kulmassa, ja yksi sidos yhdistää jokaisen niistä molekyylin keskellä olevaan hiiliatomiin. Tämän seurauksena CCl4:llä ei ole positiivista tai negatiivista nettodipolimomenttia. Jos jokin muu atomi kuin kloori olisi sijainnut molekyylissä missä tahansa muussa paikassa, molekyylillä olisi dipolimomentti ja CCl4 olisi sen seurauksena polaarinen.
”Määrittelemme orgaanisen kemian hiiliyhdisteiden kemiaksi.” – August Kekule
Se on nopea vastaus hiilitetrakloridin poolisuudesta. Olisi kuitenkin hyödyllistä puhua molekyylien poolisuudesta yleensä ja tutkia hiilitetrakloridia ja sen ominaisuuksia, jotta ymmärtäisimme, miksi se on luonnossa pooliton.
Mitä tarkoittaa, että molekyylillä on poolisuus?
Kun kuulet termin polaarinen, ajattelet todennäköisesti maapallon pohjois- ja etelänapaa. Nämä pohjois- ja etelänavat sijaitsevat maapallon vastakkaisissa päissä, samaan tapaan kuin paristossa voi olla positiivinen ja negatiivinen napa. Myös molekyyleillä ja atomien välisillä sidoksilla voi olla napaisuus. Molekyyli määritellään polaariseksi, kun molekyylin muodostavat atomit on järjestetty siten, että molekyylin toisessa päässä on positiivinen varaus ja toisessa päässä negatiivinen varaus.
Polaarinen molekyyli syntyy, kun atomi, jolla on korkea elektronegatiivisuustaso, yhdistyy tai sitoutuu atomin kanssa, jolla on heikompi elektronegatiivisuustaso. Syntyvässä molekyylissä on yksi alue, jolla on korkea elektronegatiivisuus ja yksi alue, jolla on matalampi elektronegatiivisuus eli sähköiset navat. Yksi tunnetuimmista esimerkeistä polaarisesta molekyylistä on vesi, ja veden polaarisen luonteen ansiosta se toimii elämän perustana maapallolla.
Ei-polaarisissa molekyyleissä ei sitä vastoin ole sähköisiä napoja, ja elektronit jakautuvat niissä tasaisemmin. Epänapaisissa molekyyleissä ei ole merkittävää varausta molekyylin kummassakaan päässä. Useimmat hiilivedyt ovat luonteeltaan poolittomia.
Yhteenvetona voidaan todeta, että molekyyli, jonka dipolit eivät kumoa toisiaan, on polaarinen, kun taas poolittomat molekyylit ovat molekyylejä, joissa atomien varaukset kumoavat toisensa eikä molekyylin toisessa tai toisessa päässä ole varausta.
Esimerkkejä polaarisista molekyyleistä
Vesi on polaarinen molekyyli, kuten aiemmin mainittiin. Happi- ja vetyatomien välillä olevat sidokset ovat jakautuneet siten, että atomin molemmat puolet, sekä happi- ja vety- että sidokset, ovat tasaisin välimatkoin. Tuloksena on, että happipuolella eli molekyylin yläosalla on lievästi negatiivinen varaus, kun taas vetyatomeilla eli molekyylin alaosalla on lievästi positiivinen varaus.
Etanoli on polaarinen molekyyli, koska molekyylin sisällä olevilla happiatomeilla on enemmän elektronegatiivisuutta kuin muilla atomeilla. Happiatomit vetävät puoleensa enemmän elektroneja suuremman elektronegatiivisuuspotentiaalinsa vuoksi, ja molekyylissä olevilla -OH-sidosryhmillä on kaiken kaikkiaan negatiivinen varaus, vaikka negatiivinen varaus onkin hyvin vähäinen.
”Elämää on olemassa maailmankaikkeudessa vain siksi, että hiiliatomilla on tiettyjä poikkeuksellisia ominaisuuksia.” – James Jeans
VAROITUS
Muita esimerkkejä polaarisista molekyyleistä ovat rikkidioksidi (SO2), rikkivety (H2S) ja ammoniakki (NH3).
Varoitetaan siitä, että molekyyli voi koostua polaarisista sidoksista ja silti olla pooliton. Esimerkkinä hiilidioksidi, jossa on neljä sidosta, mutta silti molekyylin dipolimomentit päätyvät neutraloimaan toisensa, joten molekyyli on pooliton.
Esimerkkejä poolittomista molekyyleistä

Esimerkkejä poolittomista molekyyleistä ovat typpi, metaani, otsoni ja happi. Nämä ovat homoydinmolekyylejä eli molekyylejä, jotka koostuvat vain yhden alkuaineen atomeista. Epänapaisia molekyylejä, jotka eivät ole homoydinmolekyylejä, ovat esimerkiksi edellä mainittu hiilidioksidi ja metaani. Myös tolueeni ja bensiini ovat esimerkkejä poolittomista aineista. Hiiliyhdisteet ovat pääsääntöisesti poolittomia, vaikka on joitakin poikkeuksia, kuten hiilimonoksidi. Hiilimonoksidi on luonteeltaan lineaarinen, mikä yleensä tekisi molekyylistä poolittoman, mutta hapen ja hiilen molekyylien välinen elektronegatiivisuusero on niin suuri, että molekyyli on poolinen. Alkyynit eivät liukene veteen, ja niitä pidetään poolittomina molekyyleinä. Myös inertit eli jalokaasut luokitellaan poolittomiksi molekyyleiksi, koska kaasut ovat vain yksittäisiä alkuaineittensa atomeja, kuten neon, helium, argon ja krypton.
Molekyylin polaarisuuden ennustaminen
Molekyylin atomien elektronegatiivisuusarvojen tarkasteleminen auttaa päättelemään, onko molekyyli todennäköisesti polaarinen vai pooliton. Merkittävät erot elektronegatiivisuusarvojen välillä tarkoittavat, että elektronit ovat jakautuneet tasaisesti molekyylin atomien kesken. Koska elektronit ovat lähempänä yhtä atomia kuin toista, molekyylin kyseinen alue on polaarinen, vaikka koko molekyylin polaarisuuden määrittämiseksi on otettava huomioon kaikki sidokset.
Molekyylin polaarisuuden tai epäpolaarisuuden kannalta ratkaiseva tekijä on sen geometria. Jos molekyylin toisessa päässä on negatiivinen varaus ja toisessa päässä positiivinen varaus, molekyyli on poolinen. Jos taas varaukset ovat tasaisesti jakautuneet ja kiertävät keskeistä atomia, molekyyli on todennäköisesti pooliton. Tämän avulla voit ennustaa, onko molekyyli poolinen vai pooliton. Kaikilla molekyyleillä ei ole dipolimomenttia, ja tämä voi tehdä molekyylin poolisuuden ennustamisesta hieman vaikeampaa. Esimerkiksi molekyyleillä, jotka voidaan kääntää ja peilata geometrisen tason poikki, ei ole dipolimomenttia, koska dipolimomentti voi koostua vain yhdestä pisteestä.
Faktoja hiilitetrakloridista
Hiilitetrakloridin löysi ensimmäisen kerran ranskalainen kemisti Henri Victor Regnault 1800-luvun puolivälissä. Kemikaali löydettiin kloorin ja kloroformin yhdistelmästä. Tästä huolimatta hiilitetrakloridia johdetaan nykyään pääasiassa metaanista. Hiilitetrakloridin valmistuksessa käytetään usein kloorausreaktioiden sivutuotteita yhdisteen tuottamiseksi. Näihin kuuluvat kloroformin ja dikloorimetaanin valmistuksen sivutuotteet. Hiilitetrakloridi on luonteeltaan melko haihtuvaa, ja sen haju muistuttaa kuivapesukemikaalien hajua. Hiilitetrakloridi on myös liuotin ja siksi siitä on hyötyä poolittomien aineiden, kuten öljyjen ja rasvojen, liuottamisessa.
Hiilitetrakloridilla on monia eri käyttökohteita, ja sitä on käytetty puhdistusaineena, jäähdytysaineena ja palonsammuttimissa. Hiilitetrakloridia käytetään usein laavalamppujen valmistuksessa, jolloin vaha muuttuu raskaammaksi.
”… Onko hiilimolekyyli vuorattu ajatuksella?” – Saul Bellow
Hiilitetrakloridin ympäristövaikutusten vuoksi sen tuotanto on vähentynyt jyrkästi 1980-luvulta lähtien. Montréalin pöytäkirjalla rajoitettiin kloorifluorihiilivetyjen tuotantoa, ja koska hiilitetrakloridi on keskeinen ainesosa CFC-yhdisteiden valmistuksessa, hiilitetrakloridin tuotanto on tämän seurauksena vähentynyt jyrkästi. Hiilitetrakloridin haitalliset terveysvaikutukset ovat myös vähentäneet sen tuotantoa, ja vaikka sitä käytettiin aikoinaan laajalti liuottimena, sitä käytetään nykyään harvoin tällaisiin tarkoituksiin.
Hiilitetrakloridi on erittäin myrkyllistä maksalle, ja muita maksaa vahingoittavia aineita verrataan usein hiilitetrakloridin myrkyllisyyteen. Korkeat pitoisuudet hiilitetrakloridia voivat vahingoittaa maksan lisäksi myös munuaisia. Pitkäaikainen altistuminen hiilitetrakloridille voi aiheuttaa kooman tai kuoleman. Kemikaalille altistuminen voi myös lisätä mahdollisuutta sairastua syöpään.
Miksi hiilitetrakloridi on poolinen?
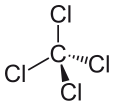
Kun olemme nähneet, mikä tekee molekyylistä poolisen, ja tarkastelleet joitakin esimerkkejä poolisista molekyyleistä, voimme nyt paremmin ymmärtää, miksi hiilitetrakloridi on pooliton molekyyli. Ensimmäinen asia, joka on tehtävä, kun yritetään määrittää, onko molekyyli poolinen vai pooliton, on laskea molekyylin sisällä olevien atomien elektronegatiivisuusarvot. Kahden atomin välisen sidoksen poolisuus on selvitettävä, ja kaikki sidokset on otettava huomioon, kun yritetään määrittää molekyylin poolisuutta. Hiilitetrakloridin tapauksessa kloridin ja hiilen elektronegatiivisuusarvojen ero ei kuitenkaan ole ainoa huomioon otettava tekijä. Myös molekyylin muoto on otettava huomioon. Vaikka molekyylissä on dipoleja, hiilitetrakloridin lineaarinen muoto tarkoittaa, että molekyylin eri dipolimomenttien vaikutukset kumoavat toisensa, ja molekyyli on tämän seurauksena neutraali tai pooliton.