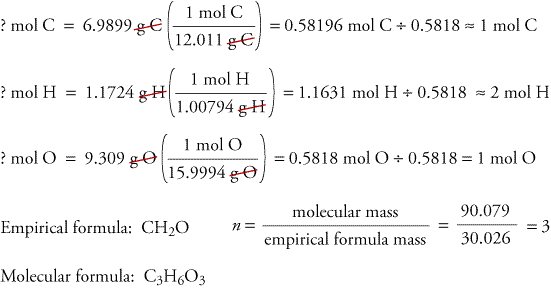Empiiristen ja molekyylikaavojen saaminen palamistiedoista
Yhdisteiden, jotka sisältävät vain hiiltä ja vetyä (CaHb) tai hiiltä, vetyä ja happea (CaHbOc), empiiriset ja molekyylikaavat voidaan määritellä palamisanalyysiksi kutsutulla menetelmällä. Tämän menettelyn vaiheet ovat
Punnitse näyte analysoitavasta yhdisteestä ja aseta se alla olevassa kuvassa esitettyyn laitteeseen.
Polttakaa yhdiste kokonaan. Pelkkää hiiltä ja vetyä (CaHb) tai hiiltä, vetyä ja happea (CaHbOc) sisältävän yhdisteen ainoat palamistuotteet ovat hiilidioksidi ja vesi.
H2O ja hiilidioksidi vedetään kahden putken läpi. Toisessa putkessa on ainetta, joka imee vettä, ja toisessa ainetta, joka imee hiilidioksidia. Punnitse kumpikin näistä putkista ennen ja jälkeen palamisen. Ensimmäisen putken massan lisäys on palamisessa muodostuneen H2O:n massa ja toisen putken massan lisäys on muodostuneen CO2:n massa.
Asettele, että yhdisteen kaikki hiili on muuttunut CO2:ksi ja sitoutunut toiseen putkeen. Laske yhdisteen hiilen massa mitatun muodostuneen CO2:n massan hiilen massasta.
Aseta, että kaikki yhdisteen vety on muuttunut H2O:ksi ja jäänyt ensimmäiseen putkeen. Laske yhdisteen sisältämän vedyn massa mitatun veden massan sisältämän vedyn massasta.
Jos yhdiste sisältää hiilen ja vedyn lisäksi happea, laske hapen massa vähentämällä hiilen ja vedyn massa alkuperäisen yhdisteen näytteen kokonaismassasta.
Käytä näitä tietoja empiirisen ja molekyylikaavan määrittämiseen tavalliseen tapaan.
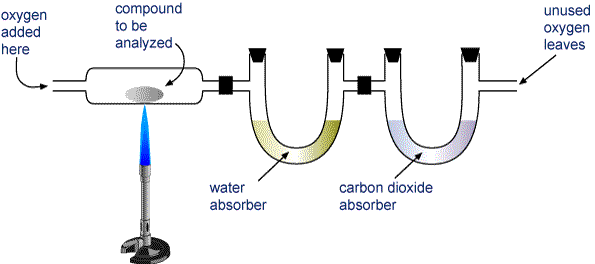
Palamisanalyysilaitteisto Hiiltä ja vetyä (CaHb) tai hiiltä, vetyä ja happea (CaHbOc) sisältävä yhdiste poltetaan kokonaan muodostaen H2O:ta ja CO2:ta. Tuotteet vedetään kahden putken läpi. Ensimmäiseen putkeen imeytyy vesi ja toiseen putkeen hiilidioksidi.
Katsotaanpa palamisanalyysistä saatujen tietojen perusteella, miten empiiriset ja molekyylikaavat voidaan määrittää, ja tarkastellaan ainetta nimeltä trioksaani. Formaldehydi, CH2O, on epästabiili puhtaana kaasuna, ja se muodostaa helposti seoksen aineesta nimeltä trioksaani ja polymeeristä nimeltä paraformaldehydi. Siksi formaldehydi liuotetaan liuottimeen, kuten veteen, ennen sen myyntiä ja käyttöä. Hiiltä, vetyä ja happea sisältävän trioksaanin molekyylikaava voidaan määrittää kahdesta eri kokeesta saatujen tietojen perusteella. Ensimmäisessä kokeessa poltetaan 17,471 g trioksaania yllä olevassa laitteessa, jolloin muodostuu 10,477 g H2O:ta ja 25,612 gCO2:ta. Toisessa kokeessa trioksaanin molekyylimassaksi saadaan 90,079.
Voidaan saada yhdisteen molekyylikaava sen empiirisestä kaavasta ja molekyylimassasta. (Katso tekstistä, miten tämä tehdään.) Saadaksemme empiirisen kaavan meidän on määritettävä hiilen, vedyn ja hapen massat grammoina 17,471 grammassa trioksaania. Meidän on siis suoritettava seuraavat yleiset vaiheet.
Ensiksi muunnetaan annetut tiedot hiilen, vedyn ja hapen grammamääriksi.
Toiseksi määritetään empiirinen kaava hiilen, vedyn ja hapen grammamääristä.
Kolmanneksi määritetään molekyylikaava empiirisestä kaavasta ja annetusta moolimassasta.
Koska oletamme, että kaikki trioksaanin hiili on reagoinutmuodostuakseen CO2:ksi, voimme löytää hiilen massan 17,471 g:ssa trioksaania laskemalla hiilen massan 25,612 g:ssa CO2:ta.
Kuva yksikköanalyysiasetelmasta, joka muuntaa 25,612 grammaa hiilidioksidia mooleiksi hiilidioksidia, joka muunnetaan mooleiksi hiiltä, joka muunnetaan grammoiksi hiiltä. Vastaus on 1,1724 grammaa vetyä.
Koska oletamme, että kaikki trioksaanin vety on reagoinut muodostaen H2O:ta,voimme löytää 17,471 g trioksaanin sisältämän vedyn massan laskemalla vedyn massan 10.477 g H2O.

Koska trioksaani sisältää vain hiiltä, vetyä ja happea, voimme laskea hapen massan vähentämällä hiilen ja vedyn massat trioksaanin kokonaismassasta.
? g O = 17,471 g trioksaania – 6,9899 g C – 1,1724 g H = 9.309 g O
Laskemme nyt empiirisen kaavan, empiirisen kaavan massan ja molekyylikaavan.
NäyteOpiskelulomake: Calculating Molecular Formulas from Combustion Data
Vinkki- Haluat laskea molekyylikaavan yhdisteelle, joka sisältää vain hiiltä ja vetyä (CaHb) tai hiiltä,vetyä ja happea (CaHbOc), ja sinulle on annettu sen molekyylimassa ja CO2:n ja H2O:n massat, jotka muodostuvat tietyn massan yhdisteen palamisessa.
Yleismenettely
Lasketaan yhdisteen sisältämän hiilen grammamäärä laskemalla tietyn CO2-määrän sisältämän hiilen grammamäärä.

Lasketaan yhdisteen sisältämän vedyn grammamäärä laskemalla vedyn grammamäärä annetussa H2O-määrässä.

Jos yhdiste sisältää happea, laske siinä olevan hapen grammamäärä vähentämällä hiilen ja vedyn massat yhdisteen annetusta kokonaismassasta.
? g O = (annettu) g kokonaismassa – (laskettu) g C – (laskettu) g H
Lasketaan hiilen, vedyn ja hapen grammamääristä yhdisteen empiirinen kaava
Lasketaan empiirisen kaavan kaavan kaavan massat ja jaetaan annettu molekyylimassa empiirisen kaavan massalla saadaksemme n.
Kerro jokainen empiirisen kaavan alaviite n:llä saadaksesi molekyylikaavan.
ESIMERKKI – Molekyylikaavan saaminen polttotiedoista:
Dianabol on yksi anabolisista steroideista, jota jotkut urheilijat ovat käyttäneet kasvattaakseen lihastensa kokoa ja voimaa. Se on samanlainen kuin mieshormoni testosteroni. Joidenkin tutkimusten mukaan lääkkeen toivotut vaikutukset ovat minimaaliset, ja sivuvaikutukset, joihin kuuluvat steriliteetti ja lisääntynyt maksasyövän ja sydänsairauksien riski, estävät useimpia ihmisiä käyttämästä sitä. Dianabolin molekyylikaava, joka koostuu hiilestä, vedystä ja hapesta, voidaan määrittää kahdesta eri kokeesta saatujen tietojen perusteella. Ensimmäisessä kokeessa poltetaan 14,765 g Dianabolia, jolloin muodostuu 43,257 g CO2:ta ja 12,395 g H2O:ta.Toisessa kokeessa Dianabolin molekyylimassaksi saadaan 300,44. Mikä on Dianabolin molekyylikaava?
Liuos:

.