Apoptose

L’apoptose, ou mort cellulaire programmée, est un moyen hautement régulé pour un organisme d’éliminer sélectivement des cellules. Ce processus joue un rôle important dans l’embryogenèse, le maintien de la taille d’un organisme et l’élimination des cellules endommagées ou aberrantes. L’importance de l’apoptose dans la santé humaine est soulignée par les nombreuses maladies résultant d’une apoptose aberrante. La dérégulation de l’apoptose a été liée à divers cancers, à des troubles neurologiques et cardiovasculaires et à des maladies auto-immunes.
Nous distinguons communément deux types d’apoptose : la voie intrinsèque, médiée par les mitochondries en réponse à des stimuli internes tels que les lésions de l’ADN, et la voie extrinsèque, médiée par des récepteurs de mort extracellulaires (par exemple, la liaison de FasL au récepteur FasLG) (figure 1). Les deux voies reposent sur des protéases appelées caspases initiatrices qui activent une cascade de caspases effectrices, conduisant à l’apoptose. La diaphonie entre les voies intrinsèque et extrinsèque est médiée par l’agoniste de mort à domaine d’interaction BH-3 (Bid).
La voie intrinsèque (Figure 1) est initiée par les protéines d’homologie Bcl-2. Dans la voie classique de l’apoptose, les protéines Bax et Bak de Bcl-2 sont activées en réponse à des stimuli internes tels que les lésions de l’ADN ou le stress oxydatif. Ces deux protéines interagissent ensuite avec Bid et sont insérées dans la membrane mitochondriale externe. Il en résulte ce qui est considéré comme le point de non-retour de l’apoptose – la perméabilisation de la membrane externe mitochondriale (MOMP). La MOMP entraîne la libération de facteurs pro-apoptotiques tels que le cytochrome c dans le cytoplasme. Le cytochrome c dans le cytoplasme se lie à APAF-1 et au dATP pour recruter la pro-caspase- 9, formant ainsi l’apoptosome. La formation de l’apoptosome déclenche le clivage de la pro-caspase-9 en sa forme protéase active, la caspase-9. La caspase-9 est une caspase initiatrice qui active ensuite les caspases effectrices en aval, telles que la caspase-3 et -7, par protéolyse, déclenchant la cascade de caspases qui conduit à l’apoptose.
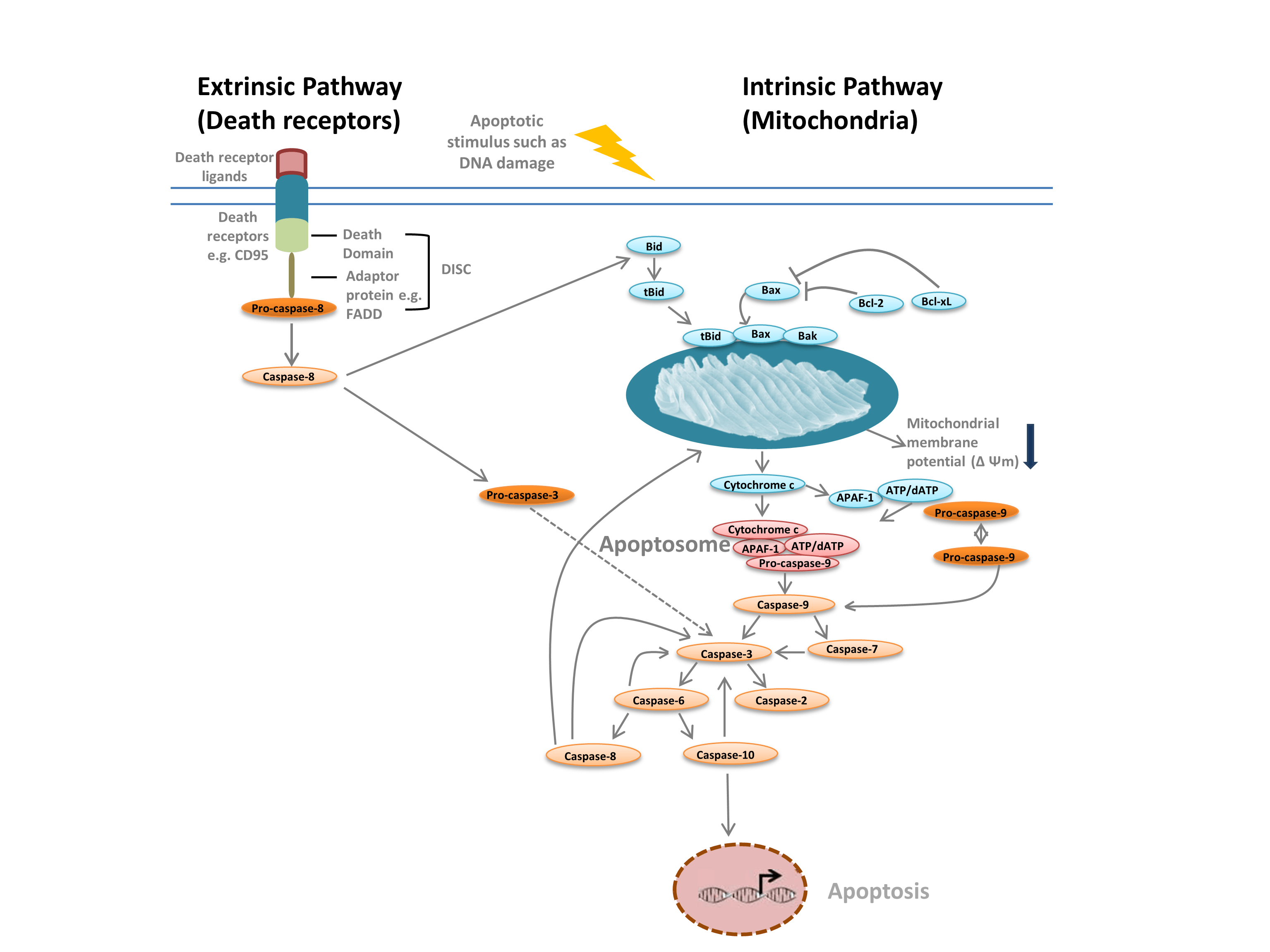
Fig. 1. Voies de l’apoptose.
La voie extrinsèque est déclenchée par la liaison des ligands aux récepteurs de la mort. Lors de la liaison du ligand, les récepteurs de la mort s’oligomérisent et recrutent des protéines adaptatrices telles que FADD. Cela permet le recrutement de la pro-caspase-8, la forme inactive de la caspase-8 initiatrice, et la formation du complexe de signalisation induisant la mort (DISC). La pro-caspase-8 s’oligomérise et est clivée en sa forme active, la caspase-8, qui à son tour clive et active la caspase-3 effectrice. La caspase-3 active à son tour de manière protéolytique diverses autres caspases, conduisant ainsi à l’apoptose. Dans certains cas, l’activation de la voie extrinisique peut également conduire à l’activation de la voie intrinsèque, médiée par Bid.
L’apoptose se distingue de la mort cellulaire non programmée/nécrose. La nécrose est un processus non régulé initié par un dommage externe et diffère de l’apoptose de plusieurs façons essentielles (tableau 1). Cependant, à mesure que nous en avons appris davantage sur l’apoptose et la nécrose et que nous avons identifié de nouveaux mécanismes de mort cellulaire tels que la nécroptose, les limites entre l’apoptose et la nécrose sont devenues plus floues. Les caractéristiques distinctives décrites dans le tableau 1 restent cependant des lignes directrices utiles.
Tableau 1. Caractéristiques de l’apoptose et de la nécrose.
| Apoptose | Nécrose | |
| Cellules rétrécissent | Cellules gonflent | |
| Phagocytes/macrophages engloutissent les cellules | Les débris cellulaires sont libérés | . débris cellulaires sont libérés |
| Le processus est non inflammatoire | Le processus est inflammatoire |
Il est utile de diviser ce processus en étapes lors de l’analyse de l’apoptose :
- L’apoptose est initiée et les cascades de signalisation sont activées
- Les cellules rétrécissent et s’arrondissent, médiée par les caspases
- Les organelles changent de forme et les membranes commencent à saigner
- La condensation nucléaire commence
- La fragmentation de l’ADN peut être observée
- Les corps apoptotiques sont formés
- Les corps apoptotiques sont phagocytés
Ces étapes apoptotiques, ainsi que les médiateurs connus de l’apoptose, peuvent être utilisés comme identificateurs de l’apoptose. Lorsque vous choisissez un test d’apoptose, réfléchissez à la question que vous souhaitez poser – les tests d’activité des caspases sont d’excellents indicateurs de l’initiation de l’apoptose tandis que les tests de fragmentation de l’ADN peuvent être utilisés pour identifier les cellules dans les derniers stades de l’apoptose, lorsqu’elles sont irréversiblement engagées dans la mort cellulaire programmée.
Lorsque l’on effectue des tests d’apoptose, il est toujours sage d’inclure des colorants de viabilité tels que l’iodure de propidium (PI) pour différencier les cellules apoptotiques des cellules nécrotiques et d’inspecter visuellement les cellules ou les tissus au microscope pour les indicateurs morphologiques clés de l’apoptose.
Évaluer l’apoptose
1. Changements morphologiques
L’imagerie à intervalles de temps de cellules vivantes peut être utilisée pour suivre l’apoptose en temps réel et est particulièrement utile pour identifier les saignements de membrane. Pour les tissus, la microscopie électronique à transmission peut être utilisée pour identifier un grand nombre des changements structurels qui accompagnent les étapes de l’apoptose. Les tissus peuvent également être colorés à l’hématoxyline et à l’éosine pour visualiser les macrophages qui ont englouti les cellules apoptotiques. L’orange acridine (AO) est un autre colorant couramment utilisé pour visualiser les cellules apoptotiques. Ce colorant populaire de viabilité et de prolifération peut être utilisé pour évaluer l’apoptose car son spectre d’émission passe à l’orange lorsqu’il se trouve dans l’environnement acide du lysosome, ce qui rend le colorant utile pour identifier les cellules apoptotiques englouties. Les colorants liant l’ADN tels que le DAPI, le Hoechst, l’iodure de propidium (PI) et le 7-AAD peuvent être utilisés pour visualiser le blanchiment nucléaire tandis que le rétrécissement cellulaire peut être détecté soit dans un cytomètre en flux comme une réduction de la diffusion vers l’avant (FSC), soit visuellement en utilisant la microscopie optique.
2. Changements du potentiel de la membrane mitochondriale
Les changements du potentiel de la membrane indiquent qu’une cellule a dépassé le point de non-retour et est maintenant engagée dans l’apoptose. Un effondrement du potentiel de la membrane mitochondriale peut être détecté par cytométrie de flux ou immunofluorescence en utilisant des colorants potentiométriques.
L’ester éthylique de tétraméthylrhodamine (TMRE), l’ester méthylique de tétraméthylrhodamine (TMRM) et le JC-1 sont des colorants potentiométriques couramment utilisés. Le TMRE et le TMRM s’agrègent dans les mitochondries des cellules non apoptotiques et émettent une fluorescence orange ou rouge vif. Dans les cellules apoptotiques dont le potentiel de la membrane mitochondriale est réduit, ces colorants sont présents dans tout le cytoplasme sous leur forme monomère et présentent une fluorescence rouge réduite. Ces colorants peuvent être utilisés en combinaison avec les tests FLICA (fluorophore labeled inhibitor of caspase assays) (voir section suivante) pour identifier les cellules apoptotiques sur la base de deux caractéristiques : la rupture du potentiel de la membrane mitochondriale et l’activation des caspases (figure 2).
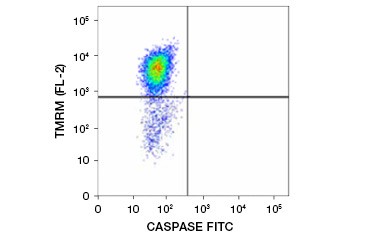
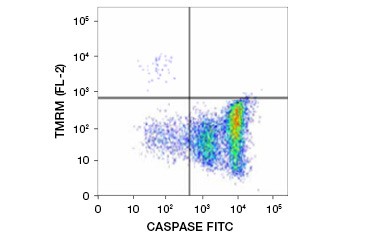
Fig. 2. Détection de la réduction du potentiel de la membrane mitochondriale et de l’activation des caspases par cytométrie de flux. La perte simultanée de la fluorescence orange du TMRM et l’augmentation de la fluorescence verte, montrant l’activation des caspases mesurée par le kit FAM-FLICA Polycaspase, montre des cellules apoptotiques (quadrant inférieur droit).
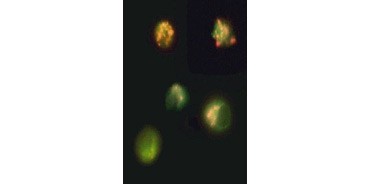
Fig. 3. Rupture du potentiel de la membrane mitochondriale visualisée à l’aide de JC-1. Les cellules Jurkat ont été colorées avec le MitoPT JC-1. Les cellules non apoptotiques (en haut) présentent des mitochondries colorées en rouge tandis que les cellules à différents stades d’apoptose présentent une fluorescence cytoplasmique verte.
Le JC-1 s’agrège également dans les mitochondries des cellules non apoptotiques et se retrouve diffusé dans toute la cellule dans les cellules apoptotiques. Contrairement au TMRE et au TMRM , qui présentent une fluorescence réduite, le JC-1 change de couleur, passant du rouge au vert. Cela permet de distinguer facilement les cellules non apoptotiques fluorescentes rouges des cellules apoptotiques fluorescentes vertes (Figure 3). Ces essais peuvent être lus à l’aide d’un microscope à fluorescence, d’un cytomètre en flux ou d’un lecteur de microplaques convenablement équipé.
3. Activation de la caspase
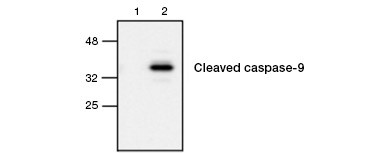
Fig. 4. La caspase-9 active est détectée par western blot. Analyse par western blot de cellules non traitées (lane 1) et traitées à l’étoposide (lane 2) sondées avec l’anticorps Rabbit anti-caspase-9 (actif). La caspase-9 active et clivée n’est détectée que lors de l’induction de l’apoptose par l’étoposide.
L’activation de la caspase est une caractéristique déterminante de l’apoptose. Les caspases apoptotiques clés couramment dosées sont les caspases initiatrices 3, 6 et 7 et les caspases effectrices 2, 8, 9 et 10. L’activation des caspases peut être identifiée soit par la taille réduite des pro-caspases lorsqu’elles sont clivées, soit par l’utilisation d’anticorps qui interagissent uniquement avec la forme clivée et activée (figure 4). Les deux approches peuvent être lues à l’aide du western blotting, tandis que la dernière approche peut également être adaptée aux tests de fluorescence et d’immunohistochimie en choisissant des anticorps conjugués à des fluorophores ou à la biotine. Ces tests sont compatibles avec les cellules fixées et non fixées.
Une chose qu’il faut garder à l’esprit est que les caspases initiatrices sont très en amont dans la voie de signalisation de l’apoptose et que leur activation n’entraîne pas toujours l’apoptose. Il est donc judicieux de coupler les tests pour les caspases initiatrices avec ceux pour les caspases effectrices ou, mieux encore, avec des sondes pour les événements en aval du point de non-retour, comme le MOMP.
Une autre classe de tests d’activation des caspases est constituée de substrats de caspases marqués par un fluorophore, comme les tests FLICA. Les tests FLICA se lient de manière covalente et irréversible aux caspases activées ; tout inhibiteur non lié diffuse hors des cellules et/ou peut être éliminé par des lavages. Ces inhibiteurs sont disponibles fusionnés à des colorants rouges ou verts. L’intensité de la fluorescence peut être utilisée comme une mesure quantitative de l’activité des caspases – les cellules apoptotiques avec une forte activité des caspases seront plus fluorescentes que celles avec une faible activité des caspases. Les tests FLICA sont compatibles avec les cellules vivantes, les coupes de tissus et les coupes fines congelées, mais pas avec les cellules fixées ou les tissus inclus en paraffine, et peuvent être lus en quantifiant l’intensité de fluorescence à l’aide de la microscopie à fluorescence, de la cytométrie en flux (figure 2) ou d’un lecteur de microplaques.
Pour tirer des conclusions solides des tests d’activité des caspases, il est toujours sage de choisir plus d’une cible.
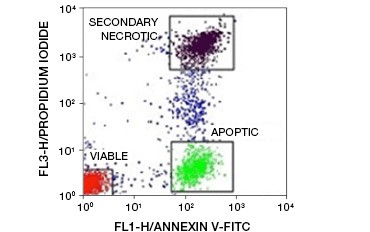
Fig. 5. Les conjugués d’annexine-V peuvent être utilisés pour distinguer les cellules apoptotiques des cellules nécrotiques et viables. Dot-plot montrant les cellules de Ramos colorées avec l’annexin V:FITC par rapport à l’iodure de propidium. Trois populations distinctes peuvent être observées.
4. Externalisation de la phosphatidylsérine
Une caractéristique clé de l’apoptose qui est détectable même dans les premiers stades est l’externalisation de la phosphatidylsérine (PS), un phospholipide trouvé exclusivement dans la membrane interne des cellules saines. L’annexin-V se lie à la phosphatidylsérine et les conjugués d’annexin-V peuvent donc être utilisés pour évaluer l’apoptose. Ces tests sont généralement réalisés par cytométrie de flux en utilisant de l’annexin-V marquée par un fluorophore. En combinant ce colorant avec un colorant de viabilité quelconque, tel que le PI, les cellules apoptotiques peuvent être distinguées des cellules nécrotiques. Dans ces expériences de cytométrie en flux bicolore, trois populations sont facilement distinguables : les cellules viables doublement négatives annexin-V/PI, les cellules apoptotiques positives/PI négatives annexin-V, et les cellules nécrotiques secondaires doublement positives annexin-V/PI
(Figure 5).
L’externalisation de la phosphatidylsérine est un processus dynamique et réversible jusqu’à ce qu’une cellule soit engagée dans l’apoptose après le MOMP. En utilisant les conjugués de l’annexin-V, il est impossible de distinguer les stades précoces et réversibles de l’apoptose des stades ultérieurs de l’apoptose, lorsqu’une cellule est engagée dans la mort. Les sondes pSIVA (indicateur de viabilité et d’apoptose sensible à la polarité) sont des biocapteurs qui se lient de manière réversible à la PS et s’allument et s’éteignent lorsque la PS passe de la membrane externe à la membrane interne (figure 6). Un autre avantage du test pSIVA est que, contrairement aux conjugués d’annexine-V, les sondes pSIVA peuvent être ajoutées directement à vos cellules sans étape de lavage. Ce test peut être lu en utilisant l’immunocytochimie et la microscopie à immunofluorescence, y compris l’imagerie des cellules vivantes, ce qui permet de comparer facilement les différences de taux d’apoptose en réponse à différents traitements expérimentaux en temps réel. Puisque l’apoptose est surveillée en temps réel, ce test n’est pas compatible avec les cellules fixées.
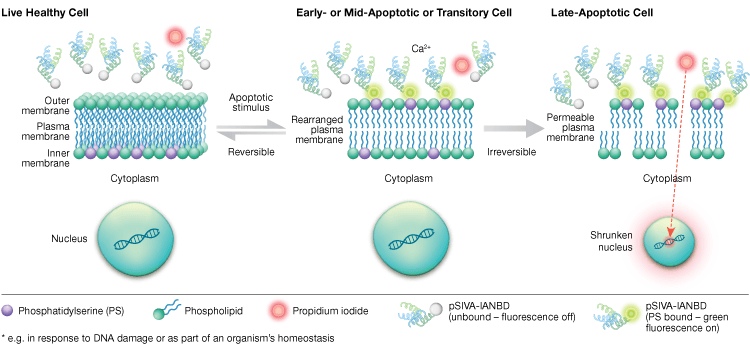
Fig. 6. Le test pSIVA peut distinguer les cellules vivantes, apoptotiques précoces et apoptotiques tardives en surveillant l’externalisation et l’internalisation de la phosphatidylsérine en temps réel.
5. Fragmentation de l’ADN
La fragmentation de l’ADN est l’une des étapes ultérieures de l’apoptose et est couramment analysée par la détection de l’échelonnement de l’ADN à l’aide d’une électrophorèse à base d’agarose ou de la méthode de marquage à l’extrémité de l’entaille de la désoxynucléotidyl transférase terminale (TUNEL).
Une caractéristique déterminante de l’apoptose est la fragmentation de l’ADN en fragments de ~180 pb par les endonucléases activées par la caspase. L’ADN génomique extrait passé sur un gel d’agarose présentera donc un échelonnement caractéristique de l’ADN qui n’est pas observé dans les cellules mourant par d’autres mécanismes, comme la nécrose.
La méthode TUNEL est une autre façon de détecter la création d’oligonucléosomes par l’endonucléase activée par la caspase. Le clivage de l’ADN entraîne la formation de groupes 3′ hydroxyle (groupes 3′-OH). Le test TUNEL utilise l’enzyme terminal déoxynucléotidyl transférase (TdT) pour ajouter du BrdU à ces groupes 3′-OH. Le BrdU incorporé peut ensuite être détecté à l’aide d’anticorps anti-BrdU marqués à la biotine ou à un fluorophore. Ce test est compatible avec la cytométrie en flux, ainsi qu’avec l’immunohistochimie et l’immunofluorescence, et peut être converti en lecture de radiomarqueur en utilisant -TdR au lieu de BrdU. Les cellules doivent être fixées après l’incorporation de BrdU avant la coloration.
La fragmentation de l’ADN peut également être mesurée par cytométrie de flux en utilisant le test sub-G1. Les petits fragments d’ADN, ~180 pb, générés au cours de l’apoptose s’échappent des cellules, diminuant le contenu total en ADN des cellules apoptotiques. En colorant l’ADN avec du PI, les cellules apoptotiques hypodiploïdes peuvent être comptées dans le pic sub-G1 de l’histogramme PI.
6. Panneaux de marqueurs d’apoptose multiplex
Enfin, de nombreux vendeurs vendent des panneaux pour l’analyse immunologique multiplex des populations cellulaires. Ces panels peuvent doser plusieurs marqueurs d’apoptose à la fois.
Quoi qu’il en soit de la méthode utilisée pour détecter l’apoptose, il faut inclure des contrôles appropriés, car les conditions expérimentales et le type de cellule peuvent altérer les performances de certains dosages. Toujours inclure des contrôles positifs et négatifs. Inclure des contrôles traités par véhicule pour tenir compte des effets des solvants, des contrôles spécifiques à l’application pour contrôler des facteurs tels que l’autofluorescence dans les expériences d’immunofluorescence, et des contrôles de charge pour le western blotting.
Tableau 2. Résumé des essais pour détecter les marques de l’apoptose.
| Stade de l’apoptose | Réactifs permettant la détection | Application |
| Conjugués de l’annexine-V à la SP flipping | , sondes pSIVA | Cytométrie de flux, microscopie |
| Cascades de signalisation initiées | FLICA, anticorps caspase | Cytométrie en flux, microscopie, western blot |
| MOMP | TMRM, TMRE, JC-1 | Cytométrie en flux, microscopie, lecteur de microplaques |
| Rétrécissement cellulaire | Cytométrie en flux, microscopie | |
| Saignement des membranes | hématoxyline + éosine | Microscopie |
| Condensation nucléaire | DAPI, Hoechst, PI, 7-AAD | Microscopie |
| Fragmentation de l’ADN | TUNEL, Test Sub-G1, laddering ADN | Gel d’agarose, cytométrie en flux, microscopie |
| Phagocytose des corps apoptotiques | Acridine orange, hématoxyline + éosine | Cytométrie en flux, microscopie optique et électronique |
.