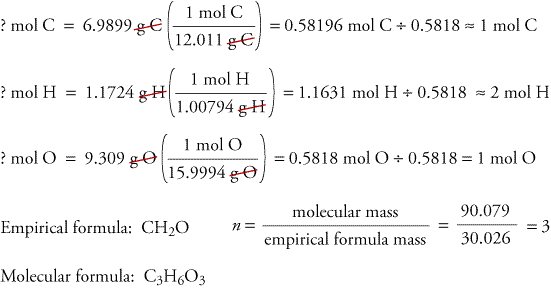Obtention des formules empiriques et moléculaires à partir des données de combustion
Les formules empiriques et moléculaires des composés qui contiennent seulement du carbone et de l’hydrogène (CaHb) ou du carbone, de l’hydrogène et de l’oxygène (CaHbOc) peuvent être déterminées avec un procédé appelé analyse de combustion. Les étapes de cette procédure sont les suivantes
Peser un échantillon du composé à analyser et le placer dans l’appareil montré dans l’image ci-dessous.
Combustion complète du composé. Les seuls produits de la combustion d’un composé qui ne contient que du carbone et de l’hydrogène (CaHb) ou du carbone, de l’hydrogène et de l’oxygène (CaHbOc) sont le dioxyde de carbone et l’eau.
L’H2O et le CO2 sont aspirés dans deux tubes. Un tube contient une substance qui absorbe l’eau, et l’autre une substance qui absorbe le dioxyde de carbone. Pesez chacun de ces tubes avant et après la combustion. L’augmentation de la masse dans le premier tube est la masse de H2O qui s’est formée lors de la combustion, et l’augmentation de la masse pour le second tube est la masse de CO2 formée.
Supposez que tout le carbone du composé a été converti en CO2 et piégé dans le second tube. Calculez la masse de carbone dans le composé à partir de la masse de carbone dans la masse mesurée de CO2 formée.
Supposez que tout l’hydrogène dans le composé a été converti en H2O et piégé dans le premier tube. Calculez la masse d’hydrogène dans le composé à partir de la masse d’hydrogène dans la masse d’eau mesurée.
Si le composé contient de l’oxygène ainsi que du carbone et de l’hydrogène, calculez la masse de l’oxygène en soustrayant la masse de carbone et d’hydrogène de la masse totale de l’échantillon initial de composé.
Utilisez ces données pour déterminer les formules empiriques et moléculaires de la manière habituelle.
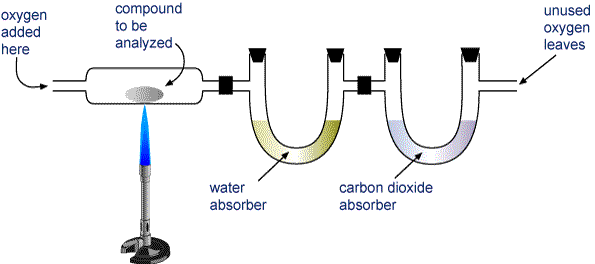
Appareil d’analyse de combustion Un composé contenant du carbone et de l’hydrogène (CaHb) ou du carbone, de l’hydrogène et de l’oxygène (CaHbOc) est brûlé complètement pour former H2O et CO2. Les produits sont aspirés à travers deux tubes. Le premier tube absorbe l’eau, et le second tube absorbe le dioxyde de carbone.
Pour illustrer comment les formules empiriques et moléculaires peuvent être déterminées à partir des données issues de l’analyse de la combustion, considérons une substance appelée trioxane. Le formaldéhyde, CH2O, est instable en tant que gaz pur, formant facilement un mélange d’une substance appelée trioxane et d’un polymère appelé paraformaldéhyde. C’est pourquoi le formaldéhyde est dissous dans un solvant, comme l’eau, avant d’être vendu et utilisé. La formule moléculaire du trioxane, qui contient du carbone, de l’hydrogène et de l’oxygène, peut être déterminée à partir des données de deux expériences différentes. Dans la première expérience, 17,471 g de trioxane sont brûlés dans l’appareil illustré ci-dessus, et 10,477 g de H2O et 25,612 g de CO2 sont formés. Dans la deuxième expérience, on constate que la masse moléculaire du trioxane est de 90,079.
On peut obtenir la formule moléculaire d’un composé à partir de sa formule empirique et de sa masse moléculaire. (Pour obtenir la formule empirique, nous devons déterminer la masse en grammes du carbone, de l’hydrogène et de l’oxygène dans 17,471 g de trioxane. Nous devons donc effectuer ces étapes générales.
Premièrement, convertir les données données données en grammes de carbone, d’hydrogène et d’oxygène.
Deuxièmement, déterminer la formule empirique à partir des grammes de carbone, d’hydrogène et d’oxygène.
Troisièmement, déterminer la formule moléculaire à partir de la formule empirique et de la masse moléculaire donnée.
Parce que nous supposons que tout le carbone du trioxane a réagipour se former en CO2, nous pouvons trouver la masse de carbone dans 17,471 g de trioxaneen calculant la masse de carbone dans 25,612 g de CO2.

Parce que nous supposons que tout l’hydrogène du trioxane a réagi pour former H2O,nous pouvons trouver la masse d’hydrogène dans 17,471 g de trioxane en calculant la masse d’hydrogène dans 10.477 g H2O.

Parce que le trioxane ne contient que du carbone,de l’hydrogène et de l’oxygène, on peut calculer la masse de l’oxygène en soustrayant les masses de carbone et d’hydrogène de la masse totale du trioxane.
? g O = 17,471 g trioxane – 6,9899 g C – 1,1724 g H = 9.309 g O
Nous calculons maintenant la formule empirique, la masse de la formule empirique et la formule moléculaire.
EchantillonFiche d’étude : Calcul des formules moléculaires à partir des données de combustion
Tip-off- Vous voulez calculer la formule moléculaire d’un composécontenant uniquement du carbone et de l’hydrogène (CaHb) ou du carbone,de l’hydrogène et de l’oxygène (CaHbOc), et on vous donne sa masse moléculaire et les masses de CO2 et de H2Oformées lors de la combustion d’une masse donnée du composé.
Procédure générale
Calculer le nombre de grammes de carbone dans le composé en calculant le nombre de grammes de carbone dans la quantité donnée de CO2.

Calculer le nombre de grammes d’hydrogène dans le composé en calculant le nombre de grammes d’hydrogène dans la quantité donnée de H2O.

Si le composé contient de l’oxygène, calculer le nombre de grammes d’oxygène qu’il contient en soustrayant les masses de carbone et d’hydrogène de la masse totale donnée du composé.
? g O = (donné) g total – (calculé) g C – (calculé) g H
Calculez la formule empirique du composé à partir des grammes de carbone, d’hydrogène et d’oxygène.
Calculez la masse de la formule empirique et divisez la masse moléculaire donnée par la masse de la formule empirique pour obtenir n.
Multiplier chacun des indices de la formule empirique par n pour obtenir la formule moléculaire.
EXEMPLE – Obtention d’une formule moléculaire à partir de données de combustion :
Le diabol est l’un des stéroïdes anabolisants qui a été utilisé par certainsathlètes pour augmenter la taille et la force de leurs muscles. Il est similaire à l’hormone mâle testostérone. Certaines études indiquent que les effets désirés du médicament sont minimes et que les effets secondaires, qui comprennent la stérilité et un risque accru de cancer du foie et de maladie cardiaque, empêchent la plupart des gens de l’utiliser. La formule moléculaire du Dianabol, qui se compose de carbone, d’hydrogène et d’oxygène, peut être déterminée à partir des données de deux expériences différentes. Dans la première expérience, 14,765 g de Dianabol sont brûlés, et 43,257 g de CO2 et 12,395 g de H2O sont formés.Dans la seconde expérience, la masse moléculaire du Dianabol est de 300,44. Quelle est la formule moléculaire du Dianabol ?
Solution:

.