DOI : 10.17235/reed.2016..4095/2016
ORIGINAL PAPERS
Association entre la localisation des polypes du côlon au départ et la coloscopie de surveillance – Une étude rétrospective
Ana Oliveira, Paulo Freire, Paulo Souto, Manuela Ferreira, Sofia Mendes, Clotilde Lérias, Pedro Amaro, Francisco Portela et Carlos Sofia
Département de gastroentérologie. Centro Hospitalar e Universitário de Coimbra. Coimbra, Portugal.
Correspondance
ABSTRACT
Introduction : Plusieurs facteurs sont utilisés pour stratifier la probabilité de récidive des polypes. Cependant, il n’existe pas d’études corrélant la localisation des polypes initiaux et des récidives. L’objectif de cette étude était de vérifier si la localisation des polypes lors de la coloscopie de surveillance était corrélée à la localisation des polypes précédemment excisés lors de la coloscopie initiale.
Méthodes : Une étude rétrospective de patients soumis à une coloscopie avec présence et excision de tous les polypes, suivie d’une coloscopie de surveillance. La localisation des polypes a été divisée en proximal/distal de la flexure splénique et du rectum. Les caractéristiques et les taux de récurrence au même endroit du côlon ont également été évalués.
Résultats : Sur les 346 patients qui ont subi une coloscopie répétée, 268 (77,4%) ont eu au moins 1 polype détecté. Pour tous les segments, il y avait un risque accru de polypes récurrents au même endroit et il était environ quatre fois plus élevé dans les segments du côlon proximal (OR 3,5 ; CI 2,1-6,0) et distal (OR 3,8 ; CI 2,1-6,8), puis trois fois plus élevé dans le rectum (OR 2,6 ; CI 1,5-4,6). Aucune différence n’a été trouvée entre les taux de récidive dans le même segment, en tenant compte de la morphologie du polype, de sa taille, de la technique de polypectomie employée et de la classification histologique.
Conclusion : Il semble y avoir une association significative entre la localisation des polypes au départ et la coloscopie de surveillance.
Mots clés : Colon. Polype. Emplacement. Récidive.
Introduction
Les adénomes du côlon et du rectum sont des lésions néoplasiques bénignes courantes découvertes chez environ 25% des patients soumis à une coloscopie (1). Le cancer colorectal (CCR) est le troisième cancer le plus fréquent et la quatrième cause de décès par cancer dans le monde (2). La coloscopie ainsi que la détection et la résection endoscopiques des lésions précancéreuses entraînent une réduction de l’incidence et de la mortalité dues au CCR (3). Cette réduction du risque semble être plus forte pour le côlon distal. Néanmoins, une réduction de 77 % de l’incidence et une diminution de 29 à 37 % des décès liés au CCR ont été observées avec la coloscopie (4,5). La coloscopie de surveillance est recommandée chez les patients ayant déjà eu des polypes adénomateux, en raison du risque de lésions métachrones, récurrentes et nouvelles (6). Le risque de trouver des adénomes lors de la coloscopie de surveillance dépend des résultats de la coloscopie initiale. Le taux est plus élevé chez les patients présentant des adénomes avancés, intermédiaire chez les adénomes non avancés, et plus faible chez les patients ne présentant pas d’adénomes (7). Malgré l’importance de la coloscopie, des cancers du côlon sont découverts à intervalles réguliers après une coloscopie antérieure avec polypectomie ou des résultats négatifs (3,8). Cela peut être dû à plusieurs facteurs, comme des lésions manquées, la récurrence de polypes enlevés de manière incomplète ou de nouvelles lésions qui se sont développées depuis la coloscopie précédente (9). Plusieurs facteurs sont utilisés pour stratifier la probabilité de récurrence des polypes, notamment l’histologie, la taille et le nombre. Certaines études privilégient également le côlon proximal comme marqueur de la récurrence future des adénomes (10), voire une certaine association entre la récurrence proximale ou distale (7,11). Ainsi, le but de cette étude était de vérifier si la localisation des polypes lors de la coloscopie de surveillance était associée à la localisation des polypes préalablement excisés lors de la coloscopie d’index.
Matériel et méthodes
Nous avons réalisé une étude rétrospective des patients soumis à deux coloscopies : une coloscopie d’index avec polypes et une coloscopie de surveillance avec ou sans polypes. Nous avons défini une association positive dans la récurrence des polypes au même endroit si au moins un polype métachrone à la coloscopie de surveillance se trouvait dans le même segment de côlon, comme un ou plusieurs de la coloscopie d’index.
Les patients ont été recrutés dans le service de gastroentérologie de janvier 2004 à décembre 2014. Les critères d’inclusion comprenaient les patients âgés de plus de 18 ans ayant subi deux coloscopies de haute qualité à au moins un an d’intervalle et l’excision de tous les polypes détectés lors de la coloscopie de référence. Les critères d’une coloscopie de haute qualité impliquaient qu’elle ait été réalisée par un coloscopiste expérimenté, que le degré de nettoyage des intestins évalué par l’échelle de préparation des intestins d’Ottawa (OBPS) soit excellent ou bon et que l’intubation cæcale soit réalisée. Les dossiers médicaux des patients ont été analysés. Nous avons recueilli les données démographiques des patients, notamment le sexe et l’âge. Les données des rapports de coloscopie ont été enregistrées, notamment le nombre de polypes, leur taille, leur morphologie et leur localisation, ainsi que la technique de résection. Les lésions ont été classées selon la classification de Paris (12). Les lésions non polypoïdes de type 0 et les polypes de plus de 20 mm ont été exclus. Nous avons classé la localisation des polypes en deux catégories : proximale ou distale par rapport à la flexion splénique et au rectum. La technique de résection a été divisée en résection avec pince à biopsie froide, excision standard au collet et injection sous-muqueuse suivie d’une résection. Ces données ont été recueillies lors des deux coloscopies. Le rapport histologique a été obtenu pour tous les polypes enlevés et récupérés lors des deux coloscopies. Le diagnostic histopathologique a été classé selon la classification révisée de Vienne (13). Les polypes ont également été classés en fonction de leur architecture glandulaire : tubulaire, tubulovillulaire, villositaire et dentelé. Ces données ont ensuite été utilisées pour stratifier les adénomes en adénomes avancés et non avancés. Ainsi, un adénome avancé était considéré comme tel lorsqu’il mesurait 1 cm ou plus et présentait une histologie villositaire ou une dysplasie de haut grade (6). Les analyses histologiques des marges de résection ont été classées comme suit : résection complète (R0), marges de résection n’ayant pu être évaluées complètement (Rx) ou présence d’une lésion résiduelle (R1). Les critères d’exclusion comprenaient les patients soumis à une chirurgie du côlon ou ayant des antécédents de CCR avant la coloscopie de base, une maladie intestinale inflammatoire ou un syndrome de polypose.
Le comité d’éthique a approuvé l’étude. Tous les auteurs ont eu accès aux données et ont revu et approuvé le manuscrit final.
Analyses statistiques
Nos données préliminaires indiquent que les polypes détectés lors de la coloscopie de surveillance apparaîtront au même endroit que ceux observés au départ dans au moins 20% des cas. En fixant l’α à 0,05, la puissance à 80 % et le rapport cas-témoins à 1:2, nous avons estimé que 195 patients seraient nécessaires.
Les variables catégorielles ont été exprimées en fréquence et en pourcentage. Les variables continues ont été exprimées en moyenne (dérivation standard, SD). Le test de Kolmogorov-Smirnov a été utilisé pour évaluer la normalité. Les variables catégorielles ont été comparées avec le test du Chi carré et les variables continues avec le test t de Student pour les données normalement distribuées ou le test U de Mann-Whitney si les données ne présentaient pas une distribution normale. Pour déterminer la concordance entre les résultats des deux coloscopies, le test de Kappa de Cohen a été utilisé. L’odds ratio (OR) a été calculé avec un intervalle de confiance (IC) de 95 % ; un IC n’incluant pas 1,0 indiquait qu’il existait une relation significative entre les variables. Les différences entre les données ont été considérées comme statistiquement significatives lorsque la valeur p bilatérale était inférieure à 0,05.
D’abord, les résultats des deux coloscopies ont été analysés. Ensuite, la concordance des taux de récidive pour le même emplacement dans la coloscopie de base et dans la coloscopie de surveillance a été calculée. Nous avons ensuite évalué les facteurs possibles qui pourraient contribuer à la récurrence des polypes au même endroit, tels que les caractéristiques des polypes ou les caractéristiques histologiques.
L’analyse des données a été effectuée à l’aide du progiciel statistique pour les sciences sociales-SPSS (SPSS Inc. USA), IBM®, logiciel informatique pour Mac OS X (version 21).
Résultats
Sur les 346 patients soumis à deux coloscopies de haute qualité avec des polypes à la coloscopie d’index, 78 n’avaient pas de polypes à la coloscopie de surveillance. Par conséquent, un total de 268 patients ont été inscrits à l’étude (Fig. 1). Les patients avaient un âge moyen de 64 (SD 10) ans, allant de 29 à 82 ans, avec une prédominance masculine (64,9%).
La période moyenne d’intervalle entre les deux coloscopies était de 37 (SD 20) mois.
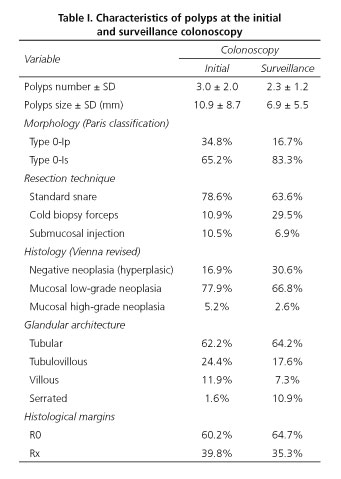
Les caractéristiques des polypes trouvés lors de la coloscopie initiale et de surveillance sont décrites dans le tableau I. Lors de la coloscopie initiale, le nombre moyen de polypes détectés et réséqués était de 3,0 (ET 2,0), et lors de la coloscopie de surveillance, ce nombre était inférieur à 2,3 (ET 1,2). En ce qui concerne les caractéristiques des polypes, lors de la première coloscopie, la taille moyenne était de 10,9 mm (écart-type 8,7) et lors de la deuxième coloscopie, les polypes étaient plus petits, mesurant en moyenne 6,9 mm (écart-type 5,5). Initialement, la morphologie était de type 0-Ip dans 34,8 % des cas et de type 0-Is dans 65,2 % des cas ; et lors de la deuxième coloscopie, nous avons continué à observer que la morphologie sessile était prédominante mais dans une proportion plus élevée, considérant que le pourcentage de polypes de type 0-Is était de 83,3 %. L’architecture glandulaire était similaire dans les deux cas, à l’exception de l’incidence plus élevée de polypes dentelés lors de la coloscopie de surveillance (1,6 % contre 10,9 %).
Lors de la coloscopie initiale, 42,5 % des patients avaient des polypes dans le côlon proximal, 75,0 % dans le côlon distal et 30,2 % dans le rectum. Lors de la coloscopie de surveillance, la répartition était similaire : 52,6 % dans le côlon proximal, 60,1 % dans le côlon distal et 25,0 % dans le rectum. Le taux de concordance global de la localisation des polypes entre les coloscopies était de 44 %. Le tableau II présente la probabilité de récidive dans le même segment du côlon. Pour tous les segments du côlon, il existe un risque accru de récurrence des polypes au même endroit. Ce risque est similaire pour les segments du côlon proximal (OR 3,5 ; IC 2,1-6,0) et distal (OR 3,8 ; IC 2,1-6,8), suivi par le rectum (OR 2,6 ; IC 1,5-4,6), p < 0,001. Les valeurs de Kappa étaient de 0,29 (IC 95 % ; 0,19-0,41) et 0,27 (0,16-0,38) pour le côlon proximal et distal, respectivement, montrant une force de concordance moyenne et 0,20 (IC 0,08-0,33) pour le rectum, signifiant une faible concordance, p < 0.001 (tableau III).


L’analyse des différents facteurs pouvant contribuer à la récurrence des polypes au même endroit ne montre aucune différence statistiquement significative (tableau IV). Cependant, il y avait une petite prédominance pour une récurrence plus élevée au même segment lorsque la résection était effectuée avec une injection sous-muqueuse (70,4%), par rapport aux pinces à biopsie (68,3%) et au collet (61,4%) et pour les polypes hyperplasiques (75,7%), par rapport aux polypes avec une dysplasie de bas grade (66,7%) ou de haut grade (66,7%). Il n’y avait pas de différence dans les marges histologiques, et bien que la Rx (68,1 %) ait été plus fréquente que la résection complète (53,3 %), cela n’avait pas de signification statistique (p = 0,511). Il n’y avait pas non plus de différence dans la probabilité de récidive au même endroit après stratification dans les adénomes avancés (70,8%), les adénomes non avancés (61,9%) et les adénomes hyperplasiques (75,7%), p = 0,216. Le délai entre les coloscopies n’était pas associé à la récurrence des polypes sur le même site (36 vs 38 mois).

Discussion
Dans notre étude, nous avons trouvé une association significative entre la localisation initiale du polype et celle de la récurrence. Pour tous les segments du côlon, la présence de polypes lors de la coloscopie initiale confère un risque significatif de récidive au même endroit lors de la coloscopie de surveillance. Ce risque est environ quatre fois plus élevé dans le côlon distal, suivi de près par le côlon proximal. Il y a plusieurs explications possibles à ce taux élevé de concordance de localisation. Tout d’abord, chez les patients ayant des antécédents de résection de polypes, le coloscopiste peut renforcer l’attention portée aux sites de détection antérieure de polypes. Une autre raison est liée à la résurgence de polypes due à une résection incomplète. Dans le but de réduire la résection incomplète comme facteur de récurrence, nous avons exclu les lésions plates et de grande taille. De plus, dans cette étude, les marges histologiques de la résection (lésion complète ou résiduelle) n’ont pas été impliquées dans le taux de récurrence. Le taux de polypes manquants est d’environ 20% et il augmente au fur et à mesure que la taille des lésions diminue (14). Les adénomes manquants peuvent également expliquer les polypes récurrents, bien que nous ayons essayé de réduire ce facteur en sélectionnant uniquement des coloscopies de haute qualité. Une autre possibilité pour ce taux élevé de concordance de localisation est liée au développement de nouvelles lésions. Ces nouvelles lésions peuvent être dues à l’absence d’un effet inhibiteur après l’ablation des polypes (7), ou à des effets locaux favorisant la carcinogenèse tels qu’une inflammation ou une blessure répétée/persistante (9). En outre, ces nouvelles lésions peuvent être associées à une voie de carcinogenèse différente et plus rapide. Il a été démontré que les cancers d’intervalle après polypectomie apparaissent plus fréquemment que prévu dans le segment de la polypectomie précédente (9). Cette étude renforce ces résultats précédents en démontrant que les polypes ont également tendance à récidiver au même endroit. Pour les cancers d’intervalle, les études montrent que 70 à 80 % sont principalement dus à des lésions manquantes plutôt qu’à de nouvelles lésions (15,16).
On sait que les taux de récurrence des adénomes sont estimés à environ 30-40 %, 3 à 4 ans après la coloscopie initiale (8,17). Le risque de récidive des adénomes lors de la coloscopie de surveillance dépend des résultats de la précédente. Le risque est plus élevé en cas d’adénomes avancés et/ou multiples (7,10,18). Avec cette hypothèse, nous avons analysé les caractéristiques des polypes (taille, morphologie et histologie), les marges de résection (présence de tissu hyperplasique ou adénomateux), et la technique utilisée pour réaliser la polypectomie. Nous n’avons trouvé aucun facteur statistiquement significatif qui pourrait contribuer à la récidive au même endroit. Même après stratification de l’adénome en adénome avancé, il n’y avait pas de facteur de récurrence.
Il ne semble pas y avoir de lien entre la probabilité de détection d’adénomes lors de la coloscopie de surveillance après une coloscopie ne comportant que des polypes hyperplasiques (19). Dans notre étude, nous avons constaté que lors de la deuxième coloscopie, il y avait un nombre accru de polypes hyperplasiques, bien que le type histologique ne contribue pas à la récurrence au même endroit. Cela peut être justifié comme une réaction locale qui induit une hyperprolifération de la muqueuse, puisque les polypes hyperplasiques sont composés de composants cellulaires normaux. Les lésions hyperplasiques peuvent acquérir des mutations, notamment K-ras, mais aussi BRAF, qui ont le potentiel de transformer ces lésions en cancer (20-22). Non seulement les polypes hyperplasiques mais aussi les polypes dentelés ont un potentiel CRC (23). Les polypes dentelés ont été identifiés plus fréquemment lors de la deuxième coloscopie (bien qu’ils n’aient pas contribué comme facteur de récurrence). Cela peut s’expliquer par des différences au moment où les pathologistes ont effectué leur analyse. Les polypes dentelés habituellement classés comme hyperplasiques sont maintenant classés dans le même groupe que les tumeurs dentelées. Les polypes dentelés sessiles ou les adénomes dentelés sont normalement petits ou plats, ils peuvent croître plus rapidement et progresser par une voie de cancérogenèse différente. Ils sont également associés à un taux plus élevé d’ablation incomplète (24,25).
Il y a des limites dans notre étude. La population étudiée comprend un petit échantillon, enregistré rétrospectivement, et elle a été réalisée dans un hôpital universitaire, donc ces Résultats peuvent ne pas être représentatifs de la population générale. Dans notre étude, nous n’avons pas inclus les facteurs de risque potentiels associés au développement du cancer/polypes tels que le tabagisme (26), la consommation de viande rouge et un indice de masse corporelle élevé (27), ni les facteurs de protection tels que l’acide acétylsalicylique ou les anti-inflammatoires non stéroïdiens (28) et l’ingestion de fruits (29). Bien que des coloscopistes hautement qualifiés aient effectué toutes les coloscopies, l’équipe comprenait plusieurs médecins qui ont changé entre la coloscopie de base et la coloscopie de surveillance. En outre, comme indiqué précédemment, la possibilité de manquer des adénomes doit toujours être prise en compte.
En conclusion, il semble y avoir une association significative dans la localisation des polypes au départ et à la coloscopie de surveillance. Cela pourrait avoir des implications futures en termes d’exécution technique et de précision des coloscopies, y compris un avertissement pour une inspection prudente des segments où les polypes ont été précédemment retirés. Il serait également intéressant d’explorer le rôle d’un effet de champ, en comparant les caractéristiques histologiques et moléculaires de la muqueuse proche des polypes excisés avec la muqueuse restante. Ces résultats nécessitent des recherches supplémentaires, idéalement par le biais d’un essai prospectif et multicentrique avec une population d’étude plus importante.
1. Giacosa A, Frascio F, Munizzi F. Épidémiologie des polypes colorectaux. Tech Coloproctol 2004;2:s243-7. DOI: 10.1007/s10151-004-0169-y.
2. Ferlay J, Soerjomataram I, Dikshit R, et al. Incidence du cancer et mortalité dans le monde : Sources, méthodes et principales tendances dans GLOBOCAN 2012. Int J Cancer 2014;136(5):E359-86. DOI : 10.1002/ijc.29210.
3. Zauber AG, Winawer SJ, O’Brien MJ, et al. Polypectomie coloscopique et prévention à long terme des décès dus au cancer colorectal. N Engl J Med 2012;366:687-696. DOI : 10.1056/NEJMoa1100370.
4. Brenner H, Chang-Claude J, Seiler CM, et al. Protection contre le cancer colorectal après une coloscopie : Une étude cas-témoins basée sur la population. Ann Intern Med 2011;154:22-30. DOI: 10.7326/0003-4819-154-1-201101040-00004.
5. Baxter N, Goldwasser M, Paszat L, et al. Association de la coloscopie et du décès par cancer colorectal. Annales de médecine interne 2009;150:1-8. DOI: 10.7326/0003-4819-150-1-200901060-00306.
6. Lieberman DA, Rex DK, Sidney JW, et al. Lignes directrices pour la surveillance par coloscopie après résection du cancer : Une mise à jour du consensus de l’American Cancer Society et de la US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2012;143:844-57. DOI: 10.1053/j.gastro.2012.06.001.
7. Pinsky P, Schoen R, Weissfeld J, et al. Le rendement de la coloscopie de surveillance en fonction de l’historique des adénomes et du délai avant l’examen. Clin Gastroenterol Hepatol 2009;7:86-92. DOI: 10.1016/j.cgh.2008.07.014. 9. Brenner H, Chang-Claude J, Jansen L, et al. Cancers colorectaux survenant après une coloscopie avec détection de polypes : Sites des polypes et sites des cancers. Int J Cancer 2013;133:1672-9. DOI : 10.1002/ijc.28166. 10. Martínez ME, Samplier R, Marshall JR, et al. Caractéristiques de l’adénome en tant que facteurs de risque de récidive des adénomes avancés. Gastroenterology 2001;120:1077-83. DOI : 10.1053/gast.2001.23247. 11. Avidan B, Sonnenberg A, Schnell TG, et al. Nouvelle occurrence et récurrence des néoplasmes dans les 5 ans suivant une coloscopie de dépistage. Am J Gastroenterol 2002;97:1524-9. DOI : 10.1111/j.1572-0241.2002.05801.x. 12. Participants à l’atelier de Paris. La classification endoscopique de Paris des lésions néoplasiques superficielles : œsophage, estomac et côlon : Du 30 novembre au 1er décembre 2002. Gastrointest Endosc 2003;58:S3-S43. 13. Schlemper RJ, Riddell RH, Kato Y, et al. La classification de Vienne des néoplasies épithéliales gastro-intestinales. Gut 2000;47:251-5. DOI : 10.1136/gut.47.2.251. 14. Heresbach D, Barrioz T, Lapalus MG, et al. Taux de ratés pour les polypes néoplasiques colorectaux : une étude prospective multicentrique de vidéocoloscopies dos à dos. Endoscopie 2008;40:284-90. DOI : 10.1055/s-2007-995618. 15. Pohl H, Robertson D. Les cancers colorectaux détectés après coloscopie résultent fréquemment de lésions manquées. Clin Gastroenterol Hepatol. 2010;8:858-64. DOI: 10.1016/j.cgh.2010.06.028. 16. Singh H, Nugent Z, Demers AA, et al. Taux et prédicteurs de cancers colorectaux précoces/manquants après coloscopie au Manitoba : une étude basée sur la population. Am J Gastroenterol 2010;105:2588-96. DOI : 10.1038/ajg.2010.390. 17. Schoen RE. Surveillance après des examens de coloscopie positifs et négatifs : questions, rendements et utilisation. Am J Gastroenterol 2003 ; 98:1237-46. 18. Huang Y, Gong W, Su B, et al. Récurrence et surveillance des adénomes colorectaux après polypectomie dans une population du sud de la Chine. J Gastroenterol 2010;45:838-45. DOI: 10.1007/s00535-010-0227-3. 19. Laiyemo AO, Murphy G, Sansbury L, et al. Polypes hyperplasiques et risque de récidive d’adénome dans l’essai Polyp Prevention Trial. Clin Gastroenterol Hepatol 2009;7:192-7. DOI: 10.1016/j.cgh.2008.08.031. 20. Chan TL, Zhao W, Leung SY, et al. Mutations BRAF et KRAS dans les polypes hyperplasiques colorectaux et les adénomes dentelés. Cancer Res 2003;63:4878-81. 21. Spring KJ, Zhao ZZ, Karamatic R, et al. Prévalence élevée d’adénomes dentelés sessiles avec mutations BRAF : Une étude prospective de patients subissant une coloscopie. Gastroenterology 2006;131:1400-7. DOI: 10.1053/j.gastro.2006.08.038. 22. Morimoto LM, Newcomb PA, Ulrich CM, et al. Facteurs de risque pour les polypes hyperplasiques et adénomateux : Evidence for malignant potential ? Cancer Epidemiol Biomarkers Prev 2002;11:1012-8. 23. Snover DC. Mise à jour sur la voie dentelée vers le carcinome colorectal. Hum Pathol 2011;42:1-10. DOI: 10.1016/j.humpath.2010.06.002. 24. Pohl H, Srivastava A, Bensen SP, et al. Résection incomplète de polypes pendant la coloscopie-Résultats de l’étude CARE (complete adenoma resection). Gastroenterology 2013;144:74-80. DOI: 10.1053/j.gastro.2012.09.043. 25. Lazarus R1, Junttila OE, Karttunen TJ, et al. Le risque de néoplasie métachrone chez les patients atteints d’adénome dentelé. Am J Clin Pathol 2005;123:349-59. DOI : 10.1309/VBAGV3BR96N2EQTR. 26. Botteri E, Iodice S, Bagnardi V, et al. Smoking and colorectal cancer : A meta-analysis. JAMA 2008;300:2765-78. DOI : 10.1001/jama.2008.839. 27. Song X, Pukkala E, Dyba T, et al. Indice de masse corporelle et incidence du cancer : L’étude FINRISK. Eur J Epidemiol 2014;29:477-87. DOI: 10.1007/s10654-014-9934-z. 28. Din FV, Theodoratou E, Farrington SM, et al. Effet de l’aspirine et des AINS sur le risque et la survie au cancer colorectal. Gut 2010 ; 59:1670-9. DOI : 10.1136/gut.2009.203000. 29. Koushik A, Hunter DJ, Spiegelman D, et al. Fruits, légumes et risque de cancer du côlon dans une analyse groupée de 14 études de cohorte. J Natl Cancer Inst 2007;99:1471-83. DOI : 10.1093/jnci/djm155.