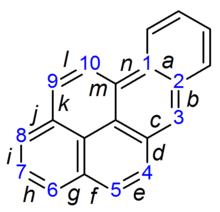
Système nerveuxEdit
L’exposition prénatale du BaP chez les rats est connue pour affecter l’apprentissage et la mémoire dans les modèles de rongeurs. Il a été démontré que les rates enceintes consommant du BaP avaient un effet négatif sur la fonction cérébrale à la fin de la vie de leur progéniture. A un moment où les synapses sont d’abord formées et ajustées en force par l’activité, le BaP a diminué l’activité des cellules nerveuses dépendantes des récepteurs NMDA, mesurée par l’expression de l’ARNm de la sous-unité NR2B du récepteur NMDA.
Système immunitaireEdit
Le BaP a un effet sur le nombre de globules blancs, empêchant certains d’entre eux de se différencier en macrophages, la première ligne de défense du corps pour combattre les infections. En 2016, le mécanisme moléculaire a été découvert comme étant une atteinte à l’intégrité du radeau lipidique de la membrane du macrophage par une diminution du cholestérol membranaire à 25%. Cela signifie que moins d’immunorécepteurs CD32 (membre de la famille des immunorécepteurs Fc) pouvaient se lier aux IgG et transformer le globule blanc en macrophage. Par conséquent, les membranes des macrophages deviennent sensibles aux infections bactériennes.
Système reproducteurEdit
Dans des expériences sur des rats mâles, il a été démontré que l’exposition subchronique au BaP inhalé réduit généralement la fonction des testicules et de l’épididyme avec une production de stéroïdes sexuels/testostérone et une production de sperme plus faibles.
CancérogénicitéEdit
Les métabolites du BaP sont mutagènes et hautement cancérigènes, et il est classé comme cancérigène du groupe 1 par le CIRC. Chemical agents and related occupations, Volume 10, A review of Human Carcinogens, IARC Monographs, Lyon France 2009
En juin 2016, le BaP a été ajouté en tant que benzochrysène à la liste candidate REACH des substances très préoccupantes pour autorisation.
De nombreuses études depuis les années 1970 ont documenté des liens entre le BaP et les cancers. Il a été plus difficile de relier les cancers à des sources spécifiques de BaP, en particulier chez les humains, et difficile de quantifier les risques posés par les différentes méthodes d’exposition (inhalation ou ingestion). Un lien entre la carence en vitamine A et l’emphysème chez les fumeurs a été décrit en 2005 comme étant dû au BaP, qui induit une carence en vitamine A chez les rats.
Une étude de 1996 a fourni des preuves moléculaires reliant les composants de la fumée du tabac au cancer du poumon. Il a été démontré que le BaP provoquait des dommages génétiques dans les cellules pulmonaires qui étaient identiques aux dommages observés dans l’ADN de la plupart des tumeurs pulmonaires malignes.
La consommation régulière de charcuterie a été épidémiologiquement associée à des niveaux accrus de cancer du côlon (bien que cela ne prouve pas en soi la cancérogénicité),Une étude du NCI de 2005 a révélé qu’un risque accru d’adénomes colorectaux était associé à la consommation de BaP, et plus fortement à la consommation de BaP provenant de tous les aliments. Cependant, les aliments eux-mêmes ne sont pas nécessairement cancérigènes, même s’ils contiennent des traces de substances cancérigènes, car le tractus gastro-intestinal se protège contre les carcinomes en se débarrassant continuellement de sa couche externe. En outre, les enzymes de détoxification, comme les cytochromes P450, ont une activité accrue dans l’intestin pour se protéger des toxines d’origine alimentaire. Ainsi, dans la plupart des cas, de petites quantités de BaP sont métabolisées avant de passer dans le sang. Les poumons ne sont protégés d’aucune de ces manières.
Les enzymes de détoxification cytochrome P450 1A1 (CYP1A1) et cytochrome P450 1B1 (CYP1B1) sont à la fois protecteurs et nécessaires pour la toxicité du benzopyrène. Des expériences menées avec des souches de souris modifiées pour éliminer (knockout) le CYP1A1 et le CYP1B1 révèlent que le CYP1A1 agit principalement pour protéger les mammifères contre de faibles doses de BaP, et que l’élimination de cette protection entraîne l’accumulation de fortes concentrations de BaP. À moins que CYP1B1 ne soit également éliminé, la toxicité résulte de la bioactivation du BaP en benzopyrène -7,8-dihydrodiol-9,10-époxyde, le composé toxique ultime,.
Interaction avec l’ADNEdit

À proprement parler, le BaP est un procarcinogène, c’est-à-dire que son mécanisme de cancérogenèse dépend de son métabolisme enzymatique en époxyde de BaP diol. Il s’intercale dans l’ADN, et l’époxyde électrophile est attaqué par les bases guanines nucléophiles, formant un adduit guanine volumineux.

Des études de structure par cristallographie aux rayons X et résonance magnétique nucléaire ont montré comment cette liaison déforme l’ADN en confondant la structure double-hélice de l’ADN. Cela perturbe le processus normal de copie de l’ADN et provoque des mutations, ce qui explique l’apparition de cancers après exposition. Ce mécanisme d’action est similaire à celui de l’aflatoxine qui se lie à la position N7 de la guanine.
Il semble que le benzopyrène diol époxyde cible spécifiquement le gène protecteur p53. Ce gène est un facteur de transcription qui régule le cycle cellulaire et fonctionne donc comme un suppresseur de tumeur. En induisant des transversions de G (guanine) en T (thymidine) dans les points chauds de transversion au sein de p53, il existe une probabilité que le benzopyrène diol époxyde inactive la capacité de suppression des tumeurs dans certaines cellules, ce qui conduit au cancer.
Le benzopyrène-7,8-dihydrodiol-9,10-époxyde est le produit cancérigène de trois réactions enzymatiques :
- Le benzopyrène est d’abord oxydé par le cytochrome P450 1A1 pour former une variété de produits, dont le (+)benzopyrène-7,8-époxyde.
- Ce produit est métabolisé par l’époxyde hydrolase, ouvrant le cycle époxyde pour donner le (-)benzopyrène-7,8-dihydrodiol.
- Le cancérogène ultime est formé après une autre réaction avec le cytochrome P450 1A1 pour donner le (+)benzopyrène-7,8-dihydrodiol-9,10-époxyde. C’est cet époxyde de diol qui se lie de manière covalente à l’ADN.
Le BaP induit le cytochrome P4501A1 (CYP1A1) en se liant à l’AHR (récepteur d’hydrocarbures aryliques) dans le cytosol. Lors de la liaison, le récepteur transformé se transloque dans le noyau où il se dimérise avec l’ARNT (aryl hydrocarbon receptor nuclear translocator) et se lie ensuite aux éléments de réponse aux xénobiotiques (XRE) dans l’ADN situé en amont de certains gènes. Ce processus augmente la transcription de certains gènes, notamment le CYP1A1, puis la production de la protéine CYP1A1. Ce processus est similaire à l’induction du CYP1A1 par certains biphényles polychlorés et dioxines. Apparemment, l’activité du CYP1A1 dans la muqueuse intestinale empêche des quantités importantes de benzopyrène ingéré de passer dans le sang portal et la circulation systémique. L’expression intestinale, mais pas hépatique, du CYP1A1 dépend du récepteur 2 de type TOLL (TLR2), qui est un récepteur eucaryote pour les structures de surface bactériennes telles que l’acide lipotéichoïque.
De plus, on a constaté que le BaP active un transposon, LINE1, chez l’homme.