Introduction
Selon l’Organisation mondiale de la santé, le cancer est la deuxième cause de décès dans le monde.1 Les progrès considérables et continus des traitements ont permis d’augmenter la survie des patients atteints de cancer, mais les effets indésirables de la chimiothérapie, notamment sur le cœur, sont une cause importante de mortalité et de morbidité. La mortalité chez les patients cancéreux qui développent une cardiomyopathie induite par les anthracyclines est élevée (plus de 60 % à deux ans),2 mais le pronostic peut être amélioré par une détection précoce et une prévention.
Les anthracyclines telles que la doxorubicine, la daunorubicine, l’épirubicine, la mitoxantrone et l’idarubicine sont les médicaments de chimiothérapie les plus couramment utilisés dans le cancer. Ils sont une cause connue de cardiotoxicité (tableau 1), avec des effets aigus ou/et subaigus qui peuvent se manifester par des modifications électrocardiographiques, des arythmies ventriculaires et supraventriculaires, des troubles de la conduction cardiaque (bloc auriculo-ventriculaire ou de branche), dysfonctionnement ventriculaire, élévation du peptide natriurétique de type cérébral (BNP, marqueur d’une précharge accrue et d’une insuffisance cardiaque), myocardite et péricardite, et qui peuvent survenir à tout moment entre le début du traitement et deux semaines après la fin du traitement. Ces effets sont relativement peu fréquents et la plupart réapparaissent une semaine après l’arrêt du traitement. La cardiomyopathie chronique est définie comme précoce si elle commence dans l’année qui suit la fin de la chimiothérapie et comme tardive après cette période. Dans les deux cas, on observe une dysfonction systolique ou diastolique (tableau 2) qui peut évoluer vers une cardiomyopathie sévère et même conduire au décès.3 Bien que certaines études aient suggéré que le risque de développer une dysfonction ventriculaire et sa sévérité peuvent être prédits sur la base d’une lésion myocardique aiguë,4 la relation entre toxicité aiguë et chronique n’est pas totalement comprise. Le diagnostic de la dysfonction cardiaque induite par le traitement anticancéreux a fait l’objet de diverses études,3,5 dont l’une5 est considérée comme la publication de référence sur le sujet, et se base sur les symptômes de l’HF, l’examen physique et les paramètres de la fonction ventriculaire gauche.
Cardiotoxicité, pharmacocinétique et utilisation thérapeutique des anthracyclines.
| Mécanismes d’action | Mécanismes de cardiotoxicité | Anthracycline | Utilisation thérapeutique | Cardiotoxicité |
|---|---|---|---|---|
| La formation d’un complexe d’ADN par conjugaison d’anneaux plats avec des nucléotides inhibe la synthèse de l’ADN et de l’ARN et des protéines. Cela déclenche le clivage de l’ADN par la topoisomérase II, entraînant une cytotoxicité. Les anthracyclines inhibent l’hélicase, empêchant le clivage enzymatique du double brin d’ADN et interférant ainsi avec la réplication et la transcription. Elles provoquent des réactions d’oxydoréduction par la formation de radicaux libres cytotoxiques. |
Mécanismes principaux : – dommages à l’ADN médiés par la topoisomérase II bêta – peroxydation lipidique – stress oxydatif – apoptose et nécrose des cellules cardiaques Imparement de la synthèse de l’ADN, de l’ARN et des protéines et des facteurs de transcription impliqués dans la régulation des gènes spécifiques du cœur. Equilibre négatif des protéines sarcomériques dans les cellules cardiaques causé par une réduction de l’expression des protéines et une augmentation de la dégradation des myofilaments. La thérapie combinée exacerbe la perte des myofilaments. Les dommages à l’ADN mitochondrial et les changements dans la bioénergétique mitochondriale. Dérèglement de la régulation dynamique de la fonction cardiaque, altérant l’activité adrénergique et adénylyl cyclase et l’homéostasie du calcium. |
Doxorubicine | Cancer de l’estomac avancé Cancer de la vessie Cancer du sein Cancer ovarien Cancer du poumon à petites cellules Cancer de la thyroïde Maladie de Hodgkin Leucémie aiguë Lymphome non hodgkinien .Lymphome hodgkinien Neuroblastome Sarcome Tumeur de Wilms |
Aiguë : Hypotension Arrythmies Tachycardie Thromboembolie Subaiguë: Péricardite Myocardite Chronique : Cardiomyopathie dilatée Dysfonctionnement contractile Insuffisance cardiaque congestive |
| Daunorubicine | Leucémie lymphoblastique aiguë Leucémie myéloïde aiguë |
Aiguë : Tachycardie sinusale Tachyarythmies Extasystoles ventriculaires Bloc AV Chronique : Cardiomyopathie dilatée Dysfonctionnement contractile Insuffisance cardiaque congestive |
||
| Epirubicine | Cancer de l’ovaire avancé Cancer de l’estomac Cancer du sein Cancer du poumon |
Aiguë : Tachycardie ventriculaire Bloc AV Bloc de branche Bradycardie Thromboembolie Chronique : Cardiomyopathie dilatée Dysfonctionnement contractile Insuffisance cardiaque congestive |
||
| Idarubicine | Leucémie lymphocytaire aiguë Leucémie myéloïde aiguë |
Aiguë : Arrythmies Fibrillation auriculaire Infarctus du myocarde Thromboembolie Chronique : Cardiomyopathie dilatée Dysfonctionnement contractile Insuffisance cardiaque congestive |
||
| Mitoxantrone | Cancer du sein avancé Leucémie myéloïde aiguë de l’adulte Lymphome non hodgkinien |
Aiguë : Arrythmies Myocardite Hypertension Ischémie myocardique Chronique: Cardiomyopathie dilatée Dysfonctionnement contractile Insuffisance cardiaque congestive |
AV : atrioventriculaire.
Adapté de 24,58,59.
Critères pour confirmer ou réviser un diagnostic préliminaire de dysfonctionnement cardiaque induit par la chimiothérapie, selon le comité de révision et d’évaluation cardiaque.
Un seul de ces critères suffit à confirmer un diagnostic de dysfonctionnement cardiaque.
Cardiomyopathie caractérisée par une diminution de la FEVG cardiaque qui est soit globale, soit plus sévère dans le septum
Symptômes d’ICC
Détection d’un galop S3, d’une tachycardie ou des deux ;
Déclin de la FEVG d’au moins 5 % à moins de 55 % avec des signes ou des symptômes d’ICC accompagnant, ou déclin de la FEVG d’au moins 10 % à moins de 55 % sans signes ou symptômes accompagnant.
CHF : insuffisance cardiaque congestive ; FEVG : fraction d’éjection ventriculaire gauche.
Adapté de 3,60.
Une proposition de classification divise la cardiomyopathie induite par la chimiothérapie en deux types : le type I, causé par les anthracyclines, qui induisent des lésions cardiaques dose-dépendantes irréversibles, et le type II, causé par le trastuzumab, qui n’est pas lié à la dose cumulée et est souvent réversible après l’arrêt du traitement6. Le second type ne sera pas abordé dans cet article de synthèse.
Dans cette revue, les auteurs discutent des stratégies chez les patients traités par anthracyclines afin de prévenir ou d’atténuer leurs principaux effets indésirables sur le cœur.
Évaluation initiale
Au vu de la cardiotoxicité des anthracyclines, tous les patients orientés vers une chimiothérapie devraient subir une évaluation cardiaque afin d’établir leurs caractéristiques cardiovasculaires de base, qui pourront ensuite être utilisées pendant le régime de traitement à des fins de comparaison. Cette évaluation doit comprendre une anamnèse clinique et un examen physique, une électrocardiographie pour déterminer le rythme cardiaque et détecter les signes d’ischémie, et une imagerie cardiaque, généralement une échocardiographie transthoracique avec étude Doppler complète (tableaux 3 et 4). Lorsque l’échocardiographie ne fournit pas suffisamment d’informations, l’imagerie par résonance magnétique cardiaque (IRMC) est recommandée. Les taux de troponine de base doivent également être mesurés pour des comparaisons futures.5
Protocole d’échocardiographie recommandé en cardio-oncologie.
Échocardiographie transthoracique standard
– Conformément aux directives de l’ASE/EAE et de l’IAC-Echo
Acquisition d’imagerie de déformation 2D
– Apicale 3, 4, et 2chambres
– Acquisition de ≥3 cycles cardiaques
– Images obtenues simultanément en maintenant la même fréquence d’images 2D et la même profondeur d’imagerie
Fréquence d’images entre 40 et 90 images/s ou ≥40% de la FC
– VTI aortique (temps d’éjection aortique)
. temps d’éjection)
Analyse d’imagerie de déformation 2D
– Quantifier la déformation longitudinale segmentaire et globale
– Afficher les courbes de déformation segmentaire à partir de vues apicales dans un format quadruple
– Afficher la déformation globale dans un tracé en œil de bœuf
.œil de bœuf
Pièges de l’imagerie de déformation 2D
– Ectopie
– Translation respiratoire
Acquisition d’imagerie 3D
– Volume complet de la 4e chambre apicale pour évaluer les volumes du ventricule gauche.chambre complète pour évaluer les volumes du VG et calculer la FEVG
– Battements uniques et multiples optimisant la résolution spatiale et temporelle
Rapport
– Moment de l’échocardiographie par rapport à la perfusion IV (nombre de jours avant ou après)
– Signes vitaux (PA, HR)
– Méthode de Simpson 3D LVEF/2D biplan
– GLS (machine d’échocardiographie, logiciel et version utilisés)
– En l’absence de GLS, mesure de la s′ médiane et latérale et MAPSE
– RV : TAPSE
Adapté de 5.
2D : bidimensionnel ; 3D : tridimensionnel ; ASE/EAE : American Society of Echocardiography/European Association of Echocardiography ; BP : pression artérielle ; GLS : global longitudinal strain ; HR : fréquence cardiaque ; IAC-Echo : Intersocietal Accreditation Commission Echocardiography ; IV : intraveineux ; LV : ventriculaire gauche ; LVEF : fraction d’éjection du ventricule gauche ; MAPSE : excursion systolique du plan annulaire mitral ; RV : ventricule droit ; TAPSE : excursion systolique du plan annulaire tricuspide ; VTI : intégrale vitesse-temps.
Évaluation échocardiographique de la fonction systolique et diastolique chez le patient cancéreux.
Fonction systolique du VG
– L’échocardiographie est la méthode de choix pour l’évaluation des patients avant, pendant et après un traitement anticancéreux.
– Le calcul précis de la FEVG doit être effectué avec la meilleure méthode disponible dans le laboratoire d’échocardiographie (idéalement 3DE).
– Lors de l’utilisation de la 2DE, la technique de Simpson biplan modifiée est la méthode de choix.
– La FEVG doit être associée au calcul de l’indice de score de mouvement de paroi.
– En l’absence de SLG par STE, il est recommandé de quantifier la fonction longitudinale du LV en utilisant MAPSE et/ou la vitesse systolique maximale (s′) de l’anneau mitral par TDI à ondes pulsées.
– La FEVG évaluée par 2DE échoue souvent à détecter de petits changements dans la contractilité du LV.
Fonction diastolique
– Bien que les paramètres diastoliques ne se soient pas avérés être pronostiques de la cardiomyopathie induite par les anthracyclines, une évaluation conventionnelle de la fonction diastolique du VG, y compris la gradation de la fonction diastolique et l’estimation non invasive des pressions de remplissage du VG, devrait être ajoutée à l’évaluation de la fonction systolique du VG, selon les recommandations de l’ASE/EAE pour l’évaluation de la fonction diastolique du VG par échocardiographie.
Adapté de 5.
2DE : échocardiographie bidimensionnelle ; 3DE : échocardiographie tridimensionnelle ; ASE/EAE : American Society of Echocardiography/European Association of Echocardiography ; GLS : global longitudinal strain ; LV : ventriculaire gauche ; FEVG : fraction d’éjection ventriculaire gauche ; STE : échocardiographie à suivi de taches ; TDI : imagerie Doppler tissulaire.
Surveillance pendant le traitement
Il est important de surveiller les signes et symptômes de cardiotoxicité pendant la chimiothérapie (tableau 5). L’électrocardiogramme à 12 dérivations peut être utilisé de manière systématique pour dépister les arythmies dues à la cardiotoxicité liée aux anthracyclines, tandis que la surveillance Holter de 24 heures ou un enregistreur d’événements peut être utile pour rechercher l’étiologie d’une syncope présumée résulter d’une arythmie ou d’un bloc auriculo-ventriculaire avancé.7 La fonction cardiaque doit être surveillée par échocardiographie chez les patients sous traitement par anthracyclines. La déformation longitudinale globale (SLG) évaluée par le speckle tracking bidimensionnel est un prédicteur plus sensible de l’HF que la fraction d’éjection du ventricule gauche (FEVG),8 étant donné qu’au cours d’un traitement par anthracycline, les modifications de la SLG précèdent la réduction de la FEVG.5 Cependant, dans la pratique clinique, le raccourcissement fractionnel et la FEVG sont les paramètres les plus utilisés,9 bien que le raccourcissement fractionnel s’avère moins fiable dans ce contexte. Ces paramètres, qui dépendent de la précharge et de la postcharge, sont moins sensibles pour la détection précoce des maladies cardiaques précliniques. Diverses études ont suggéré que l’évaluation de la fonction diastolique par échocardiographie Doppler peut permettre une détection précoce de la cardiomyopathie induite par les anthracyclines.10,11 Si la FEVG est Tableau 6), et/ou si les troponines sont élevées, une consultation en cardiologie doit être envisagée, avec une discussion entre le cardiologue et l’oncologue sur le rapport risques/bénéfices de la chimiothérapie.5 Une baisse de la FEVG pendant un traitement par anthracycline est associée à un risque accru d’événements cardiaques, et bien qu’une réduction de 15 % de la FEVG soit susceptible d’indiquer une cardiotoxicité.5 L’étude doit être répétée deux à trois semaines après l’étude de base pour confirmer le diagnostic. L’IRMC peut détecter des changements subtils dans le myocarde et des augmentations du volume extracellulaire, qui suggèrent un œdème ou une fibrose diffuse. Bien qu’elle soit très sensible et reproductible pour l’évaluation de la fonction cardiaque et la caractérisation du tissu myocardique, l’IRMC présente les inconvénients d’une disponibilité limitée et d’un coût élevé.12 L’angiographie aux radionucléides est reproductible et plus facilement disponible, mais elle expose les patients à des rayonnements ionisants, ce qui augmente leur dose cumulative, en particulier lorsque des études en série sont nécessaires, et ne fournit que des informations limitées sur la fonction diastolique et la morphologie de la valve, et ne doit donc pas être la méthode de choix.12 La biopsie endomyocardique présente une sensibilité et une spécificité supérieures pour la détection et le suivi des effets indésirables des anthracyclines,5 permettant de visualiser la perte de myofibrilles, la vacuolisation du cytoplasme, la dilatation du réticulum sarcoplasmique, l’augmentation du nombre de lysosomes et le gonflement des mitochondries.12 Cependant, la nature invasive de la procédure limite son utilisation en pratique clinique. Les biomarqueurs ont été validés dans diverses études ; ils sont spécifiques non seulement pour détecter les lésions cardiovasculaires mais aussi pour déterminer leur étendue et leur réversibilité. Alors que les troponines T et I sont des indicateurs de dommages aux cardiomyocytes, le BNP et la partie N-terminale du pro-BNP (NT-proBNP) reflètent un stress myocardique accru13,14. Selon la littérature, l’élévation des troponines est un indicateur précoce de cardiotoxicité, tandis que le BNP est moins constant.
Avantages et inconvénients des examens diagnostiques dans l’évaluation de la cardiotoxicité induite par les anthracyclines.
| Examen diagnostique | Avantages | Inconvénients | |
|---|---|---|---|
| Electrocardiographie | Non invasive Faible coût Mesure l’intervalle QT, dont l’allongement est un marqueur connu de cardiotoxicité |
Ne mesure pas la FEVG Variabilité intra- et inter-observateur dans la mesure de l’intervalle QT |
|
| Échocardiographie Doppler | Non invasive Faible coût Évaluation de la diastolique fonctionnelle et morphologique (débit veineux pulmonaire, rapport E/A, temps de relaxation isovolumique) et systolique (épaississement de la paroi pendant la systole, FEVG, raccourcissement fractionnel), structure de la valve et péricarde |
Variabilité intra- et inter-observateur Mesure de la FEVG sujette à variabilité et dépendante de la qualité de l’image Valeur prédictive douteuse pour la détection précoce de lésions subcliniques |
|
| Doppler tissulaire. imagerie | Excellente résolution temporelle Détection précoce des lésions subcliniques (en combinaison avec des marqueurs d’inflammation et de stress oxydatif) Évaluation fonctionnelle des pressions de remplissage (rapport E/e′), des vélocités, déformation et vitesse de déformation des parois ventriculaires en systole et en diastole Détection de la dysfonction diastolique isolée |
Analyse plus chronophage | .temps |
| Traçage des déformations/spéculations en 2D et GLS | Supérieur à la FEVG pour prédire la mortalité cardiovasculaire dans la population générale Meilleure stratification du risque chez les patients atteints d’HF Apte à reconnaître une dysfonction précoce du VG chez les patients atteints d’HF. de reconnaître un dysfonctionnement précoce du ventricule gauche chez les patients soumis à un traitement cardiotoxique Reproductible lorsqu’il est effectué par un opérateur expérimenté |
Dépend fortement de la qualité de l’image de l’échocardiographie 2D Manque d’essais cliniques à long terme évaluant la capacité de la FEVG à prédire la mortalité cardiovasculaire.long terme évaluant la capacité du GLS à prédire les chutes persistantes de la FEVG ou l’HF symptomatique |
|
| Échocardiographie de stress | Évaluation de la réserve contractile myocardique | Semi-invasive Données controversées et limitées sur la détection précoce de la cardiotoxicité |
|
| Angiographie aux radionucléides | Haute reproductibilité Faible variabilité intra- et inter-.observateur Validé pour la mesure de la FEVG |
Rayonnement ionisant faible résolution spatiale et temporelle Sous-estime les volumes ventriculaires Sous-estime la FEVG dans les petits ventricules (femmes et enfants) Ne permet pas d’évaluer la fonction valvulaire Peu d’informations sur la fonction diastolique Valeur prédictive limitée pour la détection précoce des lésions subcliniques et des changements de la FEVG |
|
| Imagerie par résonance magnétique | Reproductible Pas de rayonnement ionisant Évaluation de la perfusion et de la fonction myocardique et du péricarde, et détection des masses myocardiques Utilisable chez les patients dont la qualité de l’image échocardiographique est médiocre Norme d’excellence pour le calcul des volumes du VG et de la FEVG Séquences T2 : détecte les changements segmentaires ou globaux de la teneur en eau du myocarde résultant d’une inflammation ou de dommages microvasculaires ou myocytaires Séquences T1 : fournit des informations sur les lésions myocardiques et la fibrose ; avec un contraste au gadolinium, détecte les altérations histopathologiques, y compris la vacuolisation intracellulaire, permettant de prédire la diminution ultérieure de la FEVG Renforcement tardif : détection de la fibrose myocardique associée à un mauvais pronostic chez les patients atteints de coronaropathie, de cardiomyopathie hypertrophique et de maladie infiltrante |
Coût élevé Disponibilité limitée Contraindication chez les patients porteurs de dispositifs incompatibles avec la résonance magnétique (stimulateurs cardiaques, dispositifs de resynchronisation cardiaque et défibrillateurs cardioverteurs implantables) Risque de néphrotoxicité du contraste chez les patients souffrant d’insuffisance rénale (GFR |
|
| Tomographie par ordinateur | Image à hauterésolution Identifie les calcifications ou épaississements péricardiques chez les patients subissant une radiothérapie ou une chirurgie Visualise et évalue les calcifications des artères coronaires |
Rayonnement ionisant Calcification coronaire documentée. avant une thérapie anticancéreuse n’est pas prédictive du risque CV chez les patients subissant une chimiothérapie aux anthracyclines Peu utilisé pour la détection et la surveillance des changements subcliniques de la fonction cardiaque |
|
| Scintigraphie | Non-invasive Évaluation fonctionnelle et structurelle |
Radiation ionisante Disponibilité limitée Faible résolution temporelle Données limitées |
|
| Biomarqueurs | Non invasive Faible variabilité inter-observateur Évaluation de la fonction CV et des signes potentiels de lésions cardiaques Promettant une détection précoce des lésions myocardiques |
Valeur prédictive indéterminée | |
| Biopsie endomyocardique | Détecte des preuves histologiques de lésions cardiaques, y compris la perte de myofibrilles, la vacuolisation du cytoplasme, la dilatation du réticulum sarcoplasmique, augmentation du nombre de lysosomes et gonflement des mitochondries | Invasif L’interprétation histologique nécessite des connaissances spécialisées Aucune information fonctionnelle Résultats limités par la quantité et la qualité de l’échantillon de biopsie |
|
| Évaluation des dommages endothéliaux | Autres paramètres de cardiotoxicité tels que les cytokines, les molécules d’adhésion et l’épaisseur intima-média de l’artère carotide | Valeur prédictive indéterminée | |
| Analyse génétique | Minimalement invasive Évalue la susceptibilité individuelle à la cardiotoxicité |
Valeur prédictive indéterminée. |
Adaptation de 5,12,61.
2D : bidimensionnel ; CAD : coronaropathie ; CV : cardiovasculaire ; ECG : électrocardiographie ; GFR : débit de filtration glomérulaire ; GLS : global longitudinal strain ; HF : insuffisance cardiaque ; LV : ventriculaire gauche ; LVEF : fraction d’éjection ventriculaire gauche.
Valeurs normales de la déformation longitudinale globale selon le vendeur du scanner, le sexe et l’âge.
| Age (années) | |||||||
|---|---|---|---|---|---|---|---|
| 0-19 | 20-29 | 30-.39 | 40-49 | 50-59 | ≥65 | p | |
| V1 | |||||||
| Globale | -22.1±2.4 | -21.2±1.9 | -21.1±2.1 | -21.4±2.0 | -21.0±2.2 | -20.3±1.9 | 0.0218 |
| Homme | -21.7±3.1 | -20,9±1,9 | -20,6±1,9 | -20,9±1,8 | -21,0±1,9 | -19,7±1,4 | 0,1982 |
| Femme | -22,4±1,6 | -22.3±1.6 | -22.8±1.8 | -22.6±2.1 | -23.3±1.9 | -20.9±2.1 | 0.0348 |
| p (homme vs. femme) | 0.4292 | 0.0316 | 0,0178 | 0,0029 | 0,1381 | ||
| V2 | |||||||
| Globale | -19.9±2.5 | -19.0±2.1 | -19.5±2.2 | -18.2±2.5 | -17.6±2.5 | -16.7±2.1 | |
| Homme | -19.4±2.7 | -18.8±2.0 | -19.1±2.3 | -17.9±2.8 | -16.9±2.3 | -15.8±1.4 | 0.0019 |
| Femme | -20.5±2.2 | -20.6±2,3 | -20,2±2,0 | -19,3±0,9 | -20,4±1,5 | -17,3±2,3 | 0,0002 |
| p (homme vs femme) | 0,1349 | 0.0248 | 0,1083 | 0,4316 | 0,0294 | 0,0928 | |
| V3 | |||||||
| Globale | -21.4±1,7 | -20,2±2,1 | -20,4±2,3 | -19,4±2,2 | -18,5±2,6 | -17,8±2,8 | |
| Homme | -21.6±2.0 | -20.2±2.0 | -20.4±2.2 | -19.8±2.3 | -18.7±2.6 | -16.3±3.1 | |
| Femme | -21.2±1,5 | -20,2±2,4 | -20,4±2,8 | -18,7±1,8 | -18,3±2,8 | -18,6±2,3 | 0,0141 |
| p (homme vs. femme) | 0,6076 | 0,9787 | 0,9201 | 0,1415 | 0,7374 | 0,0668 | |
V1 : Vivid 7 ou Vivid E9 (GE Healthcare) ; V2 : iE33 (Philips Medical Systems) ; V3 : Artida ou Apilo (Toshiba Medical Systems).
Adapté de 62.
Si la dose d’anthracyclines dépasse 240 mg/m2, une évaluation cardiaque doit être répétée avant d’administrer d’autres cycles (figure 1).
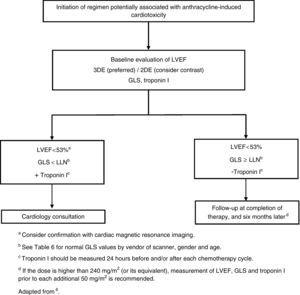
Initiation d’un régime potentiellement associé à une cardiotoxicité induite par les anthracyclines. 2DE : échocardiographie bidimensionnelle ; 3DE : échocardiographie tridimensionnelle ; GLS : déformation longitudinale globale ; LLN : limite inférieure de la normale ; LVEF : fraction d’éjection ventriculaire gauche.
Prévention de la cardiotoxicité
La prévention de la cardiotoxicité induite par les anthracyclines, tout en maintenant l’efficacité thérapeutique des médicaments, peut être réalisée par des moyens pharmacologiques et non pharmacologiques.
Prévention non pharmacologique
Les facteurs de risque cardiovasculaire doivent être identifiés et traités de manière appropriée dès le diagnostic du cancer. Les patients doivent être encouragés à adopter un mode de vie sain, notamment un régime pauvre en graisses saturées et un maximum de 2,5 g de sodium par jour, à éviter les substances toxiques comme l’alcool et le tabac, et à maintenir leur indice de masse corporelle proche de 25 kg/m2. L’exercice, qu’il soit de faible ou de forte intensité, pendant un traitement aux anthracyclines, augmente la réserve cardiovasculaire15 et des études sur des modèles animaux ont indiqué qu’il pouvait réduire les effets cardiotoxiques de ces agents.16 Bien que l’exercice se soit révélé prometteur pour améliorer la fonction cardiopulmonaire chez les survivantes du cancer du sein,17,18 aucun essai clinique chez l’homme n’a confirmé son rôle cardioprotecteur. Une autre mesure consiste à réduire ou à éviter l’utilisation de médicaments qui prolongent l’intervalle QT, en particulier les antagonistes de la 5-hydroxytryptamine 3 (fréquemment utilisés pour prévenir les effets indésirables de la chimiothérapie, notamment les nausées et les vomissements) et les antihistaminiques19,20. Il est également important de minimiser l’exposition aux radiations, de corriger les perturbations électrolytiques et de traiter les comorbidités (tableau 7).21
Facteurs de risque de cardiotoxicité induite par les anthracyclines.
| Doses cumulées supérieures à : | Maximum recommandé (mg/m2)a : | |
| Doxorubicine | 400-550 | |
| Daunorubicine | 550-800 | |
| Epirubicine | 900-…1000 | |
| Idarubicine | 150-225 | |
| Mitoxantrone | 100-140 | |
| Pré-existante | Diabète | |
| Maladie coronarienne | ||
| Maladie vasculaire périphérique | ||
| Hypertension | ||
| Prédisposition génétique : sexe féminin, race noire | ||
| Radiation médiastinale antérieure ou concomitante | ||
| Administration en bolus intraveineux | ||
| Combinaison avec d’autres agents dont le cyclophosphamide, trastuzumab ou paclitaxel | ||
| Durée depuis la fin de la chimiothérapie | ||
| Perturbations électrolytiques : hypocalcémie, hypomagnésémie | ||
| Hémochromatose (mutation C282Y) | ||
| Hyperthermie | ||
| Maladie du foie | ||
CV : cardiovasculaire.
Les patients âgés de plus de 65 ans et les enfants peuvent développer une cardiotoxicité avec des doses cumulatives plus faibles.
Adapté de 12,24.
La diminution de la dose d’anthracyclines est un autre moyen de réduire l’incidence de la dysfonction systolique ventriculaire gauche (DSTG), comme le montre une étude portant sur des patients prenant 400, 500 ou 550 mg/m2 de doxorubicine, dans laquelle l’incidence de l’HF congestive était respectivement de 5 %, 16 % et 26 %22. Bien que les anthracyclines semblent être cardiotoxiques indépendamment de la dose administrée, plusieurs études ont montré que la perfusion continue de doses plus faibles pendant 24 à 92 heures23 peut réduire la gravité des lésions cardiaques, et a été décrite comme un moyen efficace d’y parvenir.24 La prolongation de la durée de perfusion réduit la cardiotoxicité sans compromettre l’efficacité de la chimiothérapie,25 mais une perfusion de plus de 96 heures est associée à une incidence élevée de stomatite. Le seul cas où la perfusion continue de doxorubicine ne semble pas avoir d’effet cardioprotecteur par rapport à la perfusion rapide est celui des enfants atteints de leucémie lymphoblastique aiguë (LLA).26 D’autres essais cliniques utilisant la biopsie endomyocardique pour évaluer les lésions cardiaques induites par les anthracyclines dans différents régimes médicamenteux ont conclu que la perfusion continue entraîne des dommages beaucoup moins importants que l’administration intraveineuse rapide.27 Ces essais ont également montré que les patients recevant une perfusion continue avaient une meilleure tolérance à des doses cumulatives plus élevées de doxorubicine. Bien que les études animales aient démontré que les concentrations d’anthracyclines dans les tissus tumoraux étaient les mêmes quelle que soit la manière dont les médicaments étaient administrés (perfusion continue ou rapide), cela n’était pas vrai pour les tissus cardiaques, dans lesquels une perfusion rapide entraînait des concentrations plus élevées et donc une plus grande toxicité28.
Prévention pharmacologiqueAntioxydants
Bien que les antioxydants neutralisent les radicaux libres formés par le traitement aux anthracyclines et donc théoriquement réduisent ou préviennent la cardiotoxicité, les essais cliniques de la N-acétylcystéine, du coenzyme Q, de la L-carnitine, des phénéthylamines, de l’amifostine et d’une combinaison de vitamines E et C et de N-acétylcystéine n’ont pas montré d’effet cardioprotecteur29. Il a été démontré que l’érythropoïétine et l’iloprost30 protègent contre les effets cardiotoxiques de la doxorubicine in vitro, sans affecter son efficacité anticancéreuse, mais leur capacité cardioprotectrice devra être démontrée in vivo.
Les formulations liposomales
Une façon de combattre les effets cardiaques indésirables des anthracyclines est de modifier la formulation des médicaments, par exemple en les encapsulant dans des liposomes.31 Des études comparant la doxorubicine non encapsulée et la doxorubicine encapsulée dans des liposomes n’ont trouvé aucune différence dans le taux de réponse antitumorale, la survie globale ou la survie sans progression, mais l’incidence de l’HF et de la LVSD était plus faible chez les patients traités par la formulation liposomale, et ce groupe présentait également une incidence plus faible d’autres effets indésirables, notamment la neutropénie, les nausées, les vomissements et la diarrhée32. En raison de leur coût élevé, ces formulations ne sont pas largement utilisées et la Food and Drug Administration (FDA) américaine n’a approuvé leur utilisation que pour le cancer de l’ovaire, le sarcome de Kaposi lié au sida et les patients atteints de myélome multiple qui n’ont pas répondu à un an de traitement avec d’autres médicaments33.
Dexrazoxane
L’administration de dexrazoxane en concomitance avec des traitements anticancéreux peut avoir un effet cardioprotecteur, en prévenant l’élévation des troponines et en réduisant l’incidence de l’HF.34 Certains auteurs attribuent l’effet cardioprotecteur de ce chélateur du fer à sa réduction de la quantité de fer intracellulaire, ce qui peut diminuer la génération de radicaux libres induite par la doxorubicine.34 Cependant, des études sur d’autres chélateurs du fer n’ont pas démontré de cardioprotection.35,36 Il a également été suggéré que l’effet cardioprotecteur du dexrazoxane est dû non seulement à son antagonisme de la formation du complexe de clivage de la topoisomérase II, mais aussi à son induction de la dégradation rapide de la topoisomérase II bêta, ce qui suggère que cette enzyme est impliquée dans la cardiotoxicité induite par les anthracyclines.37 Une étude sur le dexrazoxane chez plus de 200 enfants atteints de LAL a montré qu’il réduisait l’élévation de la troponine T chez les deux sexes,38 et qu’il limitait la réduction du raccourcissement fractionnel et maintenait le rapport épaisseur/dimension du ventricule gauche à cinq ans, mais uniquement chez les filles.39 Récemment, trois cas ont été signalés d’adultes soumis à une chimiothérapie associée au dexrazoxane pour un cancer du sein et qui ont développé une leucémie myéloïde aiguë. Cependant, deux études comparant le dexrazoxane à un placebo chez des enfants atteints de LAL suivis pendant cinq et dix ans n’ont montré aucune différence dans l’incidence de la malignité secondaire.40,41 Néanmoins, compte tenu de ses effets indésirables connus, la FDA et l’Agence européenne des médicaments ont restreint l’utilisation du dexrazoxane aux patients adultes atteints d’un cancer du sein avancé ou métastatique qui ont déjà reçu une dose cumulative de doxorubicine de plus de 300 mg/m2 et qui bénéficieront d’un traitement supplémentaire par anthracycline.42
Bêta-bloquants
La cardioprotection offerte par les bêta-bloquants (BB) semble provenir de leurs propriétés antioxydantes et anti-apoptotiques. Un BB, le carvédilol, s’est montré particulièrement prometteur dans la réduction de l’incidence de la cardiomyopathie induite par les anthracyclines et dans la préservation des fonctions systolique et diastolique.43 Chez les enfants, le carvédilol a limité l’élévation de la troponine I et a amélioré à la fois le raccourcissement fractionnel et la tension systolique globale maximale.44 Selon certaines études, les BB et les inhibiteurs de l’enzyme de conversion de l’angiotensine (ECA) (voir ci-dessous) peuvent prévenir le remodelage associé à l’HF en réduisant la réponse adrénergique.45,46 Cependant, aucun effet cardioprotecteur n’a été observé avec le métoprolol ou l’énalapril.47
Inhibiteurs de l’enzyme de conversion de l’angiotensine et antagonistes des récepteurs de l’angiotensine
Les inhibiteurs de l’ECA et les antagonistes des récepteurs de l’angiotensine (ARA) présentent des propriétés cardioprotectrices, probablement en réduisant le stress oxydatif, le remodelage du ventricule gauche et l’apoptose.48 Administré pendant au moins deux ans après l’arrêt de la chimiothérapie chez des enfants atteints de DAVG induite par les anthracyclines, l’énalapril n’a montré aucun avantage en termes de réduction du stress de la paroi endo-systolique du ventricule gauche ou de préservation du raccourcissement fractionnel.49 En revanche, chez des adultes traités par des anthracyclines à forte dose, l’énalapril a prévenu l’HF et l’aggravation des paramètres de la fonction cardiaque, tels que la FEVG.50 Des études menées sur des souris knockout pour le récepteur de l’angiotensine II de type I ont montré que la doxorubicine n’avait pas d’effet cardiotoxique chez ces animaux et que l’administration d’ARA pouvait prévenir la cardiomyopathie induite par la daunorobucine48. Bien qu’à notre connaissance, il n’y ait eu que deux essais randomisés sur les ARA chez les patients sous chimiothérapie, il a été démontré que le valsartan prévenait l’allongement aigu du QT corrigé, la dilatation diastolique du ventricule gauche et l’élévation du BNP pendant une semaine de chimiothérapie, sans toutefois avoir d’effet sur la FEVG,51 et que le telmisartan prévenait la réduction de la vitesse de déformation maximale pendant un traitement par anthracycline à forte dose.52 D’autres études sont nécessaires avec un suivi plus long pour confirmer ces effets.
Statines
Les statines ont des propriétés antioxydantes et anti-inflammatoires.53 Des études sur des modèles animaux démontrent que la fluvastatine atténue la cardiotoxicité induite par les anthracyclines, en réduisant le stress oxydatif et en augmentant l’expression de l’enzyme antioxydante superoxyde dismutase 2 mitochondriale, ce qui entraîne une réduction de l’inflammation cardiaque.53 Dans un essai clinique évaluant l’effet d’un traitement continu par statine chez des patientes atteintes d’un cancer du sein et recevant une chimiothérapie à base d’anthracycline, les patientes recevant des statines présentaient une incidence plus faible d’HF.54 Dans une autre étude menée chez des patientes ayant une FEVG antérieurement normale et subissant une chimiothérapie à base d’anthracycline, la FEVG était inchangée à six mois chez celles traitées par atorvastatine, contre une chute de 8 % dans le groupe témoin55.
Enfin, il faut souligner qu’il n’y a pas encore de preuves solides de l’efficacité de la prévention pharmacologique de la cardiomyopathie induite par les anthracyclines, et donc la principale stratégie préventive reste une évaluation cardiovasculaire préalable approfondie des patients et une surveillance, une sélection et un ajustement appropriés des doses de chimiothérapie.
Traitement de l’insuffisance cardiaque
Après l’apparition de signes ou de symptômes d’HF ou d’une réduction de la FEVG due à une cardiotoxicité liée à la chimiothérapie, le traitement doit être basé sur les directives actuelles56. Bien que le choix de la meilleure thérapie soit évidemment important, une étude a montré que le principal facteur déterminant la réussite du traitement est le délai entre la fin de la chimiothérapie et le début du traitement de l’HF, car si ce délai est supérieur à six mois, il est peu probable que la FEVG se rétablisse complètement.57
Perspectives d’avenir
Plusieurs essais cliniques sont actuellement en cours visant à évaluer diverses stratégies thérapeutiques, pharmacologiques et non pharmacologiques, pour la prévention de la cardiomyopathie induite par les anthracyclines (tableau 8). Il faudra attendre quelques années avant d’en connaître les résultats, et il existe toujours un besoin pressant de directives fondées sur des données probantes pour l’évaluation et la surveillance clinique de ces patients.
Essais cliniques sur la prévention de la cardiomyopathie induite par les anthracyclines.
| Auteur principal et n° ClinicalTrials.gov. | Type d’essai | Condition | Agent(s) de chimiothérapie | Intervention | No. de patients | Suivi | Mesure de résultat primaire | Conclusion prévue de l’essai |
|---|---|---|---|---|---|---|---|---|
| Mavrudis D NCT01120171 |
Randomisé, phase 2 | Cancer du sein | Anthracyclines | Cyclophosphamide vs. doxorubicine encapsulée dans un liposome | 48 | 4 ans | Taux de réponse global par CT ou IRM | mai 2015 |
| Campbell K NCT02006979 |
Simple aveugle, phase 2 | Cancer du sein | Anthracyclines | Un épisode aigu d’exercice physique effectué 24 heures avant chaque perfusion d’anthracycline. | 24 | 1 an | GLS | Décembre 2015 |
| Cipolla C NCT01968200 |
Randomisé, phase 3 | Cancer | Anthracyclines | Enalapril après apparition d’une lésion cardiaque vs. énalapril concomitant à la chimiothérapie | 268 | Jusqu’à un an après la fin de la chimiothérapie | Niveaux de troponine cardiaque | Juillet 2016 |
| Virani S NCT01708798 |
Double aveugle, phase 2, 3 | Cancer du sein | Anthracyclines | Eplérénone vs. placebo | 78 | 6 mois | Changement dans le LVDF | mai 2015 |
| Bocchi E NCT01724450 |
Double aveugle, phase 3 | Cancer du sein | Anthracyclines | Carvédilol vs. placebo | 200 | 2 ans | LVSD (réduction de 10% de la FEVG) | Octobre 2016 |
| Livi L NCT02236806 |
Simple aveugle, phase 3 | Cancer du sein | Anthracyclines et trastuzumab | Bisoprolol vs. ramipril, bisoprolol vs. placebo, ramipril vs. placebo | 480 | 1 an | LVEF | novembre 2017 |
| Smith K NCT02096588 |
Randomisé, phase 2 | Cancer du sein | Anthracyclines | Simvastatine | 90 | 5 ans | GLS | Avril 2021 |
CT : Tomographie assistée par ordinateur ; GLS : déformation longitudinale globale ; LVDF : fonction diastolique du ventricule gauche ; LVEF : fraction d’éjection du ventricule gauche ; LVSD : dysfonction systolique du ventricule gauche ; IRM : imagerie par résonance magnétique.
Conclusion
L’allongement de la survie des patients sous traitement anticancéreux et l’augmentation conséquente de l’incidence de la cardiomyopathie induite par les anthracyclines signifient qu’il est nécessaire d’étudier et de déterminer les mécanismes précis conduisant aux effets cardiaques indésirables, afin de les prévenir. La poursuite des recherches permettra d’établir des plans de prévention spécifiques et validés.
Conflits d’intérêts
Les auteurs n’ont aucun conflit d’intérêts à déclarer.