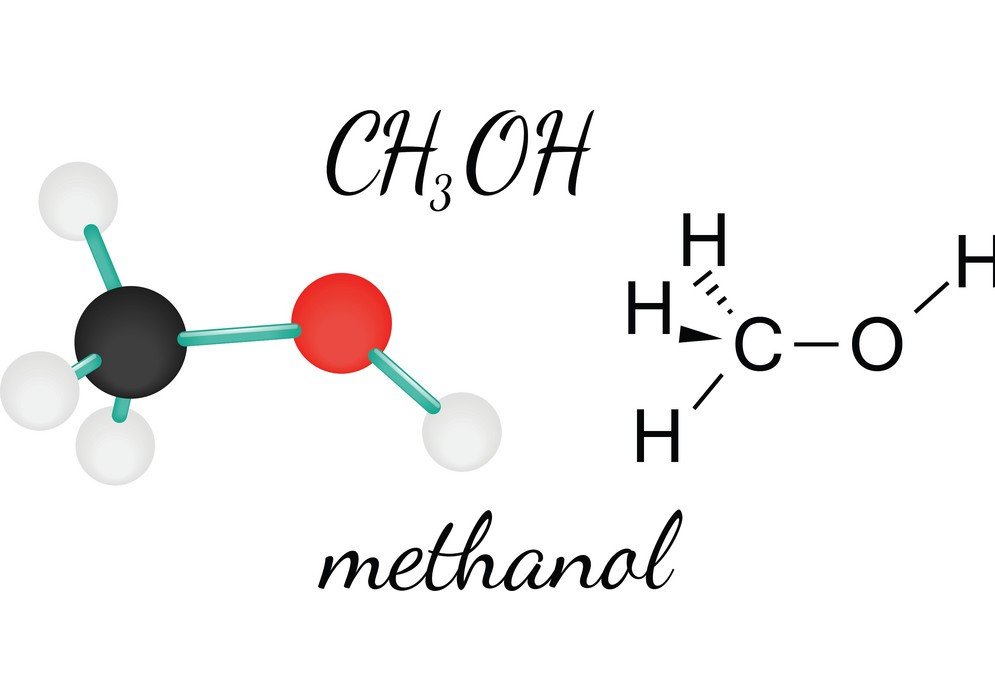
CH3OH ou Méthanol est un liquide inflammable, incolore et volatil qui a une odeur alcoolique distinctive. En étudiant son Méthanol, on peut arriver à connaître la forme moléculaire, l’angle de liaison et la polarité de la molécule. La polarité du CH3OH est l’une des caractéristiques essentielles car elle permet de connaître les autres propriétés du composé, telles que sa solubilité, ses charges électriques, et bien d’autres encore. Pour comprendre la polarité du méthanol, regardons d’abord les angles de liaison et la disposition des atomes dans la molécule de CH3OH.

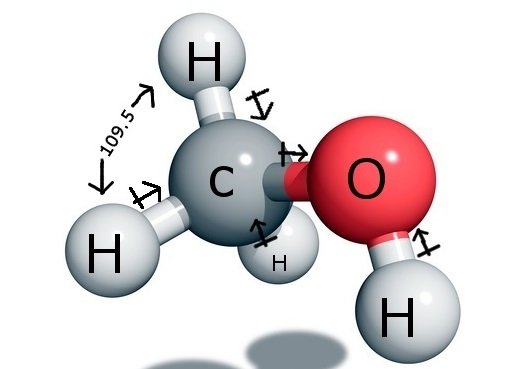
CH3OH Angles de liaison
L’atome de carbone central forme quatre liaisons dans le composé, trois avec l’atome d’hydrogène et une avec le groupe hydroxyle ( OH). Et comme cet atome de carbone a une hybridation sp3 et forme un tétraèdre, il a les angles de liaison de 109,5 degrés avec ses atomes de liaison.
En revanche, l’Oxygène forme une liaison sigma mais a deux paires solitaires, il y a donc une courbure de son angle de liaison due aux forces de répulsion paire liée-paire solitaire. Cela diminue l’angle de liaison à 104,5 degrés.
Donc le carbone a un angle de liaison de 109,5 degrés avec les trois atomes d’hydrogène et un angle de liaison de 104,5 degrés avec le groupe hydroxyle.
Est-ce que CH3OH est polaire?
La polarité de tout composé donné dépend du moment dipolaire net sur le composé. Ce moment dipolaire net peut être connu en remarquant les charges électriques sur les atomes de la molécule. Ici, les deux atomes de carbone et d’oxygène (qui sont considérés comme les centres géométriques de ce composé) dans le méthanol sont des atomes électronégatifs. Mais l’oxygène est plus électronégatif que le carbone ou l’hydrogène dans le composé.
CH3OH ne peut pas être non-polaire car il y a une différence de charges électriques entre les atomes de la molécule de méthanol. L’oxygène a plus de densité électronique en raison de ses deux paires d’électrons solitaires. Cela provoque un dipôle net pointant vers l’atome d’oxygène, ce qui rend CH3OH polaire.
En dehors des charges électriques, la molécule de CH3OH est asymétrique, ce qui annule la possibilité de non-polarité. Une molécule non polaire a une structure symétrique, car le moment dipôle-dipôle est annulé. Mais comme il y a une courbure dans la forme du méthanol, cela conduit à la formation d’une structure asymétrique, ce qui entraîne l’extrémité négative du moment dipôle électrique net vers l’atome d’oxygène. Ainsi, CH3OH est une molécule polaire.
Maintenant que nous connaissons la polarité de la molécule de CH3OH, passons en revue certaines de ses propriétés physiques :
- Le point d’ébullition du méthanol ( CH3OH) est de 64,7 °C.
- Le point de fusion du méthanol est de -97,6 °C.
- Le poids moléculaire du méthanol est de 32,04 g/mol.
- C’est un solvant polaire et il est également connu sous le nom d’alcool de bois car il était autrefois produit par la distillation du bois.
- L’odeur de ce composé est du côté plus doux par rapport à l’éthanol.
Utilisations du CH3OH
- Le méthanol est également utilisé pour la production d’hydrocarbures et pour la synthèse d’autres produits chimiques tels que le formaldéhyde.
- Il est utilisé comme antigel dans les tuyaux.
- Le CH3OH est également utilisé comme additif pour l’essence dans plusieurs pays en raison de son faible point de fusion.
- Le composé est également utilisé comme carburant dans la combustion des moteurs internes.
- De nombreuses entreprises pharmaceutiques utilisent le méthanol pur pour la synthèse d’autres composés.
J’espère que cet article vous aidera à comprendre la polarité de la molécule et ses propriétés physiques et utilisations. CH3OH est une molécule polaire car le moment dipôle-dipôle ne s’annule pas en raison de sa forme asymétrique.