08 août 2019
Mentionnez ApoE et Alzheimer, et la conversation tourne autour de l’allèle E4, le gène de susceptibilité le plus fort pour la maladie. Mais l’ApoE a une autre facette, l’ApoE2. Bien que cette isoforme protège contre la maladie d’Alzheimer, les scientifiques l’ont à peine étudiée. Aujourd’hui, l’ApoE2 fait l’objet d’un examen minutieux, car les scientifiques se demandent exactement comment certaines personnes conservent leur acuité mentale jusqu’à un âge avancé. Lors de la conférence internationale de l’Alzheimer’s Association, qui s’est tenue du 14 au 18 juillet à Los Angeles, une étude des génotypes de l’ApoE dans 5 000 cas de maladie d’Alzheimer confirmés par autopsie a révélé que les personnes possédant deux copies de l’ApoE2 voient leur risque de démence chuter de 90 % par rapport aux personnes possédant le génotype commun E3/E3. D’autres travaux ont suggéré que cela pourrait être dû au fait que l’ApoE2 réduit la pathologie amyloïde et tau, et augmente le volume de matière grise dans les régions critiques du cerveau. Les bénéfices de l’ApoE2 semblent spécifiques à la maladie d’Alzheimer, et non génériques à la neurodégénérescence.
L’ApoE est la principale protéine porteuse de cholestérol dans le cerveau. Elle est étudiée depuis sa découverte en tant que gène de risque de la MA au début des années 1990, mais elle apparaît depuis peu comme une plaque tournante des réponses gliales au dépôt d’agrégats amyloïdes et tau (actualité août 2018 ; actualité sept 2017). Le gène existe sous la forme de trois allèles polymorphes – E2, E3 et E4 – avec une fréquence mondiale de 8 %, 78 % et 14 %, respectivement. Plusieurs formes mutées sont également connues, par exemple les mutations dites de Heidelberg, Pittsburgh et Christchurch (Feussner et al., 1992 ; Kamboh et al., 1999 ; Wardell et al., 1987).
L’ApoE4 reçoit de loin la plus grande attention des chercheurs sur la MA, car il multiplie le risque de MA par 15 selon la population étudiée, et se retrouve chez 40 % des personnes atteintes de MA. L’allèle E2, l’allèle protecteur, n’a pas fait l’objet d’une grande attention, car il est le moins fréquent des trois et est largement absent des échantillons de personnes atteintes de la maladie d’Alzheimer. Les personnes possédant une copie de l’allèle E2 ont deux fois moins de risques de développer la maladie d’Alzheimer que celles possédant le génotype E3/E3, plus courant. Mais l’E2 supplémentaire a-t-il un effet au-delà de cela ? « Nous ne savions pas si la dose de E2 présente un risque différentiel, c’est-à-dire si le risque de E2/2 est significativement plus faible que celui de E2/3 », a déclaré Eric Reiman en présentant l’étude.
Pour le savoir, Reiman et ses collègues du Banner Alzheimer’s Institute, Phoenix, Gyungah Jun de l’Université de Boston, Joseph Arboleda du Massachusetts Eye and Ear, Yakeel Quiroz du Massachusetts General Hospital et ses collègues du AD Genetics Consortium ont décidé d’examiner les données de nombreux cerveaux. Ils ont analysé la contribution des trois allèles ApoE au risque de démence et à la pathologie dans 5 007 cerveaux de l’ADGC. Cet échantillon comprenait 4 018 cas de démence d’Alzheimer confirmés par autopsie, ainsi que 989 donneurs non affectés sur le plan pathologique et cognitif. En plus de fournir un nombre suffisant pour étudier les homozygotes E2/E2, cette cohorte permet d’éviter le problème de confusion lié aux erreurs de diagnostic en éliminant les démences qui ne sont pas dues à la MA, ainsi que les personnes qui présentaient une pathologie de la MA au moment du décès mais pas de démence.
Comme prévu, les homozygotes ApoE2 étaient rares – ils n’étaient que 24 sur plus de 5 000 personnes, soit 0,5 %. Par rapport aux autres génotypes, ils étaient beaucoup moins susceptibles d’être atteints de la MA. Les homozygotes E2 représentaient 0,1 % des cas mais 1,9 % des témoins sains. En revanche, les homozygotes ApoE4/4 représentaient 15,6 % des cas et seulement 1 % des témoins. En d’autres termes, 19 des 24 ApoE2/2 étaient en bonne santé cognitive, mais seulement 10 des 633 ApoE4/4 l’étaient.
Les homozygotes E2 présentaient une réduction du risque de 66 % par rapport même aux porteurs de E2/3, une réduction du risque de 87 % par rapport au génotype le plus courant, E3/3, et une énorme réduction du risque de 99,6 % par rapport aux personnes qui étaient E4/4. En fait, la plupart des personnes porteuses du gène E4/4 sont atteintes de démence d’Alzheimer, alors que peu de personnes porteuses du gène ApoE 2/2 le sont.
Le fait de posséder deux allèles E2 est corrélé avec une pathologie moindre de la plaque amyloïde et de l’enchevêtrement neurofibrillaire tau. L’effet protecteur de l’ApoE2 sur la pathologie tau était encore apparent même après ajustement pour la charge de la plaque amyloïde. Cela reflète les données animales récentes suggérant que l’ApoE4 agit pour aggraver la pathologie tau indépendamment de l’amyloïde (Shi et al., 2017).
La principale conclusion de la nouvelle étude fait écho à celle d’une étude précédente menée par Pieter-Jelle Visser, de l’Université de Maastricht, aux Pays-Bas, et ses collègues. Ils avaient trouvé 16 porteurs d’ApoE2/2 dans un échantillon de 7 583 personnes, dont 10 étaient cognitivement normaux et amyloïdes négatifs, alors que 301 des 386 porteurs d’ApoE4/4 de l’échantillon étaient atteints de démence d’Alzheimer. Cet échantillon n’a toutefois pas été confirmé par pathologie (Jansen et al., 2015).
Quelle est l’importance de la confirmation par neuropathologie ? Reiman et al. ont comparé les estimations de risque dérivées de la cohorte vérifiée par autopsie à celles calculées à partir d’une cohorte de 23 857 personnes vivantes qui ont été diagnostiquées cliniquement comme ayant une démence probable de la MA ou étant cognitivement normales, et dont le statut amyloïde était inconnu. Dans cette analyse, l’effet protecteur du 2/2 et l’augmentation du risque due au 4/4 ont tous deux été sous-estimés. Par exemple, les scientifiques ont constaté que le rapport de cotes associé à E4/E4 par rapport à E3/E3 dans l’échantillon clinique était de 10,7, contre 31,22 dans les cas confirmés par la pathologie. Les effets de dose pour E2 et E4 étaient également sous-estimés dans l’échantillon vivant. Ainsi, l’analyse de l’autopsie fournit des estimations de risque actualisées, et probablement plus précises, pour tous les génotypes ApoE, estiment Reiman et ses collègues, au moins pour ces participants à la recherche blancs non hispaniques.
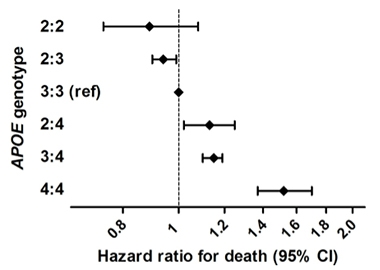
Prolongation de la vie. Dans une vaste étude épidémiologique combinant six cohortes de population de personnes d’ascendance européenne, les homozygotes ApoE2 avaient un risque de décès plus faible que les autres génotypes. Les homozygotes ApoE4 présentaient le plus grand risque.
On sait que l’impact de l’ApoE sur la maladie d’Alzheimer diffère selon les groupes ethniques. Ce type d’étude est nécessaire avec des sujets plus diversifiés, plus d’homozygotes E2/2, et en tenant compte des effets possibles des allèles ApoE sur la survie, ce qui pourrait fausser les résultats. Néanmoins, Reiman a déclaré : « Nos résultats suggèrent que l’homozygotie ApoE2 est associée à un risque exceptionnellement faible de MA, que l’impact de l’APOE et de ses variants sur le risque de MA est significativement plus important que ce qui avait été précédemment apprécié, et qu’il y a une raison impérieuse de découvrir des traitements qui favorisent cet effet protecteur. »
Ceci rejoint les résultats récents de Sudha Seshadri, Université de la santé du Texas, San Antonio, Frank Wolters, Centre médical Erasmus, Rotterdam, Pays-Bas, et ses collègues. Ils ont trouvé un avantage de survie pour les porteurs d’ApoE2 dans une étude portant sur 38 537 personnes provenant de six cohortes basées sur la population (Wolters et al., 2019). Ils ont identifié 239 homozygotes E2, qui ont mené les vies les plus longues. L’effet de E2 n’était que partiellement expliqué par ses effets sur les lipides sanguins ou les maladies vasculaires. Les homozygotes E4 présentaient le risque de décès le plus élevé, ce qui s’explique en grande partie par son association avec la démence. Seshadri a déclaré à Alzforum que les chercheurs examineront la MA et les changements cognitifs, ainsi que les mesures TEP de l’amyloïde et du tau dans cet échantillon.
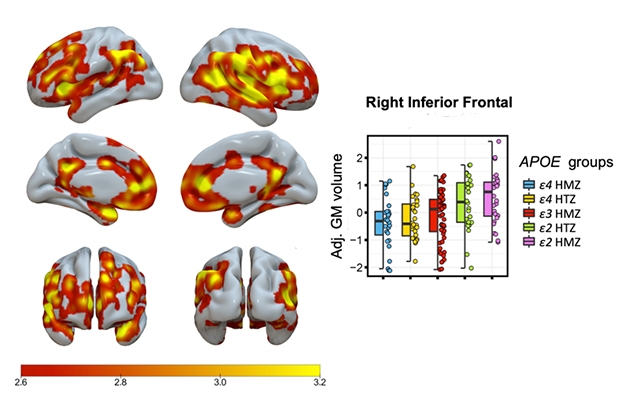
Bit by Bit. L’ombrage indique les zones présentant une augmentation significative par étapes, liée au génotype ApoE, du volume de la matière grise, les homozygotes E4/4 présentant le volume le plus faible et les E2/2 le plus élevé. Le graphique montre les données pour une région du cerveau.
Comment l’ApoE2 pourrait-elle conférer de la résilience ? Pour le savoir, Gemma Salvadó, du Centre de recherche sur le cerveau de Barcelonaβeta, en Espagne, a présenté une étude dans laquelle elle et ses coauteurs ont rassemblé des données d’imagerie provenant de différents échantillons sur autant d’homozygotes ApoE2 âgés que possible. Leur objectif était de comparer la structure cérébrale des E2/2 avec celle des autres génotypes ApoE.
Auparavant, E2 avait été lié à des changements subtils de la morphologie cérébrale chez des personnes en bonne santé, notamment une atrophie hippocampique plus lente à un âge avancé, et des hippocampes plus grands à un âge moyen (Chiang et al., 2010 ; Fennema-Notestine et al., 2011). Dans l’enfance, les porteurs du gène E2 auraient des cortex entorhinal plus épais que les homozygotes E3 ou les porteurs du gène E4 (Shaw et al., 2007). Mais ces études se sont toutes concentrées sur des personnes ayant une copie de E2.
Pour savoir ce que ferait ce E2 supplémentaire, Salvadó a recueilli et analysé des données d’IRM sur des personnes sans déficience cognitive dans l’étude ALFA à Barcelone (Molinuevo et al. 2016), la cohorte du centre médical universitaire d’Amsterdam, les études d’imagerie en accès libre OASIS et ADNI. Elle a trouvé 28 homozygotes E2/E2. Elle a apparié chacun d’eux avec cinq autres sujets du même centre sur l’âge, le sexe et le niveau d’éducation, et un de chaque autre génotype ApoE. Cela a donné un total de 168 sujets, avec un âge moyen de 62 ans.
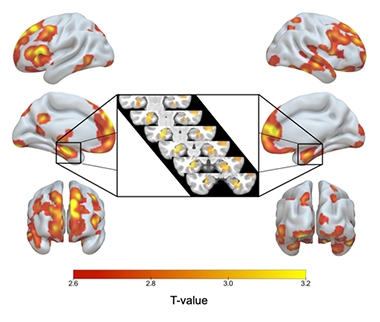
ApoE2/2 sur 3/3. L’ombrage rouge à jaune indique les régions du cerveau où les homozygotes ApoE2 avaient plus de matière grise que les homozygotes E3, y compris les deux hippocampes (encart).
Par rapport à leurs homologues E3/3, les E2/2 avaient un volume de matière grise plus important dans leurs hippocampes et dans d’autres zones de signature de la MA, notamment le cortex temporal médian, le temporal inférieur, le pôle temporal, le précuneus et les régions pariétales supérieures. Les homozygotes E2 avaient également plus de matière grise dans les zones liées à la résilience cognitive dans le vieillissement, à savoir dans les zones cingulaires antérieures et préfrontales médianes (Arenaza-Urquijo et al., 2019 ; Harrison et al., 2018). Par rapport aux hétérozygotes E2/3, les homozygotes E2 se targuaient de peu de différences significatives en matière grise, mais ils avaient des hippocampes encore plus grands que les 2/3.
Salvadó a rapporté une augmentation progressive, liée au génotype, du volume de la matière grise, les homozygotes E4/4 ayant le volume le plus faible, les E3/3 un volume intermédiaire, les E2/3 un volume plus élevé et les E2/2 un volume plus important (voir image ci-dessous).

ApoE2/2 sur 2/3. Par rapport au génotype protecteur suivant, ApoE2/3, les homozygotes E2 ont plus de matière grise seulement dans quelques petites zones.
Elle pense que la matière grise plus importante dans les zones stratégiques du cerveau pourrait aider les homozygotes E2 à faire face à la pathologie de la MA, si et quand elle apparaît. Comme l’ApoE2 gonfle le cortex entorhinal dès l’enfance, la résilience pourrait découler des processus de développement, a-t-elle ajouté.
« Ce sont des résultats très importants », a commenté Reiman. « Ils suggèrent que si l’atrophie est comme l’érosion de la bande de roulement des pneus, les homozygotes E2 peuvent commencer avec plus de bande de roulement », a-t-il ajouté. Salvadó essaie d’étendre l’étude pour examiner plus d’homozygotes provenant de cohortes supplémentaires, et d’autres modes d’imagerie.
Terry Goldberg, Université Columbia, New York, étudie depuis des années les mécanismes potentiels de la neuroprotection médiée par l’ApoE2 (Conejero-Goldberg et al., 2014). Lors de l’AAIC, Goldberg a présenté des résultats sur la relation entre les allèles ApoE et la neuropathologie dans la MA, et a étendu l’analyse à d’autres maladies.
Il a utilisé des données sur 1 557 cerveaux de la base de données du National Alzheimer’s Coordinating Center qui avaient des évaluations cliniques et neuropathologiques. Comme il avait si peu d’homozygotes E2, Goldberg a regroupé les génotypes E2/E2 et E2/E3, pour un échantillon de 130 personnes. Dans ce groupe combiné, un cerveau sur quatre présentait des modifications neuropathiques de la MA, contre 40 % des E3/3, 65 % des E3/4 et 85 % des E4/4. Conformément aux travaux antérieurs, les porteurs d’E2 présentaient la pathologie amyloïde la plus légère, le moins de plaques neuritiques et la pathologie tau la plus légère. Une analyse de médiation statistique a suggéré que l’association de l’ApoE2 avec la réduction des enchevêtrements passait en partie par son effet sur l’amyloïde, et était en partie indépendante de l’amyloïde. Cela concorde avec les résultats de Reiman.
Dans cet ensemble de données également, l’ApoE2 a fortement protégé, même si Goldberg n’a pas analysé les homozygotes : E2 a réduit de moitié le risque de pathologie amyloïde et tau par rapport à E3, et de 90 % par rapport à E4.
Quel est le plus puissant, E2 ou E4 ? En comparant les génotypes E2/E4 et E3/E4, Goldberg a trouvé des niveaux comparables de pathologie. Au contraire, la paire E2/E4 était pire. Cela suggère que l’E4 écrase les effets protecteurs de l’E2. « On pourrait dire que l’E4 est toxique », a conclu le Dr Goldberg. Cela suggère que les thérapies utilisant des constructions virales pour introduire E2 dans le tissu cérébral exprimant E4 pourraient ne pas être utiles, a-t-il dit.
Qu’en est-il des autres maladies neurodégénératives ?
La littérature offre des résultats mitigés sur E2 et E4 dans la démence frontotemporale. Certaines études suggèrent que E2 favorise le risque (nouvelles de mars 2016) tandis que d’autres le créditent d’une protection et imputent le risque à E4 (Mishra et al., 2017). À l’AAIC, Goldberg a signalé que E2 était associé à une pathologie TDP-43 plus sévère parmi 103 cas de démence fronto-temporale, et à une pathologie tau plus importante dans 28 cas de maladie de Pick et 51 cas de paralysie supranucléaire progressive. Il a averti que ces chiffres sont si faibles que les résultats pourraient être faussés. Goldberg ne sait pas si ces patients présentaient des mutations de C9ORF72 ou de progranuline, et l’accumulation de TDP-43 peut être associée à l’âge. Dans les cas de pathologie à l’α-synucléine, Goldberg a constaté que l’ApoE4 favorise, et que l’E2 réduit, la propagation de la pathologie à corps de Lewy en dehors de son origine dans le mésencéphale, dans les zones limbiques et néocorticales
Ensemble, ces études mettent en évidence une nouvelle appréciation de l’énorme impact que l’ApoE exerce sur la pathogenèse de la MA (par exemple, voir Wu et Zhao, 2016). La protection profonde offerte par E2 va probablement raviver l’intérêt des développeurs de médicaments, qui ont déjà essayé et échoué, mais qui pourraient maintenant juger bon de revisiter cette cible.-Pat McCaffrey
Citations de l’actualité
- ApoE : Un coupable microglial commun dans le vieillissement, la maladie d’Alzheimer et la tauopathie ? 11 août 2018
- L’ApoE4 aggrave tout ce qui concerne Tau, du début à la fin 20 septembre 2017
- Et Tu, ApoE2 ? Un article affirme que l’allèle augmente le risque de démence dans la SLA 1 mars 2016
Citations d’articles
- Feussner G, Funke H, Weng W, Assmann G, Lackner KJ, Ziegler R.Hyperlipoprotéinémie sévère de type III associée à un phénotype inhabituel de l’apolipoprotéine E1 et au génotype epsilon 1/ « nul ». Eur J Clin Invest. 1992 Sep;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST.Une nouvelle mutation dans le gène de l’apolipoprotéine E (APOE*4 Pittsburgh) est associée au risque de maladie d’Alzheimer à début tardif. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoprotéine E2-Christchurch (136 Arg—-Ser). Nouvelle variante de l’apolipoprotéine E humaine chez un patient atteint d’hyperlipoprotéinémie de type III. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.ApoE4 exacerbe de façon marquée la neurodégénérescence médiée par la protéine tau dans un modèle murin de tauopathie. Nature. 2017 Sep 28;549(7673):523-527. Epub 2017 Sep 20 PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Prévalence de la pathologie amyloïde cérébrale chez les personnes sans démence : une méta-analyse. JAMA. 2015 May 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE investigators.The impact of APOE genotype on survival : Results of 38,537 participants from six population-based cohorts (E2-CHARGE). PLoS One. 2019;14(7):e0219668. Epub 2019 Jul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .Taux d’atrophie hippocampique et biomarqueurs CSF chez les sujets âgés normaux APOE2. Neurologie. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.La présence de l’allèle ApoE ε4 est associée à un cortex frontal plus mince à l’âge moyen. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN.Morphologie corticale chez les enfants et les adolescents présentant différents polymorphismes du gène de l’apolipoprotéine E : une étude observationnelle. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.The ALFA project : Une plateforme de recherche pour identifier les caractéristiques physiopathologiques précoces de la maladie d’Alzheimer. Alzheimers Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3 PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P.La signature cérébrale métabolique de la résilience cognitive chez les 80+ : au-delà des pathologies d’Alzheimer. Brain. 2019 Apr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ.Morphologie cérébrale, cognition et β-amyloïde chez les adultes plus âgés avec des performances de mémoire supérieures. Neurobiol Aging. 2018 Jul;67:162-170. Epub 2018 Mar 27 PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE.APOE2 améliore la neuroprotection contre la maladie d’Alzheimer par de multiples mécanismes moléculaires. Mol Psychiatry. 2014 Feb 4 ; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium.Gene-based association studies report genetic links for clinical subtypes of frontotemporal dementia. Brain. 2017 Apr 5 ; PubMed.
- Wu L, Zhao L.ApoE2 et la maladie d’Alzheimer : il est temps de regarder de plus près. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
Lecture complémentaire
Aucune lecture complémentaire disponible
.