Voici les étapes que je suis lorsque je dessine une structure de Lewis.
1. Décidez quel est l’atome central de la structure. Ce sera normalement l’atome le moins électronégatif (# »C « #).
2. Dessinez une structure squelette dans laquelle les autres atomes sont liés par une liaison simple à l’atome central:
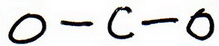
3. Dessinez une structure d’essai en mettant des paires d’électrons autour de chaque atome jusqu’à ce que chacun obtienne un octuor.
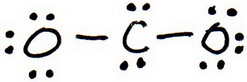
4. Comptez les électrons de valence dans votre structure d’essai (20).
5. Maintenant, comptez les électrons de valence que vous avez réellement disponibles. #1 « C » + 2 « O » = 1×4 + 2×6 = 16#.
La structure d’essai a quatre électrons de trop.
Nous devons insérer soit une triple liaison, soit deux doubles liaisons.
6. Dessinez de nouvelles structures d’essai, cette fois en insérant les liaisons supplémentaires.
Il y a trois possibilités :
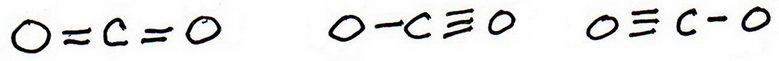
7. Comme précédemment, ajoutez des électrons de valence pour donner à chaque atome un octuor :
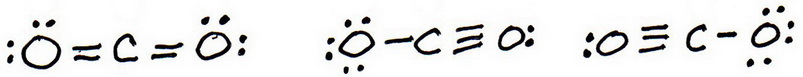
8. Calculez la charge formelle de chaque atome :
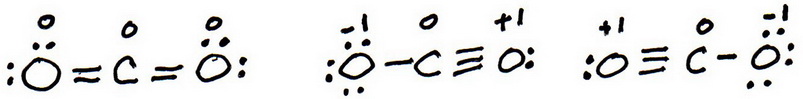
9. La « meilleure » structure de Lewis est celle qui a le moins de charges formelles.
La première structure n’a pas de charges formelles, donc la meilleure structure de Lewis pour # »CO »_2# est

.